超声造影对肾占位病变的诊断效能分析 (附31例报告)
徐长松 陈静 周闪 牛晓兵 穆正青 张晓丹 徐明
肾肿瘤是泌尿系统较常见的肿瘤之一,多为恶性,且发病率正逐年上升。肾良性肿瘤以血管平滑肌脂肪瘤最常见,肾恶性肿瘤以肾细胞癌最常见,约占 85%,病理类型有肾透明细胞癌、肾嫌色细胞癌及肾乳头状细胞癌等,以肾透明细胞癌最多见,占70%~80%。肾肿瘤的良恶性很难鉴别,大多数肾肿瘤的症状不典型[1],且发病较晚,确诊时肿瘤多已发生转移,预后较差。因此,早期确定肾占位性病变的性质是个体化治疗方案制定和预测预后的关键[2]。
目前,超声检查是肾占位性病变的最佳成像方式,并且已广泛应用于肿瘤的早期筛查和常规检查中[3]。超声检查能够清晰显示肾脏及病变的形状、结构及血液供应。CT则存在电离辐射、造影剂肾毒性、无法实时动态观察及价格昂贵等缺点,且在显示较小肿瘤的微血管方面较差[4-5]。
近几年,以微气泡作为基础造影剂的超声造影(contrast-enhanced ultrasound, CEUS)这一相对新颖的检查方式,在肾占位良恶性的诊断及鉴别诊断中发挥了重要作用[6]。CEUS可以实时、动态地观察病灶周围及内部微血管的灌注情况,具有实时、可重复、无肾毒性、无电离辐射等优点[7]。本研究对31例肾占位性病变的CEUS特征进行了比较分析,旨在探讨CEUS在肾脏占位性病变良恶性鉴别诊断中的临床价值。
对象与方法
一、研究对象
选取2015年6月至2016年12月于我院行常规超声和CEUS检查的肾脏占位性病变患者31例作为研究对象,其中男17例、女14 例,年龄24~78岁,平均年龄(53.68±13.25)岁,中位年龄55岁。
二、仪器与方法
1.仪器与试剂:TWICE超声诊断仪,探头频率3.0~5.0 MHz(百胜)。造影剂声诺维(SonoVue)[意大利Bracco(博莱科)公司]。
2.方法:患者取仰卧位或侧卧位,扫查过程中指导患者平静呼吸,先行常规二维超声检查,观察并记录病变部位、大小、形态、境界及内部回声等;再行彩色多普勒超声检查,探测病变有无血流信号,并获取频谱;最后切换至CEUS模式进行检查。使用造影剂前将5 ml生理盐水注入瓶中并轻轻摇匀,不要用力摇晃,防止微泡破裂,并在6 h内用完。造影剂采用团注的方式,在2~3 s内将1.2 ml(根据患者体重、身高和年龄确定剂量)造影剂注入肘前静脉,然后快速推注生理盐水5 ml。同步开始录像并计时,实时观察病变的灌注过程和回声强度的变化。连续观察5 min,播放视频,由2位经验丰富的超声医师进行分析,包括注射造影剂后病变增强方式、达到峰值强度(与周围肝脏、肾实质比较)和肿瘤增强特征等。根据肾肿瘤的常规超声和CEUS图像进行良恶性分类,并与病理检查结果进行对比。
3.成像描述:肾脏的血流与肝脏不同,肾皮质含有大量的血管结构,其血流量约占整个肾脏的 90%,所以在造影过程中不会表现出典型的肝脏三时相。依据其自身特点,通常将肾脏CEUS成像分为如下三个时相:皮质期或动脉期(8~35 s)、髓质期(36~120 s)和延迟期(120 s至微泡消失)[5-6]。与肾皮质造影剂充填相比较,如果病变充填早于肾皮质,称为“快进”,较肾皮质晚则为“慢进”;同理,如果廓清早于肾皮质则为“快退”,晚于肾皮质为“慢退”[7]。
三、统计学方法
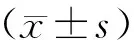
结 果
所有患者均经术后病理检查得以证实,6例良性肿瘤患者中,1例因术前诊断考虑恶性可能而行根治性切除术,其余均行肿瘤剜除术;24例恶性肿瘤中,除1例肾乳头状细胞癌行肿瘤剜除术、1例肾嫌色细胞癌行肾部分切除术外,其余均行根治性切除术;1例特殊类型的血管周上皮样细胞肿瘤行根治性切除术。病理检查结果显示,31例中19例为肾透明细胞癌、2例为肾乳头状细胞癌、2例为肾嫌色细胞癌、1例为肾集合管癌、1例为颗粒细胞癌、6例为肾血管平滑肌脂肪瘤、1例为左肾血管周上皮样细胞肿瘤。其中有1例为肾透明细胞癌合并乳头状癌。肾占位性病变的超声特征见表1、图1、2。
患者的年龄、性别以及肿瘤的大小、位置、居肾脏的部位、形态、境界、回声均匀性、开始显影时间、消退时间和彩色多普勒血流图等比较,良恶性肾占位间差异无统计学意义(P>0.05)。
恶性肾占位中有16例为低回声、5例等回声、3例高回声,非恶性肾占位中2例为低回声、1例等回声、4例高回声,差异有统计学意义(P<0.05)。
恶性肾占位CEUS达峰时间[(34.92±7.84)s]早于非恶性肾占位[(38.43±4.89)s],差异有统计学意义(P<0.05)。
恶性肾占位的CEUS增强模式3例为“慢进慢退”、1例“快进慢退”、11例“快进快退”、9例“同进快退”,而非恶性肾占位中4例为“慢进慢退”、1例“快进慢退”、1例“快进快退”、1例“同进慢退”,差异有统计学意义(P<0.05)。
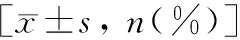
表1 肾占位性病变的临床及超声特征
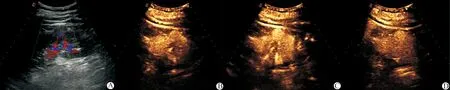
A:常规超声为左肾中部等回声,内部见血流信号;B:CEUS 14 s病灶开始显影,与周围肾实质同时显影;C:CEUS 24 s病灶高增强;D:CEUS 27 s病灶内造影剂消退,早于周围肾实质
图1 超声成像图之一(患者,男,58岁)
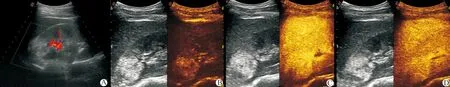
A:常规超声为右肾上极高回声,内部见点状血流信号;B:CEUS 8 s病灶开始显影,晚于周围肾实质;C:CEUS 39 s病灶高增强;D:CEUS 44 s病灶内造影剂消退,晚于周围肾实质
图2 超声成像图之二(患者,男,31岁)
CEUS对肾占位性病变良恶性鉴别诊断的灵敏度、特异度、阳性预测值和阴性预测值分别为71.4%、91.7%、71.4%和91.7%,准确度为87.1%。超声检查对肾占位的诊断准确率见表2。
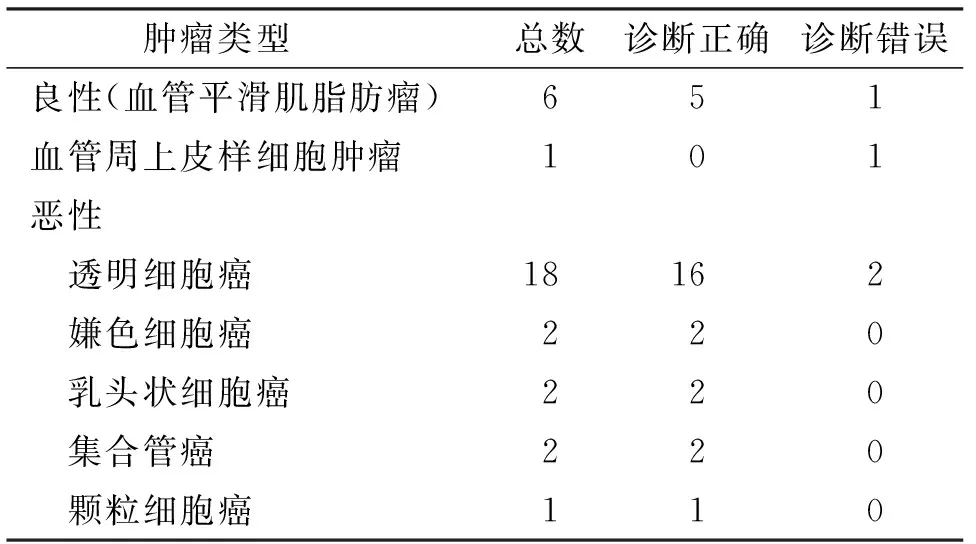
表2 肾占位的诊断准确率
讨 论
CEUS是一项新兴的超声技术,也是医学界前沿研究领域的一种新技术[8]。CEUS利用造影剂产生的高强度非线性谐波信号,增加了正常组织与病变的对比度。根据病变的微血管灌注情况,CEUS可用于诊断和区分不确定的病变、小肾癌、复杂的囊肿和炎症损伤[9-10]。
本研究发现,肾恶性肿瘤多为等低回声,而肾良性肿瘤回声多强于恶性肿瘤,呈等高回声。最常见的肾良性肿瘤肾血管平滑肌脂肪瘤由比例不同的脂肪组织、厚壁血管和平滑肌组成,回声强度与脂肪含量多少有关,脂肪越多,回声愈高。肾恶性肿瘤含有糖原和脂质,易发生出血、坏死、囊性变、纤维化及钙化等。
本研究6例肾血管平滑肌脂肪瘤中4例表现为“慢进慢退”、1例表现为“快进慢退”、1例表现为“同进慢退”,造成这种差别主要与组成肾脏血管平滑肌脂肪瘤的血管、脂肪和平滑肌组织的不同比例有关。少数血管平滑肌脂肪瘤瘤体血管成分多,血流速度快,呈“快进”,常规超声难以与肾癌相鉴别[11];大多数血管平滑肌脂肪瘤不仅血管构成比例低,而且呈畸形、迂曲、弹性差,从而造影剂灌注缓慢,另外瘤内血管结构排列杂乱,形成了堆积大量红细胞的血管网或血窦,以致造影剂廓清缓慢[12],整体呈“慢进慢退”模式。
本研究中,肾良性肿瘤的达峰时间长于恶性肿瘤,且肾良性肿瘤的对比增强方式以“慢退”为主,而恶性肿瘤多为“快退”模式。肾肿瘤恶性与良性的差别主要在供血方面,恶性肿瘤的新生血管丰富,多发展为富血供肿瘤。在“快进快退”的病例中,有58.3%为肾透明细胞癌,其中1例为肾透明细胞伴乳头状癌,这可能与透明细胞癌内部血管生成的管径、密度、走形迂曲、动静脉瘘以及淋巴管网等因素有关。83.3%的恶性肿瘤的造影特征是呈“快退”模式,这可能是与肿瘤中有更大更高的细胞密度、更丰富的淋巴网络和更粗大的静脉有关。可以看出,造影剂进入肿瘤的速度及其在肿瘤内的廓清速度可作为诊断良恶性肿瘤和不同肿瘤类型的重要参考指标。与透明细胞癌相比,乳头状癌和嫌色细胞癌血供较少,血流动力学特点也不同,造影呈“慢进”模式较多,但乳头状癌以不均质增强为主,嫌色细胞癌多呈均匀灌注[13-14]。
本研究结果显示,CEUS对肾脏占位性病变良恶性鉴别诊断的灵敏度、特异度、阳性预测值、阴性预测值和准确度分别为71.4%、91.7%、71.4%、91.7%和87.1%,与相关文献报道结果基本一致[2,7]。
造影检查可以更好地显示肾肿瘤中小血管和低速血流的信息,并可实时观察微循环灌注过程,改善空间分辨率,对肾脏恶性肿瘤的鉴别非常重要。但仍有如下不足:①肥胖、肠道积气和肋骨的干扰影响造影的成像质量;②病变位置较深和小的肿瘤病变会降低其诊断价值[12];③难以同时显示不同部位病变[15],只有在肿瘤标的明确时,才可以实时显影;④由于血液循环中微泡破坏很快,经验丰富和操作熟练的超声医生是准确诊断的重要条件。Setalo等[16]也认为,CEUS一般不适合较大的肾占位,在肿瘤的定性和分期中尚不能取代CT和MRI。
随着造影技术的日臻完善和纳米造影剂的不断发展,我们相信CEUS在肾占位的诊断和鉴别诊断中将发挥更大的临床应用价值,为临床准确诊断提供更好的服务。

