miR-223通过SEPT6抑制NCK-SOCS7信号通路促进前列腺癌细胞增殖及侵袭
魏永宝 李涛 林乐 吴进锋 金中 张若晨 吴翔 彭俊铭 钟德文 张星 朱庆国 叶烈夫 高祥勋
前列腺癌的发生、进展与miRNAs以及DNA损伤修复密切相关。目前已发现与前列腺癌有关的miRNAs有几十种[1-2]。这些miRNAs在前列腺癌中或高或低表达,在细胞凋亡、细胞周期、细胞增殖、DNA修复、雄激素非依赖、应激反应或药物抵抗等多方面起作用,影响前列腺癌的发生和进展[1,3]。我们前期研究发现miR-223-3p(miR-223)在前列腺癌发生、进展中也具有重要作用;并发现GTP结合蛋白基因Septin 6(SEPT6)是miR-223的靶基因之一,上调SEPT6表达能够逆转miR-223调控前列腺癌细胞的生物学行为[4]。SEPT6是高度保守的Septins基因之一,研究表明Septins基因突变或缺失会抑制酿酒酵母的胞质分裂并可能导致疾病的发生[5-7]。当细胞发生DNA损伤时,细胞能够通过SEPT2/6/7复合体,利用细胞因子信号传导抑制蛋白(suppressor of cytokine signaling 7, SOCS7)途径,介导将酪氨酸激酶衔接蛋白1(NCK adaptor protein 1, NCK-1或NCK)的非催化区域转移入细胞核内,从而通过阻滞细胞周期,细胞得以进行自我修复[8]。而DNA损伤修复的失败将导致恶性肿瘤等疾病的发生及进展。关于miR-223是否通过SEPT6调控NCK-SOCS7信号通路及其在前列腺癌中的作用及机制尚且未知。因此,2016年6月至2018年6月我们通过在细胞层面对这一设想进行研究探讨,旨在为阐明前列腺癌进展机制提供新依据。
材料与方法
一、细胞培养和转染
人正常前列腺上皮细胞RWPE-1(上海中乔新舟生物科技有限公司)及前列腺癌细胞株PC3、DU145和LNCaP(中国科学院上海生命科学研究院细胞资源中心)在37 ℃含有10% FBS和5% CO2的培养液(RPMI-1640,美国Sigma公司)中进行培养。24 h后进行细胞分组。在转染试剂盒(LipofectamineTM2000复合物,美国Invitrogen公司)上进行转染。分别构建miR-223空载体(miR-NC)、模拟物载体(miR-MM)以及抑制物即反义寡核苷酸质粒载体(miR-AO)。并构建SEPT6空质粒载体(siR-NC)以及SEPT6 siRNAs(siR-163、siR-1219及siR-2289)抑制载体质粒,再筛选抑制SEPT6基因最佳的抑制质粒。细胞转染后在培养箱中再孵育24 h或48 h后,分别在光学和荧光显微镜下检测并计算细胞转染率。
二、实时定量聚合酶链反应检测
根据实时定量聚合酶链反应(QPCR)操作说明书,用microRNA提取试剂盒(miRNeasy Mini Kit,美国Qiagen公司,批号#217004)纯化细胞中总miRNA。在7900HT型荧光定量PCR仪(ABI 7900系统,美国Applied Biosystems公司)上进行QPCR检测。使用miRNA QPCR检测试剂盒(miRNA QPCR Detection Kit,美国GeneCopoeia公司,批号#R0101L)检测miR-223。使用逆转录试剂盒(RevertAidTMH Minus First Strand cDNA Synthesis Kit,立陶宛Fermentas公司,批号#K1631)逆转录实时PCR的总RNA。所有实验重复3次,生成标准曲线。根据内部对照将结果进行标准化,计算基因相对表达量(relative quantity, RQ),计算方法RQ=2-DDCt。
三、MTT法检测细胞增殖能力
使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)(美国Sigma公司)检测细胞增殖。将100 μl细胞(1×104细胞)加入96孔板每个平板中。在含5% CO2的37 ℃培养箱中培养,再按上述介绍的细胞转染方法进行转染。将MTT稀释,将50 μl 1×MTT滴入到转染后的细胞平板中。将细胞再孕育4 h。去除培养物上清液,再加入二甲基亚砜(DMSO,美国Sigma公司)作用10 min,溶解细胞中的甲臜。进行酶标仪(Molecular Devices,美国Sunnyvale公司)酶标后,在570 nm吸光度下测量每个板的细胞数,计算细胞增殖率(%)。
四、Transwell小室测定细胞侵袭能力
Transwell小室由Transwell 6孔板(美国corning公司)构建,表面覆盖60~80 μl基质胶稀释液(Matrigel,美国BD公司)。用PBS洗涤细胞,在BSA无血清培养液中培养细胞。将细胞浓度调节至5×104个/ml。在下室中加入含1 ml FBS的细胞培养液,同时将细胞悬浮液种植在上室。在含5% CO2的37 ℃培养箱中培养24~96 h后,去除上室中的基质胶和残余细胞。95%乙醇固定细胞15~20 min,再用苏木精染色10 min。在倒置显微镜下以200倍放大率进行细胞计数。
五、统计学方法
结 果
一、筛选DU145细胞系进行后续研究
通过QPCR检测基因表达,对比RWPE-1,miR-223在PC3、DU145和LNCaP中的表达明显增高,在DU145中为最高(6.71±1.84)(P<0.05)。且miR-223与SEPT6、NCK及SOCS7的表达呈反向关系,在DU145中,SEPT6(1.60±0.54)、NCK(2.13±0.65)及SOCS7(1.52±0.87)表达较低。因此选择DU145细胞系做后续研究。
二、miR-223能够抑制SEPT6、NCK及SOCS7表达并促进细胞增殖及侵袭
用羧基荧光素分别标记载体miR-NC、miR-MM和miR-AO,再分别转染不同DU145细胞,在光学和荧光显微镜下动态检测不同时间点的细胞转染率,发现转染24 h时转染率达到80%以上,此时细胞转染达到实验要求。QPCR法检测转染后细胞中miR-223、SEPT6、NCK及SOCS7的表达,发现这些基因的表达在2个对照组(DU145组和miR-NC组)之间差异无统计学意义,而实验组(miR-MM组和miR-AO组)与2个对照组相比较差异有统计学意义,且miR-MM组和miR-AO组间差异也有统计学意义(P<0.05)。其中在miR-MM组,miR-223表达最高(8.97±3.71),而SEPT6、NCK及SOCS7基因表达较低[分别为(0.24±0.06)、(0.89±0.26)及0.74±0.15)];在miR-AO组,miR-223表达最低(2.17±0.85),而SEPT6、NCK及SOCS7基因表达较高[分别为(4.58±1.96)、(6.23±2.36)及(7.13±3.14)]。结果表明,提高miR-223表达能够抑制SEPT6、NCK及SOCS7表达,细胞增殖及侵袭实验发现此时细胞增殖及侵袭能力最强;反之抑制miR-223能够提高SEPT6、NCK及SOCS7表达,此时细胞增殖及侵袭能力则明显减弱(均P<0.05)。见图1。
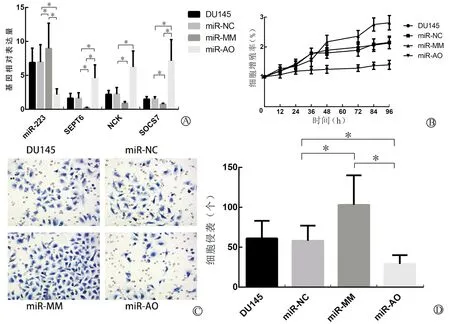
A:miR-223、SEPT6、NCK及SOCS7基因相对表达量(*P<0.05);B:细胞增殖曲线图(MTT法);C:细胞侵袭能力(Transwell小室法,×200倍);D:细胞侵袭能力组间比较(*P<0.05)
图1 miR-223能够抑制SEPT6、NCK及SOCS7表达水平并促进细胞增殖及侵袭
三、筛选最佳SEPT6 siRNA
利用SEPT6 siR-163、siR-1219及siR-2289分别转染DU145细胞,利用绿色荧光蛋白标记后分别在光学和荧光显微镜下动态检测细胞转染率,发现在转染24 h时转染率在80%以上,证实此时细胞转染率达到实验要求。用QPCR法检测转染后细胞中SEPT6的基因表达量,发现在siR-1219转染下SEPT6表达量最低(P<0.05)。因此选择siR-1219进行后续实验。
四、提高SEPT6能够促进NCK及SOCS7表达并抑制细胞增殖及侵袭
设计以下4个共转染载体,即miR-NC+siR-NC、miR-NC+siR-1219、miR-AO+siR-NC及miR-AO+siR-1219,分别转染DU145细胞系,进行SEPT6回复实验。用QPCR法分别检测miR-223、SEPT6、NCK及SOCS7表达水平及进行细胞功能实验。在本回复实验中,我们仅需要对比miR-NC+siR-1219组和miR-AO+siR-NC组,即能说明本组实验目的。我们发现在miR-NC+siR-1219组,miR-223表达较高(6.92±2.16),而SEPT6表达较低(0.26±0.07),NCK及SOCS7表达与SEPT6一致,也较低[分别为(0.59±0.08)和(0.93±0.12)],本组细胞功能实验发现细胞增殖及侵袭能力较强[细胞侵袭数为(63±25)个](P<0.05)。而在miR-AO+siR-NC组,miR-223表达最低(2.19±0.90),而SEPT6表达较高(4.57±1.95),同样NCK及SOCS7表达与SEPT6一致,也较高[分别为(5.27±2.38)和(6.25±2.62)],本组细胞增殖及侵袭能力则较弱[细胞侵袭数为(21±6个)](P<0.05)。见图2。
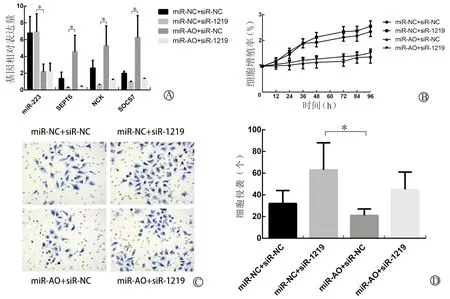
A:共转染DU145细胞后,QPCR法检测miR-223、SEPT6、NCK及SOCS7基因相对表达量(*P<0.05);B:MTT法检测4组的细胞增殖率;C:Transwell小室法检测细胞侵袭能力(×200倍);D:4组之间细胞侵袭能力比较(*P<0.05)
图2 提高SEPT6能够促进NCK及SOCS7表达并抑制细胞增殖及侵袭
讨 论
很多miRNAs与前列腺癌的发生、进展有关[1-2],miR-223也是其中之一。miR-223位于染色体Xq12上,包括miR-223-3p(miR-223)和miR-223-5p(miR-223*)2个亚体。已证实miR-223在血液系统恶性肿瘤中异常表达并促进其进展[9-10]。此外,miR-223也在其他多种实体肿瘤中异常高表达,如肝细胞癌[11-12]、大肠癌[13]。在卵巢浆液性癌中也发现miR-223高表达,并靶向调控SMARCD1促进肿瘤进展[14]。因此在不同肿瘤中,miR-223可能起到抑癌基因、原癌基因等作用,影响肿瘤细胞的增殖、细胞周期、血管形成及肿瘤转移,而针对这些基因及其靶基因的研究,能够为肿瘤防治提供新靶点[15-16]。我们前期研究发现miR-223在前列腺癌的发生、进展中也具有重要作用,miR-223在前列腺癌组织及细胞中高表达,并能够促进前列腺癌细胞的生物学行为[4]。在本研究中,再次证实miR-223基因在PC3、DU145和LNCaP中的表达都比RWPE-1中高,提示miR-223在前列腺癌中可能具有促癌基因作用。
miR-223对SEPT6具有靶向调控作用。高度保守的GTP结合蛋白基因Septins突变或缺失会抑制酿酒酵母的胞质分裂并可能导致疾病的发生[5-6,17]。近年来Septins在人类肿瘤中的作用愈发受到重视[18]。目前已发现至少14个人类Septins基因,其中多个Septins基因在肿瘤中异常表达[18]。如SEPT4在前列腺癌、肾细胞癌及膀胱癌中高表达[19]。本研究中的SEPT6能够通过基因融合,在急性髓细胞白血病中形成MLL-SEPT6基因重组,进而影响其疾病进程[20-21]。研究发现miRNAs能够通过其2~8碱基长度的序列结合靶基因mRNA的相应3′UTR端“种子”序列,组成miRNA-mRNA沉默复合体,影响mRNA的表达[22],进而在肿瘤及其他病理生理的发生、发展中起重要作用。前期我们通过多个靶基因预测网站,包括PicTar、microRNA、MiRBase和TargetSpy[22],均发现SEPT6与miR-223具有配对碱基,提示SEPT6可能是miR-223靶基因。通过研究我们首次证实SEPT6是miR-223的靶基因之一,上调SEPT6表达能够逆转miR-223调控前列腺癌细胞生物学行为[4]。本研究发现,miR-223与SEPT6、NCK及SOCS7表达呈反向关系,并且上调或抑制miR-223表达,SEPT6表达也呈现对应的反向抑制和增强趋势,从细胞水平再次验证了miR-223对SEPT6的靶向调控作用。
Septins介导的NCK-SOCS7信号通路影响DNA损伤修复过程,该信号通路发生异常会影响恶性肿瘤的进展。DNA损伤修复障碍与包括前列腺癌在内的恶性肿瘤的发生、进展及预后都有密切相关性[23-24]。2007年Kremer等[8]发现细胞受到辐射刺激发生DNA损伤后,SOCS7蛋白通过SEPT2/6/7复合体,将NCK蛋白转移入细胞核内,阻滞细胞周期,使得细胞进行自我修复。而NCK-SOCS7信号通路在受到破坏后,是否促进前列腺癌的进展尚且未知。本研究发现通过miR-MM上调miR-223表达,能够明显抑制SEPT6表达,进而抑制下游NCK-SOCS7信号通路的表达水平,进一步研究发现此时DU145细胞具有更强的细胞增殖及细胞侵袭力;反之,通过miR-AO抑制miR-223的表达,则能够提高SEPT6、NCK和SOCS7基因的表达水平,此时DU145细胞的增殖和侵袭力则相对明显下降。
通过本研究,我们认为在前列腺癌细胞周期中出现DNA损伤时,由于过表达的miR-223抑制了SEPT6基因表达,导致下游参与DNA损伤修复的NCK-SOCS7信号通路被抑制,使细胞不能完成自我修复,从而促进前列腺癌的恶性转归。本研究可能为前列腺癌的发生、进展提供新视角,为其潜在防治靶点提供理论依据。

