膀胱肿瘤患者尿液中NID2和HOXA9基因的甲基化水平研究
郭帅 赵晓俊 周政 浦金贤 江弢
全世界范围内,膀胱肿瘤为第五大恶性肿瘤,传统的检查方法有膀胱镜和尿脱落细胞学检查。膀胱镜是公认的确诊膀胱肿瘤的金标准,但其价格不低,且会给患者带来一定的不适感[1];尿脱落细胞学虽然可在一定程度上弥补膀胱镜的不足,但其存在敏感性较差的缺陷,特别是针对低级别移行细胞癌[2-3]。
巢蛋白(nidogen, NID)家族包括NID1、NID2,是基底膜的主要构成成分之一,基底膜在细胞的分化、增殖和迁移方面发挥着重要的作用,因此,NID基因的异常表达易造成细胞膜的不稳定而引起病变[4-5]。同源盒(HOX)基因的编码产物是一种重要的转录调节因子,在控制胚胎发育和调节细胞分化过程中发挥重要作用[6-7]。关于膀胱肿瘤与NID2和HOXA9基因的相关性,目前国外有研究显示肿瘤患者尿液样本中NID2和HOXA9基因甲基化水平显著高于正常对照者[8-12]。本研究采用甲基化特异性PCR(MSP)技术对膀胱肿瘤患者尿液标本中NID2和HOXA9基因甲基化水平进行了检测,以明确其在膀胱肿瘤诊断中的应用价值。
对象与方法
一、一般资料
2015年4月至2017年6月苏州大学附属第一医院泌尿外科收治的原发性膀胱尿路上皮癌患者70例纳入研究,70例患者均为首次确诊,之前未经手术及化疗等治疗。70例中男48例、女22例,年龄41~81岁,中位年龄63岁。参照WHO(2004)标准进行肿瘤分级(低度恶性潜能-LMP、低级别-Low和高级别-High),参照TNM(2010)进行临床分期。纳入研究的70例患者的尿液标本作为实验组,另采集60例泌尿系其他疾病患者的尿液标本作为对照组,对照组中男35例、女25例,年龄37~73岁,中位年龄54岁(表1)。收集的尿液标本为术前晨尿中间段(50 ml),完成收集后立刻转入-20 ℃冰箱保存。本研究经医院伦理委员会批准通过,所有受试对象均知情同意。

表1 实验组与对照组一般资料
二、尿脱落细胞DNA的提取
取5 ml尿液样本,采用通用型基因组DNA提取试剂盒(CWO 0550,康为世纪)提取尿脱落细胞总DNA,提取的DNA样本于-20 ℃冰箱保存。
三、MSP检测
采用亚硫酸氢盐转化试剂盒(EZ-DNA Methylation-Gold kit,ZYMO Research)进行DNA的亚硫酸氢盐修饰及纯化,用亚硫酸氢盐修饰过的T47D作为阳性质控品,293作为阴性质控品,ddH2O作为对照进行PCR扩增。甲基化特异性引物序列NID2顺义链:5′-GTTTCGCGGTTTTTAAGGA-3′,反义链:5′-ACGCTAAACTCATCTCCTAC-3′,探针:5′-GTTCGTAAGGTTTGGGGTAGCG-3′;甲基化特异性引物序列HOXA9顺义链:5′-GTTATTATCGTGTTTAGCG-3′,反义链:5′-CGATACCACCAAATTATTA-3′,探针:5′-GTTCGTTCGGTTCGATTTACG-3′;内参基因ACTB顺义链:5′-GGAGGAGGTTTAGTAAGT-3′,反义链:5′-CAATAAAACCTACTCCTCCC-3′,探针:5′-CACCACCCAACACACAATA-3′。甲基化反应体系为20 μl,5 μl修饰的DNA模板,每种dNTP浓度均为0.25 mmol/L,每种引物浓度均为0.4 μmol/L,2单位Taq 聚合酶。反应过程:95 ℃预变性5 min,95 ℃变性20 s,61 ℃复性延伸40 s,共计45个循环。两个基因有一个基因CT值<35即判定为阳性,其中内参通道CT值>30,判读样本为不合格样本。每例样本设置3个对照:甲基化阳性、阴性对照及水作为空白对照。
四、统计学方法
应用SPSS 22.0统计软件,计数资料用百分比表示,组间比较采用χ2检验,组内比较采用Fisher确切概率检验,P<0.05为差异有统计学意义。诊断敏感性和特异性采用受试者工作曲线(ROC)进行分析,并计算其曲线下面积(AUC)。
结 果
一、尿液标本NID2、HOXA9甲基化水平
实验组尿液标本NID2甲基化率检测灵敏度为74%(52/70),特异度为85%(51/60),NID2甲基化检测结果见图1;HOXA9甲基化率检测灵敏度为84%(59/70),特异度为93%(56/60),HOXA9甲基化检测结果见图2;双指标联合检测的灵敏度为89%(62/70),特异度为80%(48/60)。实验组与对照组基因甲基化水平比较,差异有统计学意义(P<0.01),不同分期和分级肿瘤尿液样本基因甲基化状态比较,差异无统计学意义(P=0.485、0.241) (表2)。
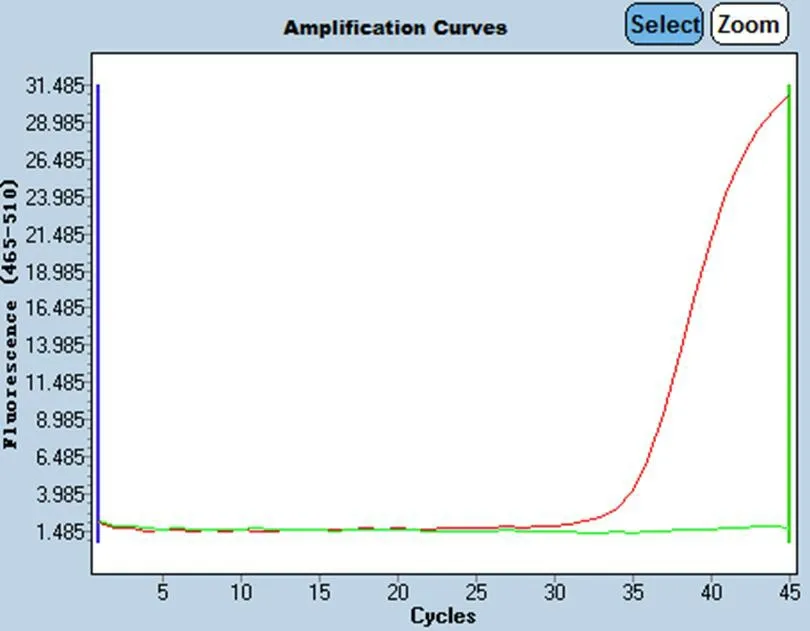
图1 NID2基因甲基化检测结果(红色为阳性,绿色为阴性)
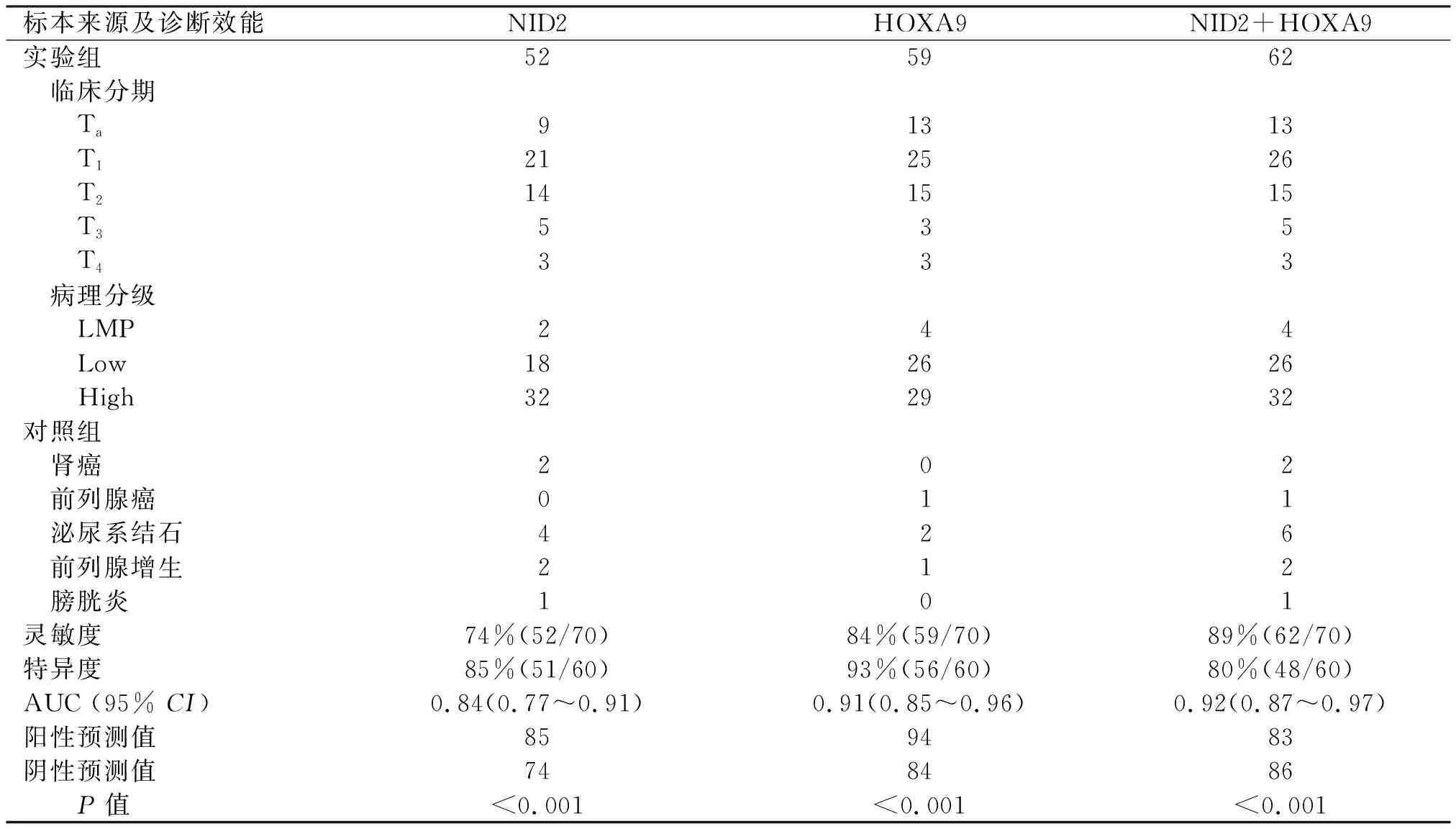
表2 实验组及对照组尿液标本基因甲基化检测结果及诊断效能

图2 HOXA9基因甲基化检测结果(红色为阳性,绿色为阴性)
70例膀胱肿瘤患者尿脱落细胞学检测结果显示,31例为阳性或可疑,灵敏度为44%(31/70),特异度为78%(47/60)。双指标联合检测的灵敏度和特异度均高于尿脱落细胞学检测。
二、ROC及AUC
膀胱肿瘤患者尿液标本NID2基因甲基化的AUC为0.84(0.77~0.91),HOXA9基因甲基化的AUC为0.91(0.85~0.96),双指标联合检测的AUC为0.92(0.87~0.97)。双基因甲基化联合检测的ROC见图3。
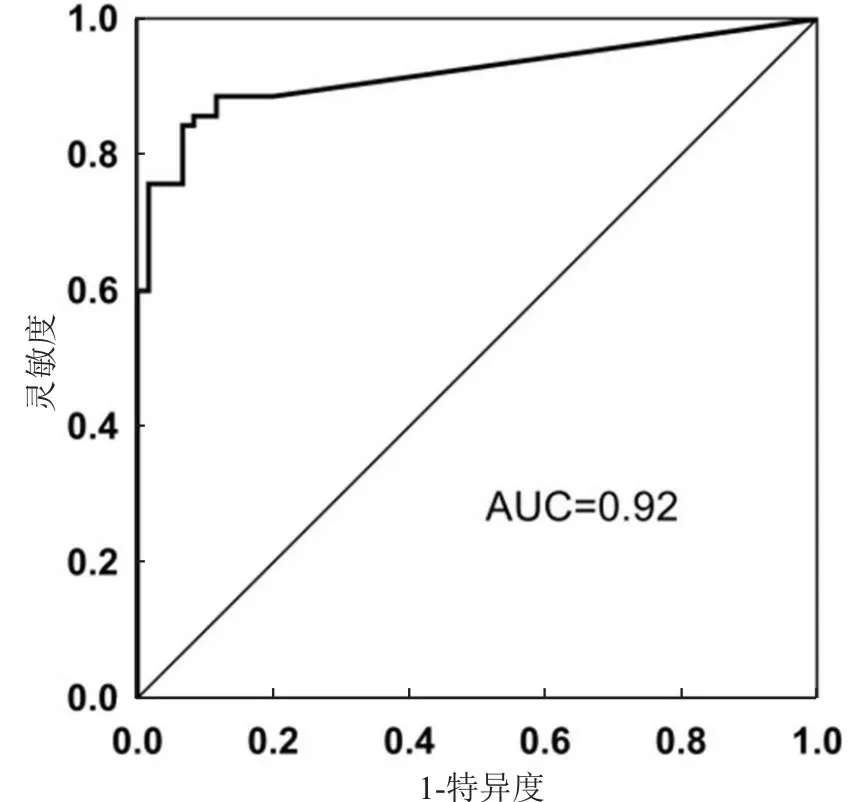
图3 NID2和HOXA9基因甲基化联合检测ROC
讨 论
肿瘤的发生发展与基因环境的相互作用和病因学有密切的关联[13],基因突变在肿瘤进展过程中发挥重要作用,但在表观遗传学中,基因的甲基化未改变基因的序列,而是通过改变构型影响基因的转录,继而引起基因沉默[14]。CpG二核苷酸是最主要的甲基化位点,CpG通常以两种形式存在,一种是分散于DNA中,另一种是CpG结构高度聚集的CpG岛[15]。正常组织中分散于DNA中的CpG的位点通常是甲基化的,而位于健康人基因启动子区的CpG岛处于非甲基化状态[16],CpG岛甲基化可引起相关基因的沉默,从而引起肿瘤的发生发展[17-18]。
Reinert等[11]使用基因芯片对膀胱肿瘤基因中27 000个CpG岛进行了研究,从中发现了多个异常甲基化的位点,部分有可能成为预测膀胱肿瘤的标志物,膀胱肿瘤组织中HOXA9基因的甲基化特异性和敏感性分别达到了74%和96%。国外已有学者使用MSP技术检测膀胱肿瘤患者尿脱落细胞NID2的甲基化状态,取得了良好的实验结果,其敏感性和特异性均高于尿脱落细胞学检测[10,12],但相关研究在国内鲜有报道。
本研究分析了膀胱肿瘤患者尿液标本中NID2和HOXA9基因甲基化表达情况。研究发现实验组尿液标本中NID2和HOXA9基因的甲基化率较高,分别达到了74%和84%,对照组尿液标本中基因甲基化率分别仅为15%和7%,差异有统计学意义,但统计结果提示甲基化与肿瘤的分级、分期等临床参数无显著相关性,该结论与国内外一些研究结果相一致[12,19]。但也有研究认为基因甲基化与膀胱肿瘤的分级、分期等临床参数有关,特别是在低分化膀胱肿瘤组织中更易检出[20-21]。NID2和HOXA9基因甲基化联合检测的AUC值为0.92,高于任一单基因检测,表明联合检测有更高的价值。
Renard等[10]于2010年首次报道了膀胱肿瘤尿液中NID2的表达情况,显示出较高的敏感性和特异性。Reinert等[8]于2012年首次报道了HOXA9对膀胱肿瘤的诊断价值,并且认为其在监测膀胱肿瘤复发中具有重要作用。Scher等[22]使用巢式PCR技术检测尿液标本中NID2基因,发现NID2基因与膀胱肿瘤有密切的关联,尽管实验方法不同,本研究也支持这一结论。本研究中,我们将泌尿系其他疾病的尿液标本作为对照组,但值得注意的是有少部分对照组患者的尿液中检测出了基因甲基化状态,然而到目前为止,尚未有相关研究证明在这些疾病中存在NID2和HOXA9基因的甲基化,这可能是由于①尿液收集时存在污染;②存在实验检测操作问题;③该疾病有可能并发膀胱肿瘤,但膀胱肿瘤未得到确诊。针对这些不足之处,我们会进一步完善后续的收集和实验操作以及对患者进一步的随访。
综上所述,NID2和HOXA9基因甲基化联合检测的诊断价值优于单一基因,双指标联合检测可能成为一种有效的诊断原发性膀胱肿瘤的方法。目前在临床诊断方面,膀胱镜依然是金标准,尿脱落细胞学也是重要的辅助手段,尚未有足够的证据表明尿液NID2和HOXA9基因甲基化检测可替代尿脱落细胞学检测,将来进一步的前瞻性研究若能证明其可行性,这样就可为患者提供一种舒适、无痛且方便的检测新方法。

