腹腔镜前列腺癌根治术+扩大盆腔淋巴结清扫治疗高危前列腺癌临床体会
王超 平季根 陆勇 何雪峰 赵晓俊 浦金贤
EAU-ESTRO-SIOG前列腺癌指南2016依据总前列腺特异性抗原(tPSA)、前列腺穿刺Gleason评分(GS)、肿瘤临床分期(cT)以及临床淋巴结状态(cN),将高危前列腺癌定义为:tPSA>20 ng/ml或GS>7分或cT≥cT2c或cN+[1]。高危前列腺癌的治疗以往多采取非手术治疗,近年来外科手术治疗逐渐占据重要的地位,治疗方案国内外各个中心不尽相同,疗效各异,多采用手术联合内分泌治疗、化疗及放疗等策略,目前腹腔镜下前列腺癌根治术(laparoscopic radical prostatectomy, LRP)+扩大盆腔淋巴结清扫(extended pelvic lymph node dissection, ePLND)已成为治疗高危前列腺癌的重要手段。我院自2012年开展LRP以来,至今总计完成500例手术,本文回顾性分析了2014年1月至2017年10月于我院行LRP+ePLND的86例高危前列腺癌患者的资料,总结临床疗效,并探讨更为合理的治疗方案。
对象与方法
一、一般资料
2014年1月至2017年10月我院收治的高危并行LRP+ePLND的前列腺癌患者共计86例纳入研究,发病年龄46~84岁,平均69.4岁。术前tPSA 4.110~141.910 ng/ml,平均37.880 ng/ml,其中>20.000 ng/ml 52例、>100.000 ng/ml 9例。穿刺活检发现GS 3+3 10例、3+4 11例、3+5 4例、4+3 21例、4+4 13例、4+5 9例、5+3 1例、5+4 16例、5+5 1例,GS≥8分44例。前列腺体积(0.52×三径线之积)11.61~109.2 ml,平均40.08 ml。所有患者经全身骨扫描排除骨转移后行LRP+ePLND,手术均由同一位医师完成。
二、手术步骤
全麻,患者取仰卧位,双腿略分开,术者位于患者左侧,扶镜手位于头端,显示器位于尾端。采用经腹腔途径,取脐下3 cm纵行切口,置入10 mm Trocar建立气腹,气腹压力设定为15 mmHg,直视下于左、右髂前上棘与脐连线中上1/3处置入12 mm Trocar各1个,麦氏点与反麦氏点各置入5 mm Trocar 1个,随后取头低脚高30° 体位。
1.LRP:首先剔除前列腺表面的脂肪组织,显露盆底筋膜和耻骨前列腺韧带,将前列腺压向左侧,贴近盆壁用超声刀打开右侧盆底筋膜,左侧同理,尽量远离前列腺包膜以减少出血,切断耻骨前列腺韧带,2-0可吸收线缝扎DVC。随后于膀胱颈和前列腺之间钝性锐性相结合分离至两侧,充分游离后切开膀胱颈前壁,拉出导尿管并横行切开膀胱颈后唇,显露精囊腺与输精管,于输精管远端用超声刀离断,过程中注意避免损伤精囊动脉,提起双侧精囊腺,暴露狄氏筋膜,水平切开后显露前列腺直肠间隙,沿此间隙游离至前列腺尖部,前列腺侧韧带用Hem-o-lock钳夹后超声刀切断或Ligasure血管闭合系统离断,接着处理前列腺尖部尿道。超声刀切断DVC,显露尿道前壁,充分游离前列腺两侧直至完全显露尿道并可180° 旋转,贴近前列腺尖部将尿道剪断,保留足够长度的尿道,完整切除前列腺。予2-0可吸收线自9点处开始顺时针连续吻合膀胱颈与尿道,置入F20导尿管1根。
2.ePLND:清扫双侧盆腔淋巴结组织,清扫范围:头端至输尿管跨越髂总血管区域,尾端至旋髂静脉和股管处,外侧缘至髂外静脉,内侧至膀胱壁,后方至盆壁,依次清扫髂外、髂内、闭孔、髂总淋巴结,骶前淋巴结不做常规清扫,标本自12 mm Trocar处取出。
三、观察指标及随访
记录手术时间、术中出血量、围手术期并发症、术后病理、术后住院时间、导尿管留置时间、tPSA、尿控和术后辅助治疗情况等。随访工作在门诊完成,随访资料录入前列腺癌数据库。术后6周进行第一次随访,术后第三个月进行第二次随访,随后每3个月随访1次。生化复发定义为tPSA连续2次>0.200 ng/ml,完全尿控定义为无需尿垫。
结 果
86例LRP+ePLND手术均顺利完成,手术时间90~430 min,平均200 min。术中出血量50~1 500 ml,平均264 ml。术中无大血管损伤、直肠损伤、闭孔神经损伤等并发症。术后常规2周拔除导尿管。出现尿漏3例、吻合口狭窄1例、吻合口出血1例、尿路感染1例、下肢水肿1例、淋巴漏15例。术后住院时间4~22 d,平均11.9 d。
术后病理分期pT2a2例、pT2b7例、pT2c41例、pT3a14例、pT3b17例、pT45例。GS 3+3 5例、3+4 14例、3+5 3例、4+3 25例、4+4 5例、4+5 19例、5+4 14例、5+5 1例,GS≥8分 42例,对比术前穿刺GS,有36例(41.86%)发生变化,其中GS升高23例(63.9%),GS下降13例(36.1%)。见表1。清扫出淋巴结8~28枚,平均13.5枚,总计1 161枚,淋巴结转移者13例,阳性淋巴结总计48枚。切缘阳性19例,切缘阳性率为22.09%。
13例淋巴结转移患者术后肿瘤病理分期均≥pT2c,其中pT2c2例、pT3a4例、pT3b4例、pT4 3例;术后患者GS≥8分 9例;13例中切缘阳性者4例,切缘阳性率30.76%;生化复发者8例,生化复发率61.53%。 淋巴结阳性组vs淋巴结阴性组见表2。
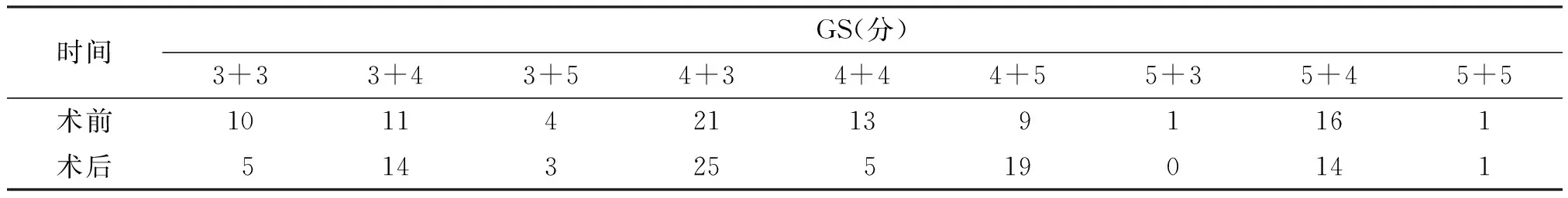
表1 手术前后GS比较(n)
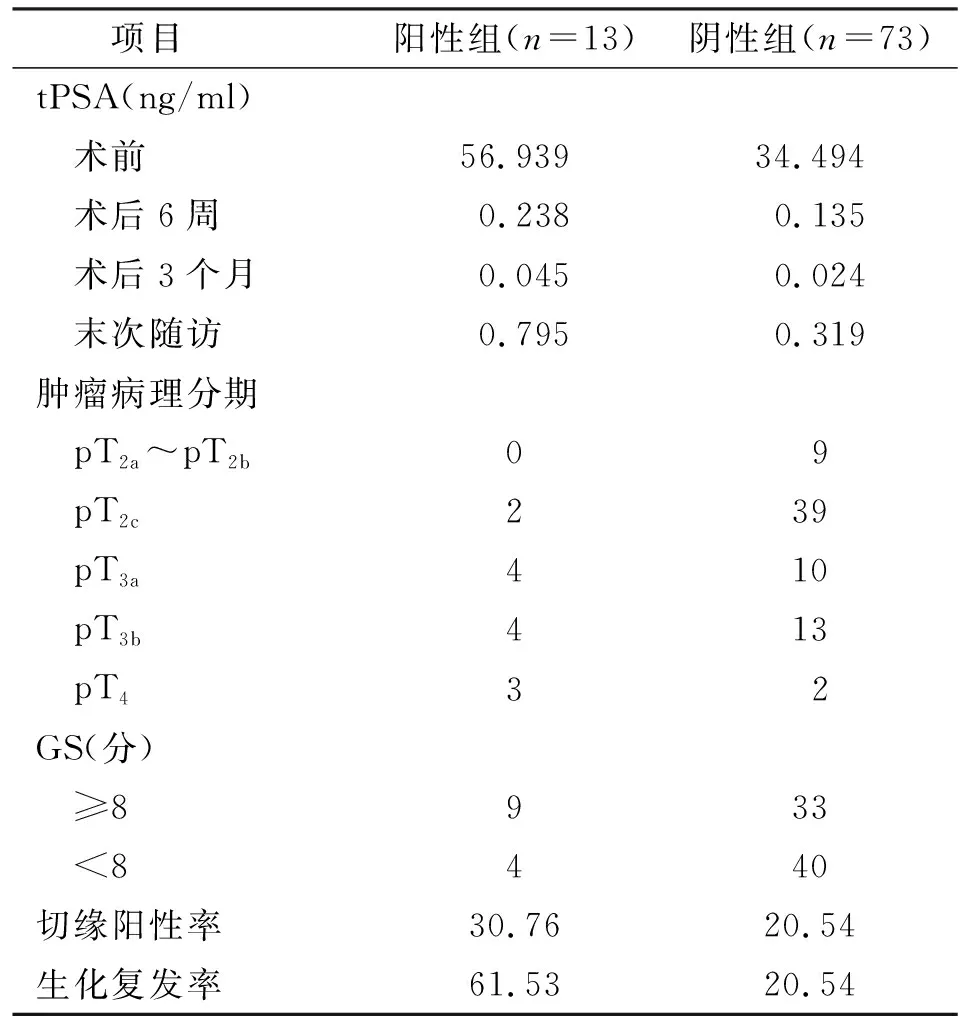
表2 淋巴结阳性组vs淋巴结阴性组
注:tPSA为平均值;肿瘤病理分期、GS为例数;切缘阳性率、生化复发率为百分数
门诊随访3~48个月,平均18.2个月,所有患者均存活,术后行辅助内分泌治疗43例、放疗28例。随访过程中23例患者出现生化复发,复发时间术后4~45个月,平均21.4个月,予内分泌治疗和/或放疗。拔除导尿管后1个月内恢复尿控39例(45.34%),3个月内恢复尿控62例(72.09%),1年内恢复尿控82例,1年尿控率达到95.34%。术后6周tPSA 0.000~2.150 ng/ml,平均0.150 ng/ml;术后3个月tPSA 0.000~0.170 ng/ml,平均0.027 ng/ml;截止末次随访日,tPSA 0.000~13.940 ng/ml,平均0.393 ng/ml。
讨 论
前列腺癌是欧美国家男性最常见的恶性肿瘤,2012年新发病例数达到240 000,居癌症死亡原因第二位,尽管有PSA筛查等早期诊断手段,仍有15%~26%的患者发现时已是高危[2]。近年来我国前列腺癌发病率呈明显上升趋势,临床确诊时高危患者约占新发病例的35.8%,饮食习惯的西方化、实验室检查技术的发展、PSA筛查等都是导致疾病检出率升高的重要因素[3]。高危前列腺癌发现时往往已侵犯前列腺包膜、精囊腺、膀胱颈和直肠等周围组织,具有很高的侵袭性和转移倾向,严重威胁着患者的生命健康,需要积极处理。
高危前列腺癌的治疗策略一直存在争议,传统观念认为外科手术难以达到肿瘤根治的目的,且可能导致尿失禁、性功能障碍等并发症,大多推荐内分泌治疗联合放疗[4]。但随着微创技术的迅速发展以及对前列腺解剖结构研究的深入,近年来,前列腺癌根治手术已被广泛应用于高危前列腺癌患者。有研究表明以手术为主的综合治疗相对于放疗或内分泌治疗具有更好的控瘤效果[5]。Zelefsky等[6]研究发现根治手术相比放疗降低约10%的转移风险并且肿瘤特异性死亡率更低。CaPSURE(Cancer of the Prostate Strategic Urological Research Endeavor)数据库10年随访结果表明,接受前列腺癌根治术的高危患者局部无复发生存率90%,全身无进展生存率89%,肿瘤特异性生存率95%,总生存率为80%。多达1/2的高危患者,接受手术后完全治愈,无需其他治疗[7]。
如何在术前精确地判断是否存在包膜外浸润或区域淋巴结转移,迄今为止始终是临床上一大难题,相比非手术治疗,手术治疗可以提供精确的肿瘤及区域淋巴结病理分期,而术后病理分期与术前临床分期往往存在差异,CaPSURE数据库资料显示临床分期的错误率高达35.4%[8]。Abern等[9]的研究证实超过1/3的高危患者在接受前列腺癌根治术后,病理分期、分级较术前出现了降低,且这些患者的生存率甚至与中低危患者相同。可想而知,若仅凭术前诊断为高危就放弃手术,将导致很多患者失去根治手术的机会。
由于相当一部分高危前列腺癌患者确诊时已存在区域淋巴结转移或微转移灶,因此在前列腺癌根治术的过程中应同时行ePLND,联合淋巴结清扫将清除潜在的微转移灶,从而提高患者的生存预后,并提供确切的肿瘤分期和区域淋巴结受累情况,为下一步治疗提供依据。比如对淋巴结阳性的患者及时采取内分泌治疗,阴性者定期随访PSA等[10]。
综上所述,LRP+ePLND治疗高危前列腺癌安全可行,具有良好的控瘤效果,并能提供准确的肿瘤病理学分期、分级,从而指导下一步治疗,是高危前列腺癌综合治疗方案中极为重要的一环。

