尿酸对大鼠血管平滑肌细胞赖氨酰氧化酶和基质金属蛋白酶-2表达的影响
刘会,张曙影,袁国军,荣季冬
动脉粥样硬化是导致动脉缺血性疾病的主要原因,平滑肌细胞增殖是动脉粥样硬化发生和发展的关键环节。赖氨酰氧化酶(LOX)是一种依赖铜的氨基酸氧化酶,参与细胞分化、迁移、转型与基因表达调控[1]。LOX表达与动脉粥样硬化密切相关[2,3]。高尿酸血症是冠状动脉粥样硬化独立的危险因素,可导致氧化应激和炎症反应增加,并介导平滑肌细胞增生[4]。Gacheru等[5]发现,刺激大鼠血管平滑肌细胞(VSMC)增殖可上调LOX表达。因此,我们推测尿酸可能上调VSMC中LOX的表达。为验证这一假说,我们体外培养大鼠VSMC,研究尿酸对大鼠VSMC 中LOX及基质金属蛋白酶-2(MMP-2)表达的影响。
1 材料与方法
细胞、实验试剂及耗材:大鼠VSMC来自大连医科大学附属第一医院中心实验室。四甲基偶氮唑蓝(MTT)、尿酸、β氨基丙腈(BAPN)、二甲基亚砜(DMSO)、溴化乙锭(Sigma公司,美国);DMEM/F12细胞培养液(HyClone公司,北京);胎牛血清、0.25%胰酶-0.03 EDTA细胞消化液(Gibco公司,美国);活性氧测定盒(碧云天公司,广州);磷酸盐缓冲液(PBS,HyClone,北京);25 cm2细胞培养瓶(Corning,美国);逆转录聚合酶链式反应(RT-PCR)试剂盒、RNAiso Plus、DL1000 DNA marker、琼脂糖(宝生物工程有限公司,大连);免疫印迹及凝胶电泳试剂、细胞及组织总蛋白抽提试剂盒、BCA蛋白质定量试剂盒(凯基生物有限公司,南京);羊抗人LOX多克隆抗体(Santa Cruz公司,北京);辣根过氧化物酶(HRP)结合的二级抗体、鼠抗MMP-2、鼠抗β-肌动蛋白(中杉金桥生物有限公司,北京);Millipore 超滤离心管(Millipore公司,上海);增强化学发光法(ECL)化学发光试剂盒(硕嘉生物科技公司,上海)。
大鼠VSMC培养:液氮冻存的细胞株用 37℃水浴溶解后用含 10%胎牛血清的DMEM/F12 细胞培养液洗去冻存液,接种于 25 cm2培养瓶,于 37 ℃、5%二氧化碳培养箱中培养,24 h 后更换培养液,以后每 2 d 换液,生长融合达 80%左右时进
行传代培养。
实验分组及预处理:本实验分为三组:对照组(只加新鲜的DMEM/F12 培养基);尿酸组(20、40、60 mg/L尿酸干预48 h;40 mg/L尿酸干预24、48、72 h);β氨基丙腈组(40 mg/L尿酸干预48 h后加入LOX的特异性抑制剂β氨基丙腈 10 mg/ml孵育 24 h)。
细胞的形态学观察:用倒置相差显微镜下观察细胞生长状态。
MTT比色法检测细胞增殖量:MTT法测得的光密度值可间接反应细胞增殖量。参照荣季冬等[6]提出的方法,将状态良好的大鼠VSMC按(2.0±0.2)×105/ml密度接种到96孔培养板中,加入DMEM/F12培养基(不含血清),孵育4 h后吸弃培养基,于不同孔中分别加入终浓度为 20、40、60 mg/L的尿酸 200 μl,孵育48 h;或在不同孔中加入终浓度为40 mg/L 尿酸 200 μl,分别孵育 24、48、72 h,加入 MTT 溶液,避光孵育4 h后吸弃培养液,加入DMSO 150 μl,振荡10 min,酶标仪(490 nm波长)测定各孔光密度值。
细胞活性氧测定:将状态良好的大鼠VSMC按5×104/ml~10×104/ml密度接种于 96孔板中,孵育6 h后吸弃DMEM培养基,于不同孔中分别加入终浓度 20、40、60 mg/L 的尿酸 100 μl,孵育 48 h,吸弃培养液后加入终浓度为10 μmol/L的荧光探针2,7-二氯荧光黄双乙酸盐(DCFH-DA) 100 μl,37℃孵育20 min,DMEM/F12培养基漂洗3次,激光共聚焦显微镜下观察活性氧情况[7],最大激发及发射波长分别是488 nm和525 nm。
RT-PCR:浓度为40 mg/L尿酸干预48 h后,吸弃细胞培养液,PBS漂洗2次,收集大鼠VSMC并提取其总RNA,计算总RNA的浓度和纯度。取1 μg总RNA按逆转录试剂盒说明书方法合成cDNA,产物按PCR试剂盒说明书方法操作。所有引物均参造Genebank提供的序列,由大连晨钰生物有限公司合成,引物序列见表1。反应条件:95℃预变性2 min,经过多个(表1)循环(95℃变性25 s,复性 48℃ ~63℃ 35 s,72℃ 延伸 65 s),终末 72℃延伸 5 min 。PCR产物以3%琼脂糖凝胶电泳,以Bio-Image图像采集和分析软件分析各条带的光密度值,计算目的条带与内参(β-肌动蛋白)的光密度比值,以此作为目的基因的相对表达量。

表1 逆转录聚合酶链式反应中所用引物信息
免疫印迹法检测:吸弃细胞培养液,PBS漂洗2次,加蛋白裂解液及蛋白酶抑制剂,冰上裂解30 min,期间反复震荡混匀,离心后取上清 BCA 法蛋白定量。取50 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白及转膜,15%脱脂牛奶-PBST溶液室温下封闭60 min,加入一级抗体(β-肌动蛋白:鼠抗单克隆抗体为1:2 000;LOX:羊抗人多克隆抗体为 1:500;MMP-2:鼠抗单克隆抗体为1:500),4℃摇床上过夜,PBST洗膜10 min,洗5次,加入HRP偶联二级抗体(β-肌动蛋白:山羊抗小鼠为1:20 000;LOX:兔抗羊为1:2 000;MMP-2:山羊抗小鼠为1:2 000),室温下摇床上孵育60 min,PBST洗膜10 min,洗5次,ECL法发光显像,X线压片曝光,将曝光胶片进行扫描,用凝胶图像处理系统分析条带像素灰度值。用目标蛋白的灰度值比β-肌动蛋白的灰度值为数值,所得数值代表目标蛋白的相对含量。
统计学方法:用 SPSS 16.0统计学软件进行统计学分析,所有数据用均数±标准差(±s) 表示,组间资料比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
体外培养的大鼠VSMC形态:倒置显微镜显示,培养的大鼠VSMC呈典型谷峰样生长,为大鼠VSMC特异的生长方式。
不同浓度尿酸干预48 h对大鼠VSMC增殖的影响(表2):与对照组比较,尿酸组不同浓度尿酸干预大鼠VSMC 48 h后细胞增殖量均明显增加,且细胞增殖量随着尿酸浓度升高而增加,差异均有统计学意义(P均<0.01)。
表2 对照组和尿酸组不同浓度尿酸干预下大鼠血管平滑肌细胞增殖情况比较(n=5,±s)
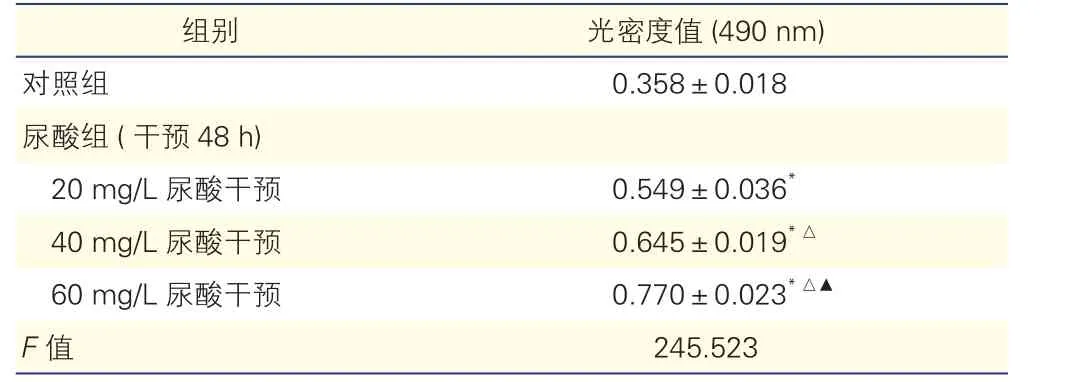
表2 对照组和尿酸组不同浓度尿酸干预下大鼠血管平滑肌细胞增殖情况比较(n=5,±s)
注:与对照组比较*P<0.01;与尿酸组(20 mg/L尿酸干预)比较△P<0.01;与尿酸组(40 mg/L尿酸干预)比较▲P<0.01
组别 光密度值(490 nm)对照组 0.358±0.018尿酸组(干预48 h)20 mg/L尿酸干预 0.549±0.036*40 mg/L尿酸干预 0.645±0.019*△60 mg/L尿酸干预 0.770±0.023*△▲F值 245.523
不同浓度尿酸干预48 h对大鼠VSMC活性氧的影响(图1、表3):与对照组相比,不同浓度尿酸干预大鼠VSMC 48 h后细胞活性氧均明显增多, 且活性氧含量随着尿酸浓度升高而增加,差异均有统计学意义(P均<0.01)。

图1 激光共聚焦显微镜下对照组和尿酸组不同浓度尿酸干预下大鼠血管平滑肌细胞活性氧生成情况(n=5,×10)
表3 对照组和尿酸组不同浓度尿酸干预下大鼠血管平滑肌细胞活性氧的平均荧光强度比较(n=5,±s)
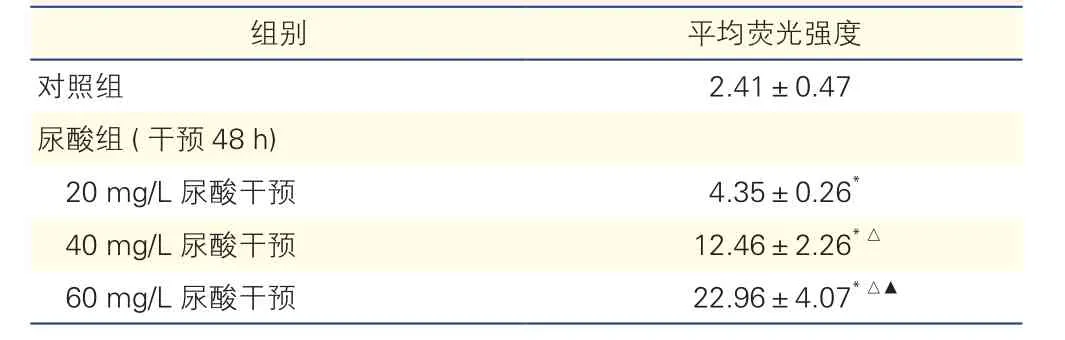
表3 对照组和尿酸组不同浓度尿酸干预下大鼠血管平滑肌细胞活性氧的平均荧光强度比较(n=5,±s)
注:与对照组比较*P<0.01;与尿酸组(20 mg/L尿酸干预)比较△P<0.01;与尿酸组(40 mg/L尿酸干预)比较▲P<0.01
组别 平均荧光强度对照组 2.41±0.47尿酸组(干预48 h)20 mg/L尿酸干预 4.35±0.26*40 mg/L尿酸干预 12.46±2.26*△60 mg/L 尿酸干预 22.96±4.07*△▲
40 mg/L尿酸干预不同时间对大鼠VSMC增殖的影响(表4):对照组及尿酸组40 mg/L尿酸干预下,大鼠VSMC增殖量随孵育时间延长均有所增加;在孵育时间相同的情况下,尿酸组40 mg/L尿酸干预下大鼠VSMC增殖量较对照组均明显增加,差异均有统计学意义(P均<0.01)。

表4 对照组和尿酸组40 mg/L尿酸干预不同时间后大鼠血管平滑肌细胞增殖情况比较(n=5,±s)
40 mg/L尿酸干预 48 h对大鼠VSMC中LOX和MMP-2 mRNA和蛋白表达的影响(图2、图3、表5):与对照组比较,尿酸组(40 mg/L尿酸干预 48 h)大鼠VSMC中LOX、MMP-2 mRNA和蛋白表达量均明显增加(P均<0.01);与尿酸组(40 mg/L尿酸干预 48 h)比较,β氨基丙腈组大鼠VSMC中LOX、MMP-2 mRNA和蛋白表达量均明显下降(P均<0.01)。

图2 逆转录聚合酶链式反应产物电泳显示三组大鼠VSMC中LOX和MMP-2 信使核糖核酸的表达情况

图3 免疫印迹法显示三组大鼠VSMC中LOX和MMP-2蛋白的表达情况
表5 半定量分析三组大鼠VSMC中LOX、MMP-2的mRNA和蛋白表达水平的影响(n=5,±s)

表5 半定量分析三组大鼠VSMC中LOX、MMP-2的mRNA和蛋白表达水平的影响(n=5,±s)
注:VSMC:血管平滑肌细胞;LOX:赖氨酰氧化酶;MMP-2:基质金属蛋白酶-2;mRNA:信使核糖核酸。*:指40 mg/L尿酸干预 48 h的情况下。与对照组比较△P<0.01;与尿酸组比较▲P<0.01
3 讨论
动脉粥样硬化是人类心血管疾病的重要病理基础,因此,防治动脉粥样硬化对于减少心血管疾病负担非常关键。目前公认的动脉粥样硬化发病机理是:内皮细胞受损后其功能及渗透性发生改变,脂质和单核细胞沉积于内皮下形成脂质斑,附着于损伤处的血小板释放生长因子刺激平滑肌细胞进入内膜、增殖合成胶原纤维,最终纤维斑块形成。因此,平滑肌细胞增殖是动脉粥样硬化发生和发展的关键步骤。
自Gertler等[8]首次报道尿酸与冠状动脉粥样硬化性疾病相关后,众多的临床研究证实,血尿酸增高与心血管疾病密切相关[9],并且认为高尿酸血症是心血管疾病的危险因素[10,11]。但高尿酸血症与心血管疾病之间如何关联目前尚不明确。本研究结果显示,不同浓度尿酸(20、40、60 mg/L)干预大鼠VSMC 48 h及40 mg/L尿酸干预不同时间(24、48、72 h)后,细胞增殖量均增加,且呈浓度依赖性和时间依赖性。大鼠VSMC在不同浓度尿酸(20、40、60 mg/L)干预下细胞内活性氧生成量增加,且呈浓度依赖性,这印证了尿酸可通过一系列途径使氧自由基增加,导致氧化应激加重。
LOX在动脉粥样硬化过程中扮演着重要的作用,LOX的调节变化在动脉粥样硬化早、晚期可能有所不同,在动脉粥样斑块形成及破裂过程中,均发现有LOX表达异常[12]。既往我们的研究表明,LOX在心脏重构中扮演重要作用,提取慢性心力衰竭小鼠心肌组织的RNA及蛋白质,LOX可通过p38及核因子-κB信号通路调节心脏重构[13]。此外,刺激成年大鼠VSMC增殖可促进LOX的表达[14]。既往有研究表明,尿酸可刺激大鼠VSMC增殖[15],但尿酸诱导VSMC增殖后是否能调节LOX表达进而促进动脉粥样硬化的发生和发展则未见报道。本研究发现,尿酸诱导VSMC增殖后LOX的表达上调,这与Gacheru等[5]的报道相似,这证实尿酸可上调大鼠VSMC中LOX的表达进而在一定程度上促进动脉粥样硬化的发生和发展。
MMP是一组锌、钙离子依赖的蛋白水解酶家族,特异性地与细胞外基质成分结合并降解细胞外基质,参与炎性反应、缺血缺氧损伤、心血管疾病和癌症等病理过程[16,17]。姜昕等[18]报道,在正常动脉组织中没有检测到MMP活性,而在动脉粥样硬化血管中,随着血管动脉粥样硬化程度加重,MMP的表达量升高。此外有研究表明,心肌梗死动物模型心肌组织中LOX的表达明显上调,心肌组织胶原纤维明显增加,MMP-1表达明显下调,金属蛋白酶抑制因子-1表达无明显变化[19]。在扩张型心肌病中,转化生长因子-β可上调LOX的表达,参与促进胶原纤维的合成并诱导激活MMP活性[20],但在VSMC中LOX能否调节MMP-2的表达进而影响动脉粥样硬化的发生和发展少见报道。我们推测,尿酸可通过诱导大鼠VSMC增殖导致LOX表达增加,进一步诱导MMP-2表达上调。我们发现,尿酸诱导VSMC增殖后MMP-2表达上调,应用LOX的特异性抑制剂β氨基丙腈后,细胞中的MMP-2表达明显下调,这证实尿酸诱导VSMC增殖后LOX表达增加能进一步诱导MMP-2表达上调,加速细胞外基质的降解,进而促进动脉粥样硬化的发生和发展。
综上所述,尿酸诱导大鼠VSMC增殖后LOX表达上调,LOX可进一步上调MMP-2表达,加速细胞外基质的降解而促进动脉粥样硬化的发生和发展,这可能是尿酸促进动脉粥样硬化进展的主要机制之一。但本研究未探索尿酸促进LOX表达的上下游信号通路,这值得进一步研究。

