微血管阻力指数预测经皮冠状动脉介入治疗围术期心肌梗死的价值
刘启云,李江华,刘华东,董少红
经皮冠状动脉介入治疗(PCI)后出现围术期心肌梗死(PPMI)的患者院内不良事件发生率升高,总体预后差[1]。根据指南定义,择期PCI手术中发生PPMI的患者高达30%[2],其发生机制与冠状动脉微循环有关。尽管已知患者发生PPMI的风险因素,但临床上仍无法及时预测PPMI的发生[3]。在介入手术过程中早期预测或发现PPMI,有利于及时调整治疗策略(例如更积极的抗血小板治疗)避免PPMI进展,并最终改善患者的结局。微血管阻力指数(IMR)是近来新用于临床的评价微循环状态的有创参数[4]。目前尚缺乏基线微血管功能状态与PPMI之间的关系的研究,尤其是在稳定性心绞痛患者中,因此,本研究拟探讨在PCI前、后使用IMR评估微血管功能是否有助于及时发现PPMI。
1 资料与方法
研究对象:入选2016-03至2017-04期间在我院住院的55例择期PCI的稳定性心绞痛患者,年龄(67.7±8.52)岁,男性26例,女性29例。1例患者因出现分支闭塞,出现PPMI症状,被剔除分析,54例患者成功接受PCI,根据是否发生PPMI,将54例患者分为 PPMI组(n=24)和无PPMI组(n=30)。排除标准:近3个月内发生的心肌梗死,或者此次干预的血管与过去12个月的心肌梗死罪犯血管为同一支血管,心电图提示左心室肥大,急性发作性疾病,慢性心房颤动,左心室功能障碍(左心室射血分数≤35%),冠状动脉旁路移植术史,双重抗血小板治疗禁忌证,严重瓣膜性心脏病或病变涉及大侧支(>2.0 mm),严重肾损伤[估算肾小球滤过率(eGFR)<30ml/(min·1.37m2)],慢性肾功能衰竭导致的长期行血液透析患者。按指南标准[2],术后12~24 h 复测超敏肌钙蛋白 I(hs- TnI),hs- TnI升高超过99%参考值上限的3倍定义为发生PPMI。
血液hs- TnI水平测定[5]:术后12 h内采集肘静脉血至少2 ml,依地酸二钠抗凝试管保存,30 min内测定hs- TnI水平。所用仪器为日本三菱公司PATHFAST全自动快速化学发光免疫分析系统,可检测N末端B型利钠肽原(NT-proBNP)范围 0~50 ng/ml。
血流储备分数(FFR)及IMR检查:术前常规服用抗血小板药物,术中动脉肝素化,6 F指引导管进入冠状动脉口,冠状动脉内注入硝酸甘油200 μg,充分扩张冠状动脉。经指引导管推送冠状动脉温度/压力导丝,导丝到达冠状动脉口处,校正压力与温度信号。然后将导丝头端放到狭窄远端至少2/3处。通过外周静脉注射腺苷[140 mg/(kg·min)]。在目标冠状动脉中测量IMR及FFR:用注射器从指引导管内弹丸式注射3 ml室温生理盐水,记录热稀释曲线,通过计算两条热稀释曲线之间的时间差,计算盐水从指引导管到达导丝头端温度感受器的时间,即平均传导时间(Tmn)。重复测量3次,取其平均值。同时记录冠状动脉口压力(Pa)及狭窄远端冠状动脉压力(Pd)为Pd 1。球囊扩张的同时,记录冠状动脉楔压(Pw)。PCI完成后,再次测量狭窄远端同一部位的冠状动脉压力为Pd2。IMR校正计算 公 式:IMR=Pa×Tmn×[(Pd-Pw)/(Pa-Pw)]。FFR=Pd1/Pa。同样测量计算造影正常冠状动脉的IMR。计算术前相对IMR比值(rPIMR),即靶血管PCI前IMR与血管造影正常冠状动脉的IMR比值。PCI后每6 h测量一次hs- TnI,持续至术后18~24 h。
统计学处理:采用SPSS16.0软件进行统计学分析。计量资料以±s表示,两组间差异比较采用独立样本t检验;计数资料以百分比表示,两组间差异比较采用卡方检验。相关分析采用Spearman等级相关分析法;绘制受试者工作特征(ROC)曲线并用抛物线估算法(Simpson)计算出曲线下面积(AUC),评估PCI术前及术后IMR、球囊扩张次数及rPIMR对PPMI的预测价值,分点计算其敏感度、特异度。以P<0.05为差异有统计学意义。对单因素分析有统计学差异的连续型变量进一步行Logistic回归分析,连续型变量采用四分位数法、等间距法将其转变成有序分类变量并进行赋值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线特征比较(表1)
两组患者的基线特征,包括临床特征和冠状动脉病变分型等方面差异均无统计学意义(P>0.05)。
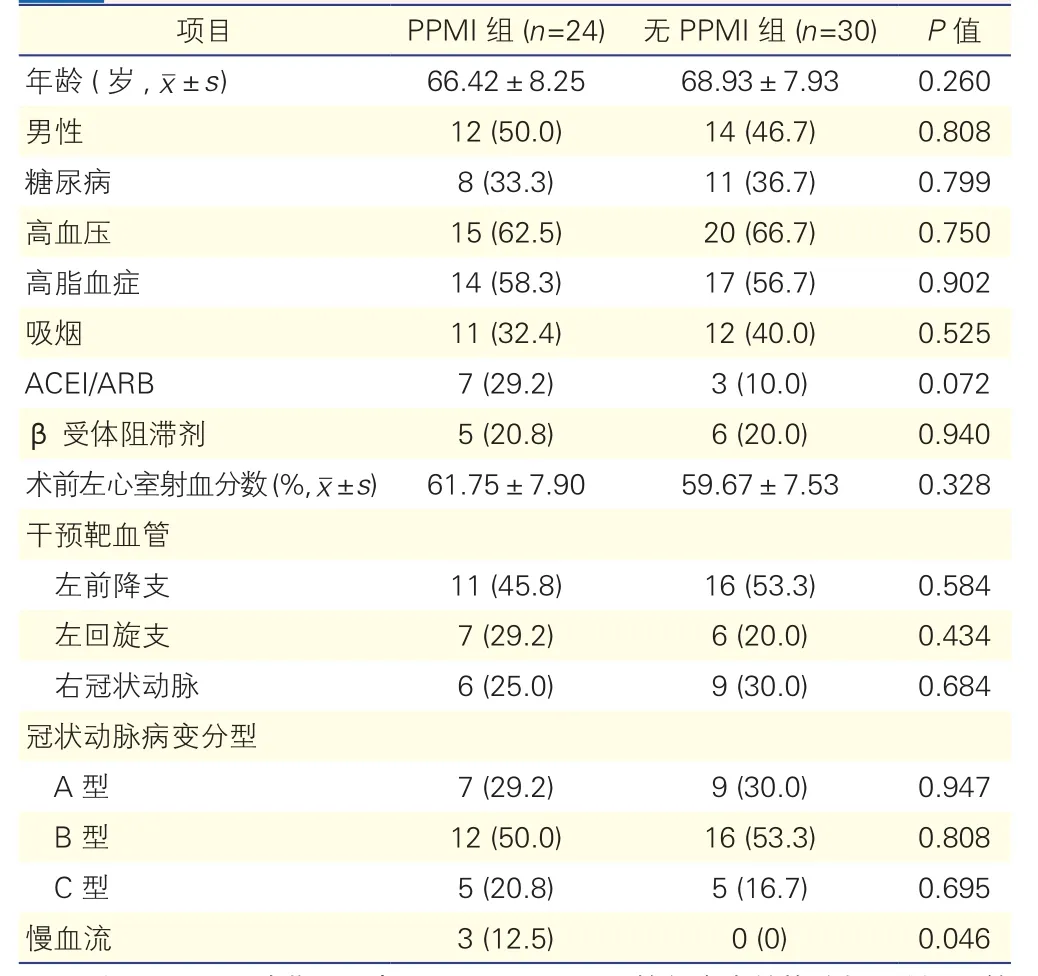
表1 两组患者基线特征比较[例(%)]
2.2 两组患者的冠状动脉生理指标和球囊扩张情况比较(表2)
两组患者的PCI前及PCI后FFR、正常冠状动脉的IMR值差异均无统计学意义(P>0.05);PPMI组患者PCI前、术后IMR及rPIMR均高于无PPMI组(P均<0.05)。同组患者手术前、后比较显示,PPMI组术后的IMR较术前明显升高(25.86±3.04 vs 22.02±2.92,P<0.05); 但 无 PPMI组 术 后 的IMR与术前比较差异无统计学意义(18.96±2.84 vs 17.46±3.43,P=0.07)。与无PPMI组比较,PPMI组接受了预扩(70.8% vs 36.7%,P<0.05)及后扩(54.2%vs 23.3%,P<0.05)的患者较多,并且PPMI组患者的球囊扩张次数多于无PPMI组患者[(4.33±1.79)次vs (3.20±1.63)次,P<0.05]。
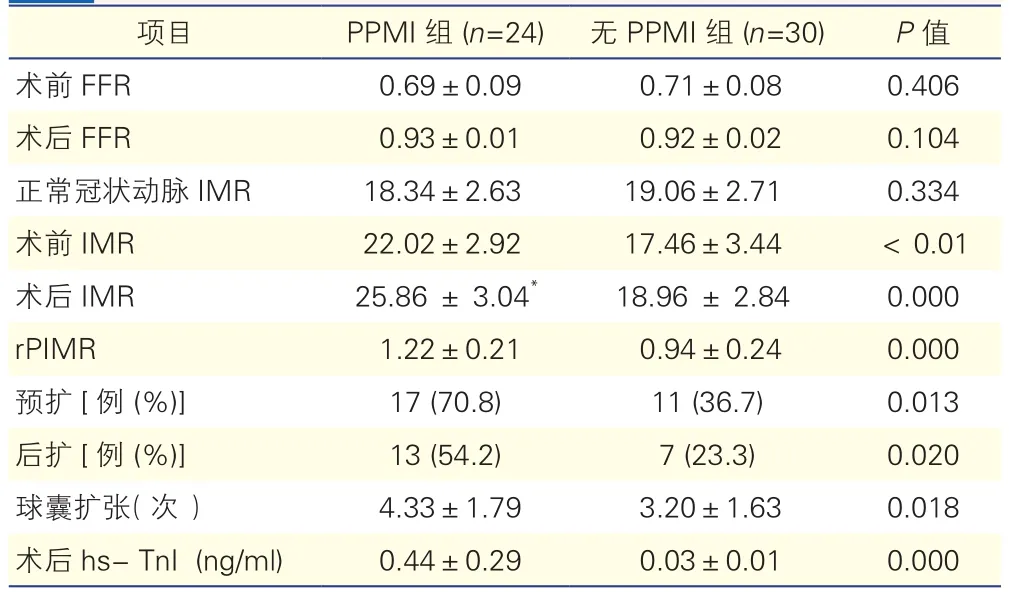
表2 两组患者的冠状动脉生理指标和球囊扩张情况比较
2.3 IMR与hs- TnI的相关分析(图1)
PCI前、后IMR均与hs- TnI呈正相关(r=0.473,r=0.458,P均 <0.05)。
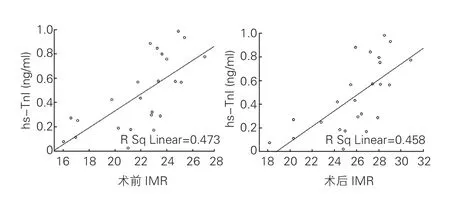
图1 IMR与hs- TnI的相关分析
2.4 ROC曲线分析(图2)
PCI前IMR预测PPMI的AUC为 0.831(95%CI:0.719~0.942,P<0.05),PCI后 IMR 预 测 PPMI的AUC 为 0.941(95%CI:0.884~0.998,P<0.05), 球囊扩张次数预测PPMI的AUC为0.689(95%CI:0.544~0.834,P=0.018)。rPIMR 预 测 PPMI的 AUC为 0.847(95%CI: 0.738~0.956,P<0.05)。使用 ROC曲线,术前IMR检测PPMI的最佳临界值为16.62,敏感度为95.8%,特异度为50.0%。术后IMR检测PPMI的最佳临界值为19.91,敏感度为95.8%,特异度为77.0%。扩张次数检测PPMI的最佳临界值为3.5,敏感度为75.0%,特异度为56.7%。rPIMR检测PPMI的最佳临界值为1.02,敏感度为91.7%,特异度为76.7%。
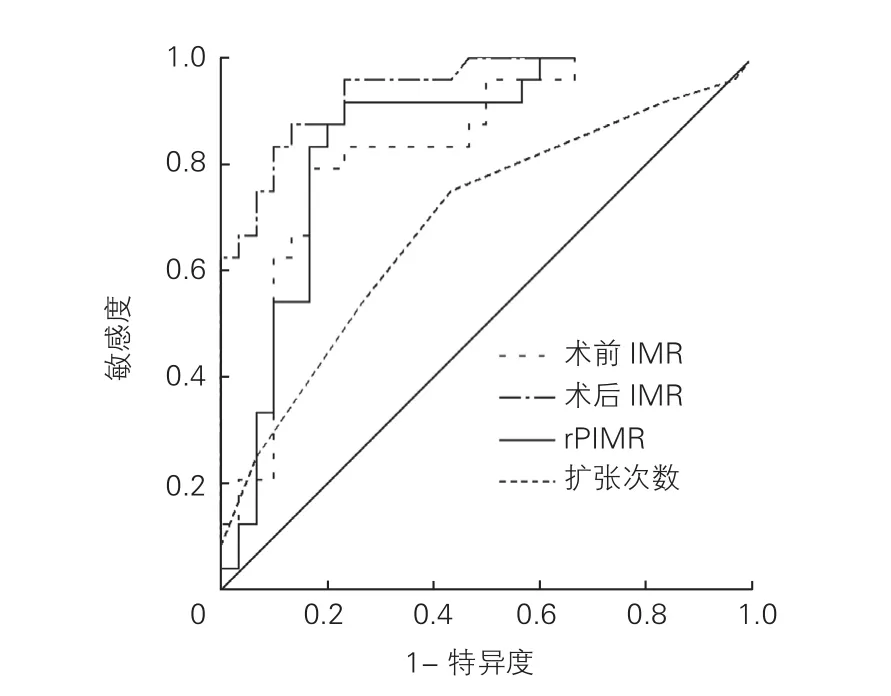
图2 术前IMR、术后IMR、扩张次数及rPIMR的ROC曲线分析
2.5 Logistic回归分析(表3)
连续型变量采用四分位数法、等间距法将其转变成有序分类变量,赋值说明如下:术后hs- TnI(≤ 0.026 ng/ml =1,0.027~0.036 ng/ml =2,0.037~0.117 ng/ml =3,≥0.118 ng/ml =4);术前IMR(≤16.12=1,16.13~17.91=2,17.92~21.94=3, ≥ 21.95=4); 术 后IMR( ≤ 17.67=1,17.68~19.42=2,19.43~24.87=3,≥ 24.85=4);rPIMR:( ≤ 0.82=1,0.83~0.99=2,1.00~1.11=3, ≥ 1.12=4);二分类反应变量的非条件Logistic回归分析,采用进入法回归分析(入选标准0.05,筛出标准0.10),最后进入Logistic回归模型的影响因素有3个,回归系数显示术前IMR(OR=3.501,95%CI:0.974~12.582,P=0.037) 术 后IMR(OR=15.074,95%CI:3.915~31.705,P=0.015)rPIMR(OR=2.104,95%CI:1.672~2.375,P=0.046)与PPMI独立相关。
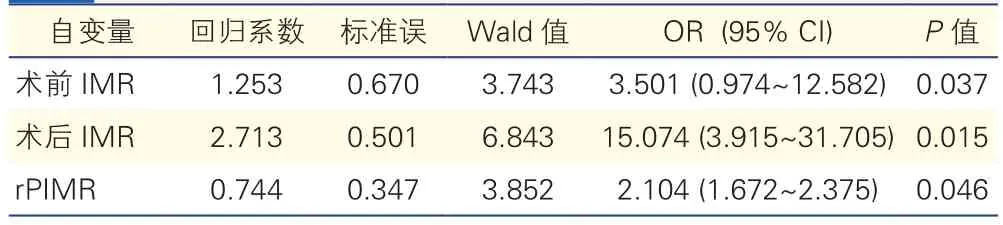
表3 发生PPMI的危险因素Logistic分析
3 讨论
冠状动脉微循环结构和功能受损是PCI后心肌梗死发生的主要原因[6],是冠心病患者不良预后的独立预测因素。研究表明,术前微循环系统的基础功能状态也是PCI术后出现心脏损伤的重要影响因素。目前对冠状动脉微循环评价主要有两种方法[7]:一是冠状动脉血流储备(CFR),即冠状动脉最大充盈时血流与基础状态血流之比,CFR无法区分心外膜大血管及微循环异常对冠状动脉血流的影响,且易受到血流动力学影响,重复性差。二是IMR,IMR是近来用于临床新的评价微循环状态的参数[4],代表峰值血流通过时微血管的阻力。通过公式计算IMR,不受心外膜狭窄病变、血流动力学状态等因素影响,重复性强[8]。在ST段抬高型心肌梗死患者中,IMR与心脏核磁共振成像(MRI)显示的微血管阻塞区域呈良好的相关[9]。此外,Kitabata等[10]已经表明,在稳定性心绞痛随机分为直接或常规支架置入策略的患者中,PCI后肌钙蛋白升高的患者具有较高的IMR值。PPMI的关键问题是PCI术中及术后不能及时被发现,影响患者预后[11]。因此,我们探讨在PCI之前和之后使用IMR评估微血管完整性将有助于术中及时预测、发现PPMI患者。
发生PPMI的风险因素包括多个方面:患者相关因素(如高龄、糖尿病、肾损伤、多器官疾病、心功能不全)和程序相关因素(如复杂病变、使用斑块旋切术、血栓负荷等)[10]。尽管术前已明确这些高危因素的患者,但仍然有接近30%的患者发生PPMI[10]。许多研究也在致力于早期识别具有PPMI风险的患者。
PPMI的发病机制涉及诸多因素,最终都导致部分冠状动脉微循环障碍并产生心肌坏死。冠状动脉支架置入术后,发生PPMI有两个主要机制[12],约有25%的患者在置入支架前后发生支分血管闭塞造成PPMI,而这在造影时并不一定能够被发现。另一个更常见的机制涉及远端微循环栓塞。Herrmann等[12]研究证实了PCI过程中多普勒检测的微栓塞与发生PPMI相关的证据,其研究显示术后IMR>20是PPMI的独立预测因子。与包括预扩在内的传统策略相比,直接支架置入策略的患者,具有较低的术后IMR。事实上,球囊扩张的次数也与PCI后肌钙蛋白升高有关,推测更多的进行球囊扩张及支架后扩,使得术前已经受损的目标冠状动脉远端微循环更容易遭受缺血性损伤,导致PPMI发生[13]。
但目前还没有统一关于IMR正常值的认识。在主要研究ST段抬高型心肌梗死患者人群中,IMR>32或IMR>33的值与左心室活力缺乏相关[12,14]。Melikian等[15]研究证实,正常冠状动脉患者的平均IMR为19,我们研究显示正常冠状动脉平均IMR为18.34,发生PPMI患者的平均IMR,PCI前大约为22.02,PCI后为25.86,几乎与早期研究公布的数据一致。此外,PCI后肌钙蛋白水平阳性的患者PCI后的IMR值较高。然而这些研究未涉及PCI前的IMR值。因此,基线微血管功能与PPMI之间的关系尚未得到充分研究。本研究发现PCI前IMR高的患者更易发生PPMI。
本研究中我们创新性使用了rPIMR,也对PPMI的发生具有较好的检测价值。假设心肌内微血管阻力是均匀的,当使用正常冠状动脉作为对照时,rPIMR可以反应目标冠状动脉微循环相对整个冠状动脉微循环的功能状况。我们的研究结果表明,rPIMR高的患者更容易发生PPMI,表明微血管功能的局部损伤,易于发生PPMI。本研究中rPIMR的最佳临界值为1.02,敏感度为91.7%,特异度为76.7%。
本研究表明,PCI前IMR值和rPIMR值升高,与冠心病患者择期PCI发生PPMI相关。这表明发生PPMI的患者具有更多病变的微血管床,不能应对进一步的缺血性损伤,例如球囊扩张和支架置入。因此,测量术前IMR和rPIMR可以识别病变的“潜在栓塞”可能。临床上,测量IMR的技术可用于识别发生PPMI风险增加的患者。在常规FFR评估中可以轻松执行,所以一旦进行病变的血液动力学意义评估,也可以评估PPMI的风险。我们还表明,球囊扩张的次数在PPMI的发生中也是重要的因素。早期及时进行评估可能指导临床采取积极的治疗措施,如使用血小板糖蛋白(GP)Ⅱb/Ⅲa受体抑制剂或直接支架置入策略,以尽量减少发生PPMI的风险。旨在减少PCI前的IMR值的靶向策略是否会导致结局改善尚有待进一步研究。

