矮金莲花种子吸胀过程中内源激素含量的变化
张雁明, 卜海燕, 赵 迪, 徐当会, 刘 坤, 齐 威
(兰州大学生命科学学院 草地农业生态系统国家重点实验室, 甘肃 兰州 730000)
种子萌发受多种环境因子的影响。足够的水分、适宜的温度和充足的氧气是种子萌发的3个必须条件,光照作为一种重要的环境因子也影响种子萌发[1]。内源激素含量和比例以及种子对内源激素的敏感性均影响种子萌发[2]。吸胀作为种子萌发的起始阶段,对种子萌发起着至关重要的作用[3]。
矮金莲花(TrolliusfarreriStapf)全草均可入药,主治伤风、感冒,主要分布在云贵高原和青藏高原[4]。目前,仅见矮金莲花种子萌发特性方面的研究[5],其种子萌发各阶段的生理变化尚不明确。本研究对矮金莲花种子吸胀阶段吸水率和内源激素含量变化进行了初步研究,以期为快速打破矮金莲花种子休眠提供科学依据,进而提高其种苗的人工繁育效率,为其人工栽培提供技术支持。
1 材料和方法
1.1 材料
供试矮金莲花种子于2014年9月至10月在青藏高原东北缘甘肃省甘南藏族自治州境内兰州大学高寒草甸与湿地生态系统定位研究站附近采集,海拔约2 900 m。随机采集50株以上植株自然脱落的种子,室内自然干燥,清理干净并混匀后装入信封中,置于4 ℃冰箱保存。
1.2 方法
于2017年4月,选取成熟饱满的种子在GTOP-380B光照培养箱(浙江托普仪器有限公司)中进行吸胀实验,设置光照(光照度12 000 lx,光照时间12 h·d-1)和黑暗2种条件。参照青藏高原高寒草甸5月至8月生长季均温设定光照培养箱昼温25 ℃、夜温10 ℃。使用BAS124S电子天平〔精度0.1 mg,赛多利斯科学仪器(北京)有限公司〕称取种子,每份约1 g,并逐一标记。将种子置于玻璃培养皿(直径9 cm)中用蒸馏水浸种,每个培养皿1份种子。种子吸胀过程自蒸馏水浸种开始,满24 h记为1 d,至种子萌发结束。分别于光照条件下吸胀1、3、5和7 d以及黑暗条件下吸胀1、3、5、7和9 d取种,每次取3个培养皿,滤纸吸干表面水分后称取各培养皿中种子质量,根据公式“吸水率=〔(吸水后某培养皿中种子质量-吸水前该培养皿中种子质量)/吸水前该培养皿中种子质量〕×100%”计算种子的吸水率,结果取平均值。以未浸种的种子为对照,记为吸胀0 d。
参考文献[6]采用高效液相色谱法测定种子中ZT、GAs、IAA和ABA的含量。
1.3 数据分析
采用SPSS 22.0统计分析软件进行实验数据的统计分析,采用Duncan’s新复极差法进行多重比较,采用Origin 2017软件制图。
2 结果和分析
2.1 种子吸水特性分析
光照和黑暗条件下矮金莲花种子吸水过程基本一致(图1)。吸胀0~1 d为快速吸水期,吸水率迅速升高,主要为吸胀力吸水;吸胀1~3 d为缓慢吸水期,吸水率缓慢升高,吸水渐趋饱和;吸胀3 d后种子几乎不再吸水,为吸水停滞期,吸水率稳定。种子萌发(光照和黑暗条件下分别吸胀7和9 d)时光照和黑暗条件下的吸水率差异不显著(P>0.05)。
2.2 种子内源激素含量分析
光照和黑暗条件下矮金莲花种子内源激素含量的动态变化见表1。结果显示:光照和黑暗条件下矮金莲花种子中ZT含量在吸胀过程中总体上较低,其中,在吸胀3 d均最低(分别为0.45和0.26 μg·g-1),分别在吸胀5和9 d达到最高(分别为1.08和0.58 μg·g-1)。光照和黑暗条件下,吸胀过程中GAs含量均较高。随着吸胀时间的延长,光照条件下GAs含量基本呈逐渐升高的趋势,黑暗条件下呈“降低—升高—降低”的趋势,且不同吸胀时间的GAs含量差异不显著(P>0.05)。随着吸胀时间的延长,光照条件下IAA含量呈先降低后升高的趋势,在吸胀7 d最高(4.04 μg·g-1),且与其他吸胀时间差异显著(P<0.05);黑暗条件下IAA含量呈波动变化,在吸胀1和7 d较低,在吸胀9 d最高(4.68 μg·g-1)。光照和黑暗条件下,吸胀过程中ABA含量总体上较低,且基本呈逐渐升高的趋势,并分别于吸胀7和9 d达到最高。
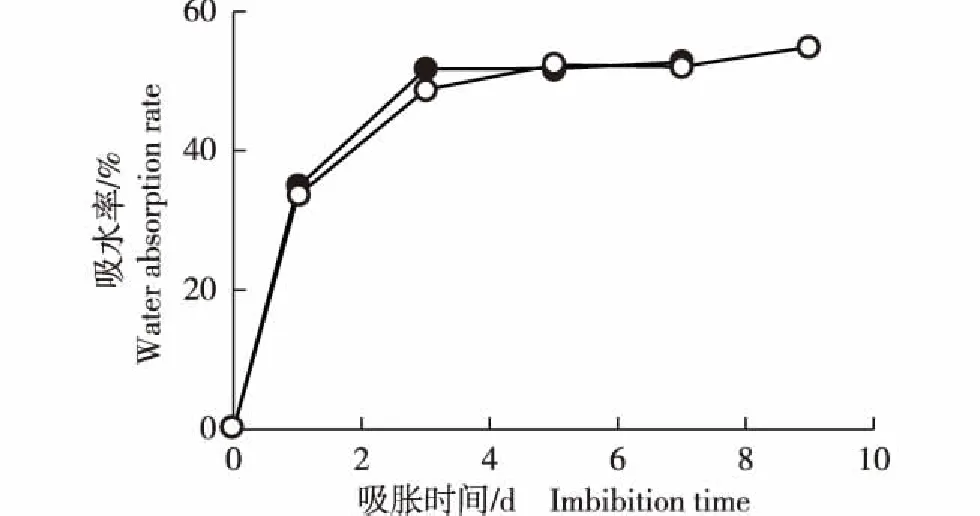
—○—: 光照Light; —●—: 黑暗Dark.图1 光照和黑暗条件下矮金莲花种子吸水率的动态变化Fig. 1 Dynamic change of water absorption rate in seeds of Trollius farreri Stapf under light and dark conditions
表1光照和黑暗条件下矮金莲花种子内源激素含量的动态变化1)
Table1DynamicchangeofendogenoushormonecontentinseedsofTrolliusfarreriStapfunderlightanddarkconditions1)

吸胀时间/dImbibition timeZT含量/(μg·g-1)ZT contentGAs含量/(μg·g-1)GAs contentIAA含量/(μg·g-1)IAA contentABA含量/(μg·g-1)ABA contentZT/ABA比ZT/ABA ratioGAs/ABA比GAs/ABA ratioIAA/ABA比IAA/ABA ratio光照Light黑暗Dark光照Light黑暗Dark光照Light黑暗Dark光照Light黑暗Dark光照Light黑暗Dark光照Light黑暗Dark光照Light黑暗Dark00.61c0.61a403.54a403.54a3.38b3.38bc0.51c0.51d1.20a1.20a791.25a791.25a6.63a6.63a10.69b0.47ab407.09a374.61a3.28b2.46d0.78b0.77c0.88b0.61bc521.91b486.51c4.21b3.19c30.45d0.26c417.63a414.93a3.08b4.03ab0.86b0.90b0.52c0.29e485.62b461.03c3.58b4.05b51.08a0.36bc453.46a427.23a3.33b3.12cd0.94ab0.77c1.15a0.47d482.40b554.84b3.54b4.05bc70.47d0.54a451.36a444.27a4.04a3.00cd1.04a0.86bc0.45c0.63b434.00b516.59c3.88b3.49c90.58a409.68a4.68a1.11a0.52cd369.08c4.22bc
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
光照和黑暗条件下ZT/ABA比分别在吸胀7和3 d最低,分别为吸胀0 d的38.00%和24.17%;分别在吸胀5和9 d达到峰值。光照条件下吸胀1 d GAs/ABA比迅速下降,之后缓慢下降;黑暗条件下GAs/ABA比呈“降低—升高—降低”的趋势。随着吸胀时间的延长,光照和黑暗条件下IAA/ABA比的变化趋势与IAA含量基本一致,IAA/ABA比在种子吸胀开始后迅速下降,吸胀1 d分别为吸胀0 d的63.05%和48.42%,之后保持在较低水平,且均在种子萌发时小幅升高。
3 讨 论
种子吸胀是植物种子进化过程中适应环境的结果。种子吸胀至饱和所需时间及吸水量与种子自身形态(如千粒质量)和种子生境的降水量等气候因子有关[7-8]。本研究中,矮金莲花种子从干种子至吸胀饱和所需时间较长,可能与种皮的不透气性和不透水性有关。光照条件下矮金莲花种子萌发起始时间较黑暗条件早,说明光照利于其种子萌发。
植物内源激素在种子休眠和萌发过程中发挥着极其重要的作用,尤其是ABA和GA[9-10]。李魏飞[11]认为,马尾松(PinusmassonianaLamb.)种子萌发期GA3含量不断升高对种子萌发具有一定的促进作用。油松(PinustabuliformisCarr.)种子萌发初期胚乳中细胞分裂素含量升高迅速,能促进种子萌发、增强胚的膜透性及促进GA释放,为胚的生长提供充足的物质和能量[12]。本研究中,矮金莲花种子吸胀过程中,ZT、IAA和ABA含量均较低,GAs含量较高且保持缓慢升高并于吸胀后期达到最高,对促进种子萌发具有重要作用。IAA含量升高可能对种子萌发、种子萌发后根系伸长、幼苗建植和芽的生长具有重要作用,而ZT含量在吸胀后期达到最高,对种子萌发具有正调控作用,与解除种子休眠和抑制ABA作用相关。ABA属于内源抑制类激素,具有诱导种子休眠、抑制种子萌发、抑制GA生物合成及其信号传导等作用[13]。多数研究认为,随着植物种子休眠的解除,ABA含量降低,但也有报道称种子对ABA的敏感性与种子休眠密切相关。而郑秀珍[14]的研究结果表明:刺槐(RobiniapseudoacaciaLinn.)种子发芽时ABA含量升高。Goggin等[9]认为,硬直黑麦草(LoliumrigidumGaud.)种子胚中的ABA浓度在种子萌发过程中具有重要作用,但并不是解除休眠的主要原因,可能与种子对ABA的敏感性有关。本研究中,ABA作为萌发抑制类激素,在吸胀过程中其含量持续小幅度升高,并在吸胀后期达到最高,但GAs含量一直处于较高水平,并未显著降低。表明ABA并未抑制GAs生物合成或者促进GAs代谢分解,可能对GAs的信号通路表现出一定的抑制作用,也可能是吸胀后期产生的ZT较多抑制了ABA的作用,导致种子对ABA的敏感性降低。
种子休眠和萌发是复杂的生理调控过程,不是由某一种内源激素单独调控,而是由多种内源激素协同作用、互相调节,使各种内源激素保持在一个平衡的浓度范围[14]。陈志颖等[15]在研究DHAP处理对天山云杉(Piceaschrenkianassp.tianschanica)种子萌发过程中内源激素比值的影响时发现,过高和过低的ABA/(ZT+GA3+IAA)比均不利于种子萌发。本研究中,未浸种(吸胀0 d)种子中ZT/ABA、GAs/ABA和IAA/ABA的比值均较高,吸胀1 d急速吸水,各激素比值急速下降,但萌发前激素比值总体较稳定,这可能是为种子萌发做充分准备,也表明激素比值过高可能不利于种子萌发。
综上所述,矮金莲花种子的休眠解除和萌发启动不一定是萌发促进类激素的绝对升高或者萌发抑制类激素的绝对降低引起的,其种子萌发过程中多种内源激素协同作用,每一阶段都有不同的内源激素表达。

