非洲猪瘟——我国养猪业的重大威胁
罗玉子,孙元,王涛,仇华吉
非洲猪瘟——我国养猪业的重大威胁
罗玉子,孙元,王涛,仇华吉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨 150069)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)感染家猪和野猪引起的一种烈性传染病,急性型临床上表现为高热、沉郁、厌食、皮肤发绀、各脏器出血,发病率和病死率可高达100%。世界动物卫生组织(OIE)将其列为法定报告动物疫病,我国将其列为一类动物疫病,是我国重点防范的外来动物疫病之一。ASF在撒哈拉以南的非洲地区、意大利撒丁岛、高加索地区以及俄罗斯和东欧部分国家流行,给疫区国家的养猪业造成巨大的经济损失,并严重冲击畜产品的国际贸易。2018年8月,ASF首次传入我国,随后迅速大范围蔓延,对我国养猪业构成重大威胁,防控形势异常严峻。随着经济全球化发展,ASF呈全球流行态势,持续传入我国的风险极高。鉴于目前无商业化的ASF疫苗,亟需研发可实现现场快速检测的早期诊断技术,做到对疫情早发现、早控制。由于ASFV具有庞大的基因组结构和复杂的免疫逃逸机制,使得研制有效的疫苗十分困难。目前研制的灭活疫苗、亚单位疫苗和核酸疫苗不能提供免疫保护或仅能提供部分保护,而减毒活疫苗和基因缺失疫苗可以诱导完全的同源保护和部分的交叉保护。未来需要深入解析病毒毒力相关基因和免疫保护性相关抗原,并着力研制基因缺失疫苗和弱毒疫苗,解决其安全性、稳定性和免疫效力等难题。本文就ASF的流行病学、诊断技术和疫苗研发等方面的最新研究进展及防控面临的挑战进行综述,并提出防控策略及建议,以期为我国ASF的防控提供参考。
非洲猪瘟;中国;流行病学;诊断;疫苗;防控策略
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染家猪和野猪引起的一种烈性传染病。不同日龄的猪均易感,临床表现为高热、皮肤发绀和各脏器出血,发病率和死亡率可高达100%,给疫区国家的养猪业造成了巨大的经济损失,并冲击生猪产业的国际贸易[1]。该病被世界动物卫生组织(OIE)列为法定报告的动物疫病,是我国重点防范的外来动物疫病之一,目前尚无有效疫苗和治疗药物。
目前ASF主要在撒哈拉以南的非洲地区、意大利撒丁岛、高加索地区以及俄罗斯和东欧部分国家流行[1-5]。2018年8月,该病首次传入我国[6],突如其来的ASF给我国养猪业带来空前的危机。我国生猪养殖规模大,很多猪场生物安全条件差,生猪跨区域调运频繁,因此该病在我国大范围扩散和流行的风险极高。同时,我国与非洲、欧洲多国以及俄罗斯的贸易日益频繁,加剧了ASF再次传入我国的风险。本文从ASF的病原学、流行病学、诊断和疫苗最新研究进展以及防控面临的挑战等方面进行概述,以期提高相关人员对该病的认识,增强相关部门的检疫防范意识,为我国ASF防控提供参考。
1 病原学
ASFV为有囊膜的双链DNA病毒,是非洲猪瘟相关病毒科()非洲猪瘟病毒属()的唯一成员[7-8]。该病毒具有20面体对称结构,直径为175—215 nm,由内至外依次由病毒基因组、内核心壳、双层内膜、衣壳和囊膜5部分构成(图1)。基因组全长170—194 kb,编码150—200种蛋白[7-8]。
ASFV结构蛋白较多,其中p72是主要的结构蛋白之一,该蛋白序列较保守,猪只感染ASFV后可诱导机体产生针对该蛋白的高滴度的抗体,常作为ASF血清学诊断的主要靶标。另外,ASFV基因组变异频繁,具有遗传多样性。根据p72基因末端一段478 bp的核酸序列,可将ASFV划分为24个基因型[9-10]。
ASFV基因组结构比较特殊,其末端是由37个核苷酸(nt)组成的共价闭合环(loop)结构,紧邻末端的是串联重复序列和多基因家族,中间是一段比较保守的基因序列(图2)。ASFV的复制机制与痘病毒相似[7],其复制的主要靶细胞是单核细胞、巨噬细胞。病毒可通过巨胞饮或者网格蛋白介导的内吞作用侵入宿主细胞,脱去内膜后主要在胞质中进行转录和翻译,在病毒“工厂”进行组装,然后通过出芽方式释放到细胞外,进入下一轮感染周期[11-12]。
ASFV耐低温,56℃ 70 min或60℃ 20 min可灭活病毒,对乙醚和氯仿敏感。2%氢氧化钠、2%—3%次氯酸钠、0.3%福尔马林、3%邻苯基酚或碘化合物作用30 min,均可灭活该病毒。ASFV在感染猪的污染物中可存活1个月,在腐败的血液或冷鲜肉中可存活近4个月,在冷藏的猪血液中可存活18个月,在冰冻猪肉或肉制品中可以存活数年至数十年,在未熟的肉品、腌肉、泔水中可长时间存活。

图2 ASFV基因组结构示意图
2 流行病学
ASFV可感染家猪和野猪引起高热、广泛性出血和高死亡率,而对于非洲野猪,如疣猪(warthogs)和非洲丛林野猪(bushpigs)则呈隐性感染[13]。非洲钝缘蜱属()的软蜱是ASFV的自然宿主和传播媒介。
ASF的潜伏期一般为3—19 d,急性型一般3—4 d,OIE法典规定的潜伏期为15 d[4]。根据毒力和临床表现差异,可将ASF分为最急性型(强毒株)、急性型(强毒株)、亚急性型(中等毒力毒株)和慢性型(弱毒株)。最急性型常无临床症状,突然死亡,死亡率高达100%;急性型发病率和死亡率可达100%,表现为高热(可达42℃),沉郁、厌食,耳、四肢、腹部等处的皮肤发绀,内脏广泛性出血,其中脾脏肿大出血是ASF的重要鉴别特征;亚急性型和慢性型较急性型病情轻,病死率低,病程可持续数周至数月,可见血清学转阳。
1921年肯尼亚首次报道ASF疫情[14],随后该病流行于撒哈拉以南的非洲地区。据报道ASFV早已在东非和南非的疣猪和非洲钝缘软蜱中存在了多个世纪[15]。经历了上世纪50至80年代从非洲大陆到欧洲和美国的几段长距离传播之后,近30年以来,除了意大利的撒丁岛,ASF局限于非洲地区。直到2007年,ASF从非洲老疫区传播至东欧的格鲁吉亚,随后迅速蔓延至整个高加索地区和俄罗斯联邦等地。该病于2012年传入乌克兰,2013年传入白俄罗斯,2014年传入波兰、立陶宛、拉脱维亚、爱沙尼亚,2016年传入摩尔多瓦,2017年传入捷克和罗马尼亚,2018年8月传入中国和比利时[1-6]。这是比利时时隔33年再次爆发ASF疫情。截止到目前,全球近60个国家发生过ASF疫情。ASF自2018年8月首次传入我国辽宁以来,不到3个月时间迅速蔓延至河南、江苏、浙江、安徽、黑龙江、内蒙古和吉林、天津、山西、云南、湖南、贵州等13个省(直辖市、自治区)[4,6],累计爆发疫情50多起,扑杀猪只超过20万头,疫情呈现区域流行态势,进一步扩散和蔓延的风险极高,防控形势异常严峻。同时,近年来全球ASF疫情明显抬头,在俄罗斯和东欧国家不断蔓延,并呈持续扩散态势。俄罗斯ASF疫情异常严峻,仅2018年已爆发疫情上百起,其境内野猪的潜在感染使得该病在俄罗斯快速根除的可能性很小。我国作为猪产品最大的进口国,与非洲、欧洲以及俄罗斯等周边国家的贸易不断增多,使ASF再次传入我国的风险极高。
2.1 传染源
感染ASFV的家猪、野猪、软蜱,猪肉及其制品、受污染的饲料、运输车辆、人员、设施等均为重要的传染源。家猪对ASFV高度易感,一旦感染可出现高热、出血和高死亡率,是疫情扩散的主要传染源[16]。非洲疣猪分布广泛,与家猪和生活在洞穴中的钝缘蜱接触机会较多,因此是ASFV在非洲最重要的感染源。软蜱通过叮咬带毒疣猪而被感染,再通过叮咬易感猪而传播病毒。非洲丛林猪感染ASFV后其病毒血症可持续91 d,但不表现病症[17]。亚临床感染、慢性感染或耐过猪是重要的传染源。这些猪在长达数周内仍具有感染性,可通过软蜱叮咬或直接及间接接触将疫病传染给其他易感猪[18]。非洲巨型森林猪很少受ASFV感染[19],在疫病传播中的作用较小。
2.2 传播方式
ASF的宿主和传播媒介涉及家猪、各种野猪和部分软蜱,在其间保持着复杂的循环。在非洲,软蜱感染ASFV后通过叮咬传染给野猪,未感染ASFV的软蜱通过叮咬感染的野猪获得病毒,通过叮咬再感染其他野猪,形成“野猪-软蜱-野猪”循环(森林循环),另外还存在家猪-家猪和野猪-野猪循环(图3)。
从野生宿主到家猪的传播机制还不完全清楚[19]。南非野猪和家猪之间杂交、家猪误食带毒的野猪肉、家猪与野猪共存区域通过蜱传播给家猪都可能为ASFV的传播提供机会。ASFV一旦传入家猪,感染猪的排泄物、分泌物、血液、组织等均含有病毒,成为危险的传染源。ASFV可通过直接接触感染猪尸体、污染物、肉制品在地区甚至国际范围内传播[20-21]。
2.3 分子流行病学
分子流行病学研究对调查ASF的流行病学模式以及病源的追溯具有重要作用。最初通过ASFV基因组限制性酶切图谱分析及测序技术,根据基因组长度的差异来分析病毒流行情况。目前主要先基于p72(B646L)基因分型,再根据B602L、E183L或CP204L基因进一步区分亚型[22]。基于B646L基因已鉴定出24个基因型[8-9],其中20个基因型仅存在于东非和南非[23]。基因I型或称ESAC-WA基因型,由欧洲、南美洲、加勒比海和西非等地区的分离株组成[24]。最近流行于高加索和俄罗斯的ASFV为基因II型[2]。基因II型ASFV最初很可能是从莫桑比克传入马达加斯加。在非洲东部和南部,一些基因型(如VIII和XIX)高度同源,这些毒株可能仅限于猪之间传播,或在猪与寄生于家猪的蜱间传播。另外一些基因型(如V、X、XI、XII、XIII和XIV)毒株同时存在于猪-蜱循环和猪-猪循环[25-26]。遗传多样性也可能受到不同分离株协同感染、重排和病毒进化的影响[27]。我国爆发的ASF疫情是由ASFV基因II型毒株引起[6]。不同ASFV基因型地理分布不同(图4),这说明了ASF流行病学的复杂性。

图3 ASFV的传播循环
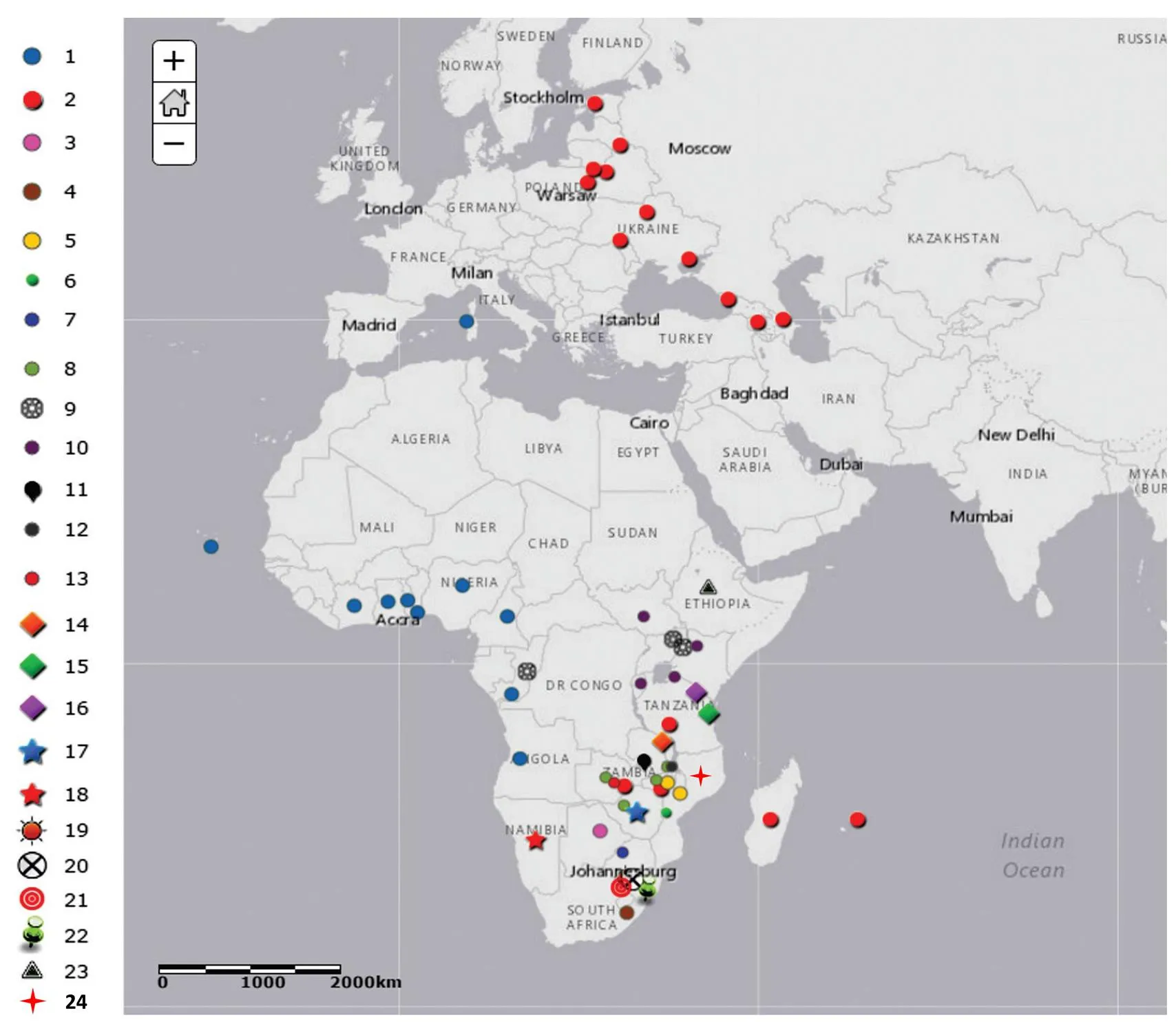
图4 ASFV不同基因型及地理分布(根据INIA-CISA, 2016整理)
3 非洲猪瘟的诊断及疫苗研究
3.1 诊断
3.1.1 病原学检测方法 ASFV结构复杂,在感染细胞内可检测到100多种病毒蛋白,其中具有免疫原性和诊断意义的主要有p72、p54、p30等蛋白。PCR方法因其具有很高的灵敏度和特异性,是国际贸易中OIE指定的ASFV检测方法。PCR技术同时适用于检测不适合进行病毒分离的腐败组织或血液样品。
(1)普通PCR 普通PCR主要为基于相对保守的ASFV p72基因设计引物建立的诊断方法[28-29],可用于ASF的监测和诊断。最近的一份研究报告显示,OIE推荐的PCR方法敏感性和特异性降低,推测可能是由于引物和病毒靶基因的核苷酸不匹配所致[30]。因此,本团队建立了改进的PCR方法,可以检测目前流行的ASFV毒株[28]。
(2)荧光定量PCR(quantitative Real-time PCR,qPCR) qPCR利用特异性寡核苷酸探针的荧光信号检测目标序列的扩增,具有快速、灵敏、交叉污染低、并可对结果定量等优点。2003年,King等建立了针对ASFV p72基因的qPCR,其引物和探针获得OIE认证[31]。2007年,McKllen等建立了分子信号实时PCR,该方法灵敏度较高,可与ASFV症状相似的猪瘟进行鉴别诊断[32]。
(3)多重PCR(multiplex PCR) 随着集约化养猪业的发展,混合感染比较普遍[33]。此外现地存在与ASF临床症状非常相似的疾病,如猪瘟,仅根据临床症状和病理变化,难以鉴别[34]。多重PCR方法可有效鉴别诊断的同时,兼具普通PCR快速、灵敏的特点。Hu等建立的多重PCR检测可以同时检测并鉴别ASFV、猪瘟病毒(classical swine fever virus,CSFV)、高致病性猪繁殖与呼吸综合征病毒(highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV)和伪狂犬病病毒(pseudorabies virus,PRV),并可用于这些疫病的流行病学监测[35]。
(4)等温扩增技术 Invader分析是美国三波技术公司开发的一种等温非“PCR”的DNA和RNA定性和定量检测方法[36]。基于Invader技术设计的ASFV特异性信号探针和Invader寡核苷酸可特异地检测ASFV,并且与CSFV没有交叉反应。James等利用环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术靶向特异性拓扑异构酶II基因检测ASFV,而与CSFV无交叉反应[37]。Gao等建立了检测ASFV的交叉引物扩增(cross-priming amplification,CPA)方法,并与试纸条联用,达到快速诊断ASF的目的[38]。同时该方法不需要昂贵的热循环仪器,在廉价的水浴设备中即可完成,适合现地快速检测。
(5)红细胞吸附试验(hemadsorption test,HAD) HAD试验是利用猪红细胞能够吸附在感染ASFV的猪单核细胞或巨噬细胞表面,形成特征性花环的特性,并且大多数ASFV毒株均可以产生这种吸附现象。由于该方法耗时长、操作繁琐,不能用于非血细胞吸附毒株的诊断,只能作为ELISA、PCR等阳性结果确认的一个参考试验。
(6)荧光抗体试验(the fluorescent antibody test,FAT) FAT通过使用异硫氰酸荧光素结合的特异性抗体检测细胞内抗原。该方法可以用来检测疑似猪组织中的ASFV抗原。FAT可用于检测无HAD现象的ASFV毒株,从而识别非血细胞吸附病毒株。另外,该方法还可根据荧光强弱来估测抗原含量,初步进行病毒定量。BOTIJAL等通过FAT快捷地检测出ASFV,并且该方法具有很高的敏感性,但是荧光素的非特异性反应会造成假阳性结果[39]。尽管FAT是急性ASF的一种高度敏感的检测方法,但是对亚急性和慢性ASF的检测灵敏度较低。
3.1.2 血清学检测方法 用于诊断ASFV感染的主要血清学方法包括ELISA抗体检测、间接免疫荧光抗体试验(indirect fluorescent antibody assay,IFA)等。ELISA抗体检测是国际贸易中OIE指定的ASF诊断方法[4]。基于全病毒抗原或表达抗原(如p72、p54等)的间接ELISA或利用针对某一蛋白(如p72)的单克隆抗体建立的阻断ELISA方法可以检测血清中的ASFV抗体,主要适用于亚急型和慢性ASF的诊断。当ELISA检测结果不确定或制备抗原困难或复杂时,可选用IFA方法。
3.2 疫苗研究进展
3.2.1 灭活疫苗 ASF灭活疫苗免疫猪后可检测到ASFV特异性抗体,但是没有保护作用,未来研发前景不大[40]。
3.2.2 核酸疫苗 细胞免疫和体液免疫应答均在抵抗病毒感染和清除病毒中发挥作用[41-42]。抗体与ASFV诱导的保护性免疫应答相关,其介导的保护性反应可有效延缓疾病的进程。CD8+T细胞反应在ASFV感染的保护性免疫反应中发挥关键的作用。ARGILAGUET等将ASFV血凝素(sHA)、p30和p54胞外域融合真核表达质粒免疫猪后无法抵御ASFV强毒株的攻击。随后,将这3种病毒抗原连接到泛素上,用其免疫可诱导特异性T细胞应答,在不产生抗体的情况下,对致死性ASFV的攻击起到部分保护,确定了T细胞反应在ASFV感染保护中的作用[43]。为进一步研究能够刺激CD8+T细胞反应的潜在免疫保护区,LACASTA等通过表达文库构建了上千个表达质粒(ASFVUblib),并对其进行了免疫攻毒保护试验,其保护率只有60%,但免疫攻毒后存活猪无排毒现象[44],为有效疫苗的研发迈出了重要一步。事实上,ASFV的p30、p54和p72蛋白单独或与其他病毒蛋白混合免疫,均能产生较高水平的抗体,并使血液中病毒含量显著减少,如何更有效地将细胞免疫和体液免疫结合,提高保护率,是ASFV核酸疫苗研发的关键和面临的难题[45]。
3.2.3 亚单位疫苗 ASFV基因组含有多达167个开放阅读框,这种蛋白编码的复杂性使得有效保护性抗原的筛选工作十分困难。因此ASFV亚单位疫苗的研制举步维艰。目前已证实多个病毒蛋白能够诱导中和抗体,其中p54和p30参与病毒的吸附和内化过程。但表达p54和p30的重组杆状病毒不能保护猪免受ASFV强毒株的攻击[46]。此外,同时表达p30、p54、p22和p72的杆状病毒尽管能诱导产生中和抗体,但仍无法保护猪免受ASFV强毒株的攻击[47]。这些数据表明,抗体介导的中和作用在ASFV诱导的保护中并不起关键作用。在另一项研究中,表达CD2v/EP402R蛋白的杆状病毒可以对ASFV同源毒株的攻击提供部分保护[48]。这可能与诱导产生的抗体能够抑制血细胞吸附(HAD)以及暂时抑制病毒的感染有关。
3.2.4 病毒活载体疫苗 针对ASFV的病毒活载体疫苗研究相对较少,目前已经开展的研究主要选用了痘病毒和腺病毒作为载体。LOPERA-MADRID等利用反向疫苗学技术筛选了5种ASFV抗原,在HEK293细胞中表达B646L(p72)、E183L(p54)和O61R(p12),并在经过减毒的牛痘病毒安卡拉(MVA)株病毒载体中表达B646L、EP153R和EP402R(CD2v),将上述蛋白按照不同组合通过初次免疫-加强免疫(prime-boost)策略免疫猪后,可以诱导ASFV特异性抗体和T细胞反应[49]。为了鉴定更多的ASFV免疫原性基因和潜在的保护性抗原,JANCOVICH等分别在质粒载体和重组牛痘病毒中克隆了47个ASFV基因用于免疫,利用DNA初次免疫和重组牛痘病毒加强免疫猪。经Georgia 2007/1株攻毒后,免疫猪的血液和淋巴组织中的ASFV基因组水平明显降低,但猪只出现了与急性ASFV一致的临床和病理变化[45]。LOKHANDWALA等先后将ASFV的保护性抗原重组至人5型腺病毒载体和复制缺陷型腺病毒载体中,通过“鸡尾酒”式混合免疫后能够在猪体内诱导高水平的体液免疫和细胞免疫应答[50-51]。但该研究未涉及动物攻毒保护试验,因此所构建的病毒活载体疫苗的效力还有待验证。
3.2.5 ASFV减毒活疫苗和基因缺失疫苗 ASFV减毒活疫苗可以诱导针对相同基因型ASFV毒株的有效免疫保护,但是对不同基因型ASFV毒株不能提供有效保护[52-53],这可能与病毒特异性T细胞反应有关[54-55]。这也是制约ASFV疫苗研发的一个难题。自然致弱的减毒活疫苗ASFV OURT88/3株和NH/P68株可以保护相同基因型ASFV毒株攻击,但对不同基因型ASFV毒株仅有部分的保护力。同时这些减毒活疫苗免疫后引发病毒血症和肺炎、关节炎等副反应,有一定的安全隐患[52-53]。目前减毒活疫苗的研发主要集中在提高安全性和增强对不同基因型的保护力方面。缺失病毒-细胞互作基因(A224L、A238L和A276R)的重组NH/P68株虽然对相同或者不同基因型(Armenia 2007株)有60%—100%的保护力,然而该疫苗株也产生病毒血症和副作用。在猪肺泡巨噬细胞(PAM)中培养的NH/P68株能对相同或者不同基因型ASFV攻击提供良好的保护,且在免疫后不表现明显的亚临床症状,在不同的细胞中培养的ASFV免疫猪后表现出不同的保护性[56]。通过基因工程手段构建的缺失9GL和MGF360/505的Georgia 2007/1株虽然使病毒的毒力减弱,但是不能对相同基因型的亲本毒株攻击提供有效的保护[57]。目前,通过同源重组构建的Georgia 2007/1株9GL和UK基因缺失减毒活疫苗可以对相同基因型ASFV的攻击提供100%保护力[58]。为研究安全有效的ASF疫苗,各国的科学家们进行了大量的尝试。MONTEADGUDO等发现,删除ASFV BA71株的CD2v(EP402R)基因(BA712RA7)后可以显著降低其毒力,将该基因缺失病毒免疫猪只后可以对BA71的攻击提供100%的保护力,同时也可以抵抗目前在东欧流行的基因II型Georgia 2007/1株的攻击[59]。该研究结果对于研发具有交叉保护力的ASFV减毒活疫苗具有重要借鉴意义。
4 防控措施和建议
ASF疫情在我国高频度、跨区域大范围出现,并 有持续蔓延之势,防控形势异常严峻。非洲猪瘟的传播方式众多,发病猪及感染猪的排泄物、分泌物、猪肉及其制品以及污染的运输车辆、饲料、人员、衣物、鞋子等均为重要的传染源,特别是感染猪的调运会加速疫情的传播。
4.1 进一步加强防控措施
为了更有效地遏制当前ASF疫情的蔓延,建议尽快成立国家ASF应急中心,由中央统一协调和督导兽医防疫、检验检疫、海关、交通、公安等相关部门,联合开展ASF疫情筛查、处置、猪只调运监管、猪肉及相关产品运输检疫等措施;立即启动重大疫情I级应急响应,暂停跨省市猪只调运,严控跨区域猪只流动。同时抓紧研制符合生物安全标准的生猪调运装备,建立可监控、可追溯的生猪调运体系;完善疫情诊断机制,疫情确诊要有两个以上的有资质专业机构相互印证,防止疫情错判或漏诊,冲击养猪业和食品安全、浪费防疫资源乃至引起社会动荡,造成巨大经济和社会损失;加强对基层从业人员的培训,确保防控措施有效落地。
养猪场(户)加强饲养管理,提高生物安全水平,严禁使用泔水喂猪,避免家猪与野猪接触,防止软蜱等吸血昆虫的叮咬。加强疫情监测,一旦发生疫情,立即启动应急预案,严格封锁、扑杀、消毒、移动控制,严防疫情扩散。严禁从有ASF疫情的国家或地区进口猪及其产品,对进口猪及其产品的入境运输工具进行严格监督、检查、登记和消毒,防止运输工具机械传播。对国际航班、火车、船舶的废弃物和泔水等严格进行无害化处理,防止家猪接触感染。
4.2 加快开展科学研究
组织具有高级别生物安全设施的研究机构进行联合攻关,研制更加快速高效的检测和防控技术,加强流行病学调查,追溯疫情来源,对流行毒株进行遗传和分子特征解析和致病性等研究,评估疫病传播特点和传播风险。由于目前尚无有效的ASF疫苗,开发安全有效的疫苗迫在眉睫。
4.3 加强国际合作,吸取他国ASF防控的经验和教训
西班牙、海地等国家应对和根除非洲猪瘟的成功经验值得我国学习和借鉴。以西班牙为例,ASF于1960年传入西班牙。1985年之前,西班牙仅采取扑杀阳性猪群和进行消毒处理等措施控制该病,疫情未能得到有效控制。之后,西班牙颁布了非洲猪瘟根除计划,采取了一系列防控措施,包括建立流动现场兽医团队网络体系;对所有猪场进行血清学监测;提高养猪场的生物安全水平;迅速拔除所有疫点,对受威胁区进行病原学和流行病学调查,及时对生产者进行足额补偿;严格控制猪只移动。通过及时准确的监测和严格有效的封锁和扑杀等措施,在根除计划颁布后10年成功根除了该病[60]。
一些发达国家之所以长期保持ASF无疫状态(或者即便疫情传入也能及时予以根除),总结起来关键在于:具有完善的监测计划和迅捷的预警响应系统;具有完善的疫情控制体系和强有力的防控技术支撑;具有严格的动物流动监管体系和动物产品可追溯体系;具有相对发达的养猪业(多以规模化猪场为主),生物安全措施比较健全[61-62]。
反观俄罗斯,ASF自2007年起流行11年,愈演愈烈,主要原因在:疫病防控体系薄弱,缺乏集中系统的防控计划,导致监测系统不完善,疫情应对滞后和疫病扩散;感染猪及其肉制品的非法贸易、泔水饲喂、发病猪的不当处置等,导致疫情大面积扩散;现代养猪业相对落后,散养户较多,加大防控难度;虽然实行扑杀政策,但经济补偿不到位,造成农场主不配合(隐瞒疫情和处置情况),贻误防控时机[61,63]。
5 结语
ASF是一种急性、出血性、致死性极强的重大疫病,一旦爆发,将重创疫区国家的养猪业和猪肉国际贸易。随着经济全球化发展,国际贸易往来日益频繁,该病呈现全球流行态势,对世界各国的养猪业构成持续的威胁。曾经离我们还很遥远的ASF瘟疫,已成为我国养猪业的重大现实的威胁,在短短二个多月内迅速蔓延至我国10多个省份,持续扩散和流行的风险极高。ASF流行病学复杂,宿主媒介涉及家猪、野猪和软蜱,在三者之间保持着复杂的传播循环。因此,ASF的预防和控制需要更好地了解该病的流行病学,从而实施有针对性的措施。目前尚无针对ASF有效的治疗方法和疫苗,因此迫切需要研究早期快速的ASF检测及防控技术,以及时发现ASFV感染猪并及时扑灭疫情。基于抗原或基因组的ASFV检测技术,可大大节省诊断时间。随着分子技术的发展,可移动式PCR、等温扩增和试纸条等检测技术等可实现快速现地诊断,且具有良好的敏感性,但这些方法还需要临床前评价和临床试验。目前商业化的ELISA试剂盒虽然可以用于检测ASFV抗体或抗原,但其特异性和敏感性还有待提高。
由于ASFV具有庞大的基因组结构和复杂的免疫逃逸机制,使得研制有效的疫苗成为难题。未来需要深入解析病毒毒力相关基因、免疫保护性相关抗原、有效的抗原递送系统以及高效的免疫佐剂。同时,鉴于核酸疫苗、亚单位疫苗、病毒活载体疫苗的效力有限,应着力研制基因缺失疫苗和弱毒疫苗,解决安全性(无残余毒力、不长时间排毒)、稳定性(体内外稳定,不发生返祖突变)、免疫效力(特别是对异型的交叉保护)、鉴别诊断(不影响监测)等难题。
[1] COSTARD S, MUR L, LUBROTH J, SANCHEZ-VIZCAINO J M, PFEIFFER D U. Epidemiology of African swine fever virus., 2013, 173(1): 191-197.
[2] ROWLANDS R J, MICHAUD V, HEATH L, HUTCHINGS G, OURA C, VOSLOO W, DWARKA R, ONASHVILI T, ALBINA E, DIXON L K. African swine fever virus isolate, Georgia, 2007., 2008, 14(12):1870-1874.
[3] GOGIN A, GERASIMOV V, MALOGOLOVKIN A, KOLBASOV D. African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012., 2013, 173:198-203.
[4] OIE. 2018. World Animal Health Information Database (WAHID). http://www.oie.int/wahis_2/public/wahid.php/Diseaseinformation/Immsummary.
[5] SÁNCHEZ-VIZCAÍNO J M, MUR L, BASTOS A D, PENRITH M L. New insights into the role of ticks in African swine fever epidemiology., 2015, 34(2):503-511.
[6] ZHOU X, LI N, LUO Y, LIU Y, MIAO F, CHEN T, ZHANG S, CAO P, LI X, TIAN K, QIU H J, HU R. Emergence of African swine fever in China, 2018., 2018 Aug 13. doi: 10.1111/tbed.12989. [Epub ahead of print]
[7] DIXON L K, CHAPMAN D A, NETHERTON C L, UPTON C. African swine fever virus replication and genomics., 2013, 173:3-14.
[8] ALONSO C, BORCA M, DIXON L, REVILLA Y, RODRIGUEZ F, ESCRIBANO J M, ICTV REPORT CONSORTIUM. ICTV virus taxonomy profile:., 2018, 99:613-614.
[9] GALINDO I, ALONSO C. African swine fever virus: a review., 2017, 9:103.
[10] QUEMBO C J, JORI F, VOSLOO W, HEATH L. Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype., 2018, 65:420-431.
[11] GALINDO I, CUESTA-GEIJO M A, HLAVOVA K, MUÑOZ- MORENO R, BARRADO-GIL L, DOMINGUEZ J, ALONSO C. African swine fever virus infects macrophages, the natural host cells, via clathrin- and cholesterol-dependent endocytosis., 2015, 200: 45-55.
[12] HERNAEZ B, ALONSO C. Dynamin- and clathrin-dependent endocytosis in African swine fever virus entry., 2010, 84(4):2100-2109.
[13] DENYER M S, WILKINSON P J. African swine fever., 1998, 76(2):54-56.
[14] MONTGOMERY R E. On a farm of swine fever occurring in British East Africa (Kenya Colony)., 1921, 34:159-191.
[15] PENRITH M L. History of ‘swine fever’ in Southern Africa., 2013, 84(1):e1.
[16] PENRITH M L, VOSLOO W. Review of African swine fever: transmission, spread and control., 2009, 80(2):58-62.
[17] ANDERSON E C, HUTCHINGS G H, MUKARATI N, WILKINSON P J. African swine fever virus infection of the bushpig () and its significance in the epidemiology of the disease., 1998, 62(1):1-15.
[18] WILKINSON P J. The persistence of African swine fever in Africa and the Mediterranean., 1984, 2(1/4): 71-82.
[19] HEUSCHELE W P, COGGINS L. Isolation of African swine fever virus from a giant forest hog.1965, 13(3):255-256.
[20] ARIAS M, SÁNCHEZ-VIZCAÍNO J M. African swine fever., 2002, 10(7):838-843.
[21] FAREZ S, MORLEY R S. Potential animal health hazards of pork and pork products., 1997, 16(1):65-78.
[22] OWOLODUN O A, BASTOS A D, ANTIABONG J F, OGEDENGBE M E, EKONG P S, YAKUBU B. Molecular characterisation of African swine fever viruses from Nigeria (2003-2006) recovers multiple virus variants and reaffirms CVR epidemiological utility., 2010, 41(3):361-368.
[23] GALLARDO C, MWAENGO D M, MACHARIA J M, ARIAS M, TARACHA E A, SOLER A, OKOTH E, MARTÍN E, KASITI J, BISHOP R P. Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72, and pB602L (CVR) genes., 2009, 38(1):85-95.
[24] BASTOS A D, PENRITH M L, CRUCIÈRE C, EDRICH J L, HUTCHINGS G, ROGER F, COUACY-HYMANN E, R THOMSON G. Genotyping field strains of African swine fever virus by partial p72 gene characterisation., 2003, 148(4):693-706.
[25] BOSHOFF C I, BASTOS A D, GERBER L J, VOSLOO W. Genetic characterisation of African swine fever viruses from outbreaks in southern Africa (1973-1999)., 2007, 121(1/2): 45-55.
[26] Lubisi B A, Bastos A D, Dwarka R M, Vosloo W. Molecular epidemiology of African swine fever in East Africa., 2005, 150(12):2439-2452.
[27] Bastos A D, Penrith M L, Macome F, Pinto F, Thomson G R. Co-circulation of two genetically distinct viruses in an outbreak of African swine fever in Mozambique: no evidence for individual co-infection., 2004, 103(3/4):169-182.
[28] LUO Y, ATIM S A, SHAO L, AYEBAZIBWE C, SUN Y, LIU Y, JI S, MENG X Y, LI S, LI Y, MASEMBE C, STÅHL K, WIDÉN F, LIU L, QIU H J. Development of an updated PCR assay for detection of African swine fever virus., 2017, 162(1):191-199.
[29] OURA C A, EDWARDS L, BATTEN C A. Virological diagnosis of African swine fever-comparative study of available tests., 2013, 173:150-158.
[30] GALLARDO C, NIETO R, SOLER A, PELAYO V, FERNÁNDEZ- PINERO J, MARKOWSKA-DANIEL I, PRIDOTKAS G, NURMOJA I, GRANTA R, SIMÓN A, PÉREZ C, MARTÍN E, FERNÁNDEZ- PACHECO P, ARIAS M. Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in Eastern European Union countries: how to improve surveillance and control programs., 2015, 53: 2555-2565.
[31] KING DP, REID S M, HUTCHINGS G H, GRIERSON S S, WILKINSON P J, DIXON L K, BASTOS A D, DREW T W. Development of a TaqMan PCR assay with internal amplification control for the detection of African swine fever virus., 2003, 107(1):53-61.
[32] MCKILLEN J, HJERTNER B, MILLAR A, MCNEILLY F, BELÁK S, ADAIR B, ALLAN G. Molecular beacon real-time PCR detection of swine viruses., 2007, 140(1/2): 155-165.
[33] LIU S, ZHAO Y, HU Q, LV C, ZHANG C, ZHAO R, HU F, LIN W, CUI S. A multiplex RT-PCR for rapid and simultaneous detection of porcine teschovirus, classical swine fever virus, and porcine reproductive and respiratory syndrome virus in clinical specimens., 2011, 172: 88-92.
[34] GALLARDO C, ADEMUN A R, NIETO R, NANTIMA N, ARIAS M, MARTTN E, PELAYO V, BISHOP R P. Genotyping of African swine fever virus (ASFV) isolates associated with disease outbreaks in Uganda in 2007., 2013, 10: 3488-3497.
[35] HU L, LIN X Y, YANG Z X, YAO X P, LI G L, PENG S Z, WANG Y. A multiplex PCR for simultaneous detection of classical swine fever virus, African swine fever virus, highly pathogenic porcine reproductive and respiratory syndrome virus, porcine reproductive and respiratory syndrome virus and pseudorabies in swines., 2015, 18(4):715-723.
[36] WILKOMSON D A. 'Third wave technologies' invader assays for nucleic acid detection., 1993, 13(22):16.
[37] JAMES H E, EBERT K, MCGONIGLE R, REID S M, BOONHAM N, TOMLINSON J A, HUTCHINGS G H, DENYER M, OURA C A, DUKES J P, KING D P. Detection of African swine fever virus by loop-mediated isothermal amplification., 2010, 164(1-2):68-74.
[38] GAO Y, MENG X Y, ZHANG H, LUO Y, SUN Y, LI Y, ABID M, QIU H J, 2018, Cross-priming amplification combined with immunochromatographic strip for rapid on-site detection of African swine fever virus., 2018, 259: 573-579.
[39] BOTIJA CS. Diagnosis of African swine fever by immunofluorescence., 1970, 72(11):819-839.
[40] BLOME S, GABRIEL C, BEER M. Modern adjuvants do not enhance the efficacy of an inactivated African swine fever virus vaccine preparation., 2014, 32(31):3879-3882.
[41] TAKAMATSU H H, DENYER M S, LACASTA A, STIRLING C M, ARGILAGUET J M, NETHERTON C L, OURA C A, MARTINS C, RODRÍGUEZ F. Cellular immunity in ASFV responses., 2013, 173(1):110-121.
[42] ESCRIBANO J M, GALINDO I, ALONSO C. Antibody-mediated neutralization of African swine fever virus: myths and facts., 2013, 173(1):101-109.
[43] ARGILAGUET J M, PÉREZ-MARTÍN E, NOFRARÍAS M, GALLARDO C, ACCENSI F, LACASTA A, MORA M, BALLESTER M, GALINDO-CARDIEL I, LÓPEZ-SORIA S, ESCRIBANO J M, RECHE P A, RODRÍGUEZ F. DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies., 2012, 7(9):e40942.
[44] LACASTA A, BALLESTER M, MONTEAGUDO P L, RODRÍGUEZ J M, SALAS M L, ACCENSI F, PINA-PEDRERO S, BENSAID A, ARGILAGUET J, LÓPEZ-SORIA S, HUTET E, LE POTIER M F, RODRÍGUEZ F. Expression library immunization can confer protection against lethal challenge with African swine fever virus., 2014, 88(22):13322-13332.
[45] JANCOVICH JK, CHAPMAN D, HANSEN D T, ROBIDA M D, LOSKUTOV A, CRACIUNESCU F, BOROVKOV A, KIBLER K, GOATLEY L, KING K, NETHERTON C L, TAYLOR G, JACOBS B, SYKES K, DIXON L K. Immunization of pigs by DNA prime and recombinant vaccinia virus boost to identify and rank African swine fever virus immunogenic and protective proteins., 2018, 92(8):e02219-17.
[46] GÓMEZ-PUERTAS P, RODRÍGUEZ F, OVIEDO J M, BRUN A, ALONSO C, ESCRIBANO J M. The African swine fever virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response., 1998, 243(2):461-471.
[47] NEILAN J G, ZSAK L, LU Z, BURRAGE T G, KUTISH G F, ROCK D L. Neutralizing antibodies to African swine fever virus proteins p30, p54, and p72 are not sufficient for antibody-mediated protection.. 2004, 319(2):337-342.
[48] BURMAKINA G, MALOGOLOVKIN A, TULMAN E R, ZSAK L, DELHON G, DIEL D G, SHOBOGOROV N M, MORGUNOV Y P, MORGUNOV S Y, KUTISH G F, KOLBASOV D, ROCK D L. African swine fever virus serotype-specific proteins are significant protective antigens for African swine fever., 2016, 97(7):1670-1675.
[49] LOPERA-MADRID J, OSORIO J E, HE Y, XIANG Z, ADAMS L G, LAUGHLIN R C, MWANGI W, SUBRAMANYA S, NEILAN J, BRAKE D, BURRAGE T G, BROWN W C, CLAVIJO A, BOUNPHENG M A. Safety and immunogenicity of mammalian cell derived and Modified Vaccinia Ankara vectored African swine fever subunit antigens in swine., 2017, 185:20-33.
[50] LOKHANDWALA S, WAGHELA S D, BRAY J, MARTIN C L, SANGEWAR N, CHARENDOFF C, SHETTI R, ASHLEY C, CHEN C H, BERGHMAN L R, MWANGI D, DOMINOWSKI P J, FOSS D L, RAI S, VORA S, GABBERT L, BURRAGE T G, BRAKE D, NEILAN J, MWANGI W. Induction of robust immune responses in swine by using a cocktail of Adenovirus-vectored African swine fever virus antigens., 2016, 23(11): 888-900.
[51] LOKHANDWALA S, WAGHELA S D, BRAY J, SANGEWAR N, CHARENDOFF C, MARTIN C L, HASSAN W S, KOYNARSKI T, GABBERT L, BURRAGE T G, BRAKE D, NEILAN J, MWANGI W. Adenovirus-vectored novel African swine fever virus antigens elicit robust immune responses in swine., 2017, 12(5): e0177007.
[52] LEITÃO A, CARTAXEIRO C, COELHO R, CRUZ B, PARKHOUSE R M, PORTUGAL F, VIGÁRIO J D, MARTINS C L. The non-haemadsorbing African swine fever virus isolate ASFV/NH/P68 provides a model for defining the protective anti-virus immune response., 2001, 82(3):513-523.
[53] MULUMBA-MFUMU L K, GOATLEY L C, SAEGERMAN C, TAKAMATSU H H, DIXON L K. Immunization of African indigenous pigs with attenuated genotype I African swine fever virus OURT88/3 induces protection against challenge with virulent strains of genotype I., 2016, 63(5): e323-7.
[54] KING K, CHAPMAN D, ARGILAGUET J M, FISHBOURNE E, HUTET E, CARIOLET R, HUTCHINGS G, OURA C A, NETHERTON C L, MOFFAT K, TAYLOR G, LE POTIER M F, DIXON L K, TAKAMATSU H H. Protection of European domestic pigs from virulent African isolates of African swine fever virus by experimental immunisation., 2011, 29(28):4593-4600.
[55] REVILLA Y, PENA L, VIÑUELA E. Interferon-gamma production by African swine fever virus-specific lymphocytes., 1992, 35(2):225-230.
[56] GALLARDO C, SÁNCHEZ E G, PÉREZ-NÚÑEZ D, NOGAL M, DE LEÓN P, CARRASCOSA Á L, NIETO R, SOLER A, ARIAS M L, REVILLA Y. African swine fever virus (ASFV) protection mediated by NH/P68 and NH/P68 recombinant live-attenuated viruses., 2018, 36(19):2694-2704.
[57] O’DONNELL V, HOLINKA L G, SANFORD B, KRUG P W, CARLSON J, PACHECO J M, REESE B, RISATTI G R, GLADUE D P, BORCA M V. African swine fever virus Georgia isolate harboring deletions of 9GL and MGF360/505 genes is highly attenuated in swine but does not confer protection against parental virus challenge., 2016, 221:8-14.
[58] O'DONNELL V, RISATTI G R, HOLINKA LG, KRUG P W, CARLSON J, VELAZQUEZ-SALINAS L, AZZINARO P A, GLADUE D P, BORCA M V. Simultaneous deletion of the 9GL and UK genes from the African swine fever virus Georgia 2007 isolate offers increased safety and protection against homologous challenge., 2017, 91(1):e01760-16.
[59] MONTEAGUDO P L, LACASTA A, LÓPEZ E, BOSCH L, COLLADO J, PINA-PEDRERO S, CORREA-FIZ F, ACCENSI F, NAVAS M J, VIDAL E, BUSTOS M J, RODRÍGUEZ J M, GALLEI A, NIKOLIN V, SALAS M L, Rodríguez F. BA71ΔCD2: a new recombinant live attenuated African swine fever virus with cross-protective capabilities., 2017, 91(21): e01058-17.
[60] SÁNCHEZ-VIZCAÍNO J M, MUR L, GOMEZ-VILLAMANDOS J C, CARRASCO L. An update on the epidemiology and pathology of African swine fever., 2015, 152(1): 9-21.
[61] SÁNCHEZ-VIZCAÍNO J M, MUR L, MARTÍNEZ-LÓPEZ B. African swine fever (ASF): five years around Europe., 2013, 165(1/2):45-50.
[62] GALLARDO M C, REOYO A T, FERNÁNDEZ-PINERO J, IGLESIAS I, MUÑOZ M J, ARIAS M L. African swine fever: a global view of the current challenge., 2015, 1:21.
[63] SÁNCHEZ-CORDÓN P J, MONTOYA M, REIS A L, DIXON L K. African swine fever: A re-emerging viral disease threatening the global pig industry., 2018, 233:41-48.
African Swine Fever: A Major Threat to the Chinese Swine Industry
LUO YuZi, SUN Yuan, WANG Tao, QIU HuaJi
(Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069)
African swine fever (ASF) is a devastating disease of domestic and wild pigs caused by African swine fever virus (ASFV), and causes significant economic losses to the pig industry in affected countries. Acute disease is characterized by high fever, hemorrhages in the skin and internal organs, and a high mortality rate up to 100%. The continuous spread of the disease through Africa, Europe and Russian Federation keeps the neighboring countries on heightened alert. In August 2018, ASF emerged in China for the first time and subsequently rapidly spread across many regions of China, posing a major threat to the Chinese pig industry. Considering unavailability of ASF vaccines, rapid and early diagnostic assays are urgently needed for on-site field testing. Developing an effective ASF vaccine continues to be challenging due to incomplete understanding of the virus. Recent attempts on attenuated live vaccines and gene-deleted vaccines have been reported with promising efficacy, which have been demonstrated to provide effective homologous protection and partial heterologous protection. This review summarizes the epidemiology, diagnostics, vaccines and control strategies and challenges of ASF.
African swine fever, China; epidemiology, diagnostics, vaccine, control strategy
10.3864/j.issn.0578-1752.2018.21.016
2018-08-28;
2018-09-17
国家重点研发计划项目“烈性外来动物疫病防控技术研发”(2017YFD0502300)
罗玉子,E-mail:luoyuzi@caas.cn。通信作者仇华吉,Tel:0451-51051708;E-mail:qiuhuaji@caas.cn
(责任编辑 林鉴非)

