日本血吸虫成虫抗原通过ROS诱导人LX-2肝星状细胞NLRP3炎症小体活化和胶原表达*
朱燕楠 缪婷婷 王 伟 陆忠奎 刘劲峰 王 勇
(南京医科大学基础医学院病原生物学系,江苏省现代病原生物学重点实验室,江苏南京 211100)
我国是日本血吸虫的主要流行区,到2016年底,全国仍有54 454例血吸虫病患者 (张利娟等, 2017)。终宿主感染日本血吸虫后,尾蚴会穿透皮肤,通过循环系统迁移至门静脉系统,在此发育成熟并产卵 (Ressurreicaoetal., 2016)。沉积在肝脏的虫卵分泌的抗原可以诱导肝脏虫卵肉芽肿的形成和局部炎症损伤,最终诱发肝纤维化 (Fernandez-Delgadoetal., 2017; Yamabeetal., 2017)。对血吸虫病患者或小鼠进行有效杀虫后,不能完全阻止卵肉芽肿炎症和肝纤维化的发展,这可能是由于慢性炎症过程仍旧持续 (Ciolietal., 2003; Southgateetal., 2005; Gryseelsetal., 2006)。然而,在血吸虫感染期间,肝脏中介导这种持续炎症的机制一直没有得到很好的解释。
2002年Martinon等人首次提出了炎症小体的概念 (Martinonetal., 2002)。炎症小体是由多种蛋白组成的复合体,现已鉴定了许多炎症小体,包括NLRP1、NLRP2、NLRP3以及HIN200家族蛋白(如AIM2)等 (Ozakietal., 2015)。炎性小体可以介导机体对各种组织的炎症反应,是细胞内炎症机制的开关 (Lamkanfietal., 2014)。NLRP3炎症小体是被最广泛研究的炎症小体,在肝脏炎症和纤维化致病中发挥着重要的作用 (Schroderetal., 2010)。最近的研究表明,血吸虫感染小鼠肝星状细胞(hepetic stellate cells, HSCs)中存在NLRP3炎症小体激活,这可能作为早期机制来启动炎症反应,从而诱发肝纤维化 (Mengetal., 2016)。然而本实验室之前的研究发现,血吸虫感染早期(虫卵未产生之前)HSCs已经活化并表达大部分趋化因子,同时肝组织中炎性细胞已经开始浸润 (Liangetal., 2012)。血吸虫感染早期形成的肝脏炎性微环境对虫卵肉芽肿的形成以及纤维化相关细胞的活化和基因表达有着重要的作用 (Amirietal., 1992; Leptaketal., 1997; Liangetal., 2011)。但是,对于虫卵产生之前,肝脏炎症产生和持续的机制仍知之甚少。虫卵产生之前,血吸虫成虫抗原SWA被认为是对宿主肝脏产生免疫影响的主要抗原。因此,深入研究SWA对HSCs的活化作用以及可能机制,对全面认识血吸虫病致病机制有重要意义。
本实验旨在确定SWA体外刺激是否可以激活人肝星状细胞系LX-2中NLRP3炎症小体活化和胶原表达,在此基础上探讨了ROS在其中的作用。本研究有助于我们了解血吸虫感染早期肝脏内炎症形成的机制,更全面认识血吸虫感染过程中NLRP3炎症小体对HSCs活化及炎症微环境形成中的作用,为进一步阐明血吸虫病的致病机制提供新的实验依据。
1 材料与方法
1.1 细胞系
人肝星状细胞系LX-2从中南大学湘雅医学院获得。
1.2 主要试剂
DMEM培养液、胎牛血清(FCS)、青霉素/链霉素和胰酶均购自美国Gibco公司,Trizol购自美国Invitrogen公司,PrimeScriptTMRT Master Mix购自日本TaKaRa公司,RealUniversal彩色荧光定量预混试剂购自天根生化科技公司,引物均由Invitrogen(上海)贸易有限公司合成,BCA Protein assay Regent Kit购自美国Thermo公司,Caspase-1抗体和H2DCF-DA荧光探针均购自美国sigma公司,PMSF、ECL化学发光试剂盒、CCK-8细胞活力检测试剂盒和LDH检测试剂盒均购自中国碧云天公司,Human IL-1β ELISA检测试剂盒购自中国达科为公司,NLRP3抗体、β-actine抗体和HRP-兔抗鼠二抗均购自美国CST公司,α-SMA抗体和ColⅠ抗体购自美国abcam公司
1.3 主要仪器
Nano Drop超微量样本分光光度计产自美国Thermo Scientific公司,Roche Real Time PCR仪产自美国Roche公司,FACS Carlibur流式细胞仪产自美国BD Bioscience公司,全自动酶标仪产自美国BioTec公司。
1.4 血吸虫成虫抗原制备
取适量冻干日本血吸虫虫体置研钵内碾磨成粉(冰上操作),加适量PBS,转移至1.5 mL EP管中,-20℃冰箱过夜,常温下融化后,使用100 W超声粉碎共6次每次10 s,之后将其放入-80℃冰箱冻存过夜,反复冻融3次,置室温充分融化后,混匀,4℃、10 000 g离心25 min;取上清即为SWA,无菌过滤至无菌1.5 mL EP管中;取5 μL,按照BCA试剂盒说明书检测蛋白浓度,其余的分装,-80℃冻存。
1.5 细胞培养
将LX-2细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM完全培养基,在37℃、5% CO2的细胞培养箱中培养,细胞生长至培养皿的 70%~80% 左右,胰酶消化,以1∶3传代。取对数生长期细胞进行铺板,用于相关实验。
1.6 抗原刺激
细胞计数后用DMEM完全培养基将细胞调节至5×105/mL,用相应的SWA刺激培养相应的时间,以未经抗原刺激的PBS作为对照组。每组细胞至少重复4孔,收集上清和细胞后进行后续检测。
1.7 RNA抽提和实时荧光定量PCR检测
细胞进行相应刺激,24 h后,按照TRIZOL说明书所给的方法提取LX-2细胞中的总RNA,使用Nano Drop超微量样本分光光度计测量RNA的含量和纯度(A260/280吸光值在1.8~2.0之间)。之后按照PrimeScriptTMRT Master Mix说明书将总RNA反转录成cDNA。根据美国生物信息中心(NCBI)人类mRNA序列用Primer 5.0设计引物,引物序列见表1,由Invitrogen(上海)贸易有限公司合成。应用SYBR Green法进行荧光定量PCR,以GAPDH作为内参,反应体系为:(GAPDH、NLRP3、Caspase-1、α-SMA和ColⅠ)上、下游引物浓度0.3 μmmoL、模板约为500 ng、SYBR Green Mix 10 μL、DEPC水加至20 μL;参数设定为:95℃ 15 min;95℃ 10 s,60℃ 30 s,45个循环。扩增阶段进行荧光信号收集,并在扩增完毕后进行溶解曲线的测定,采用2-ΔΔCt法计算差异倍数。
1.8 Western blot测定
对细胞进行相应刺激,48 h后,弃去培养基,加入预冷的PBS漂洗2次,弃去上清,每孔加入100~120 μL RIPA裂解液(之前已经按照相应比例加入蛋白酶抑制剂、磷酸酶抑制剂和PMSF),冰上裂解30 min,4℃、12 000 r/min离心15 min,将上清(即为细胞总蛋白)转移至预冷的离心管中,使用BCA法检测蛋白浓度。加入loading buffer,煮沸5 min变性,SDS-PAGE凝胶电泳,每孔加40 μg蛋白样品,转至PVDF膜,转膜后将PVDF膜放入封闭液中,脱色摇床上摇动封闭2 h,加入一抗(NLRP3,1∶1 000;Caspase-1,1∶1 000;α-SMA,0.5 μg/mL;ColⅠ,1∶2 000;β-actine,1∶1 000),4℃摇床上孵育过夜,TBST洗涤3次,每次7 min,加入HRP标记的相应二抗,摇床上室温孵育2 h,TBST洗涤3次,每次7 min。
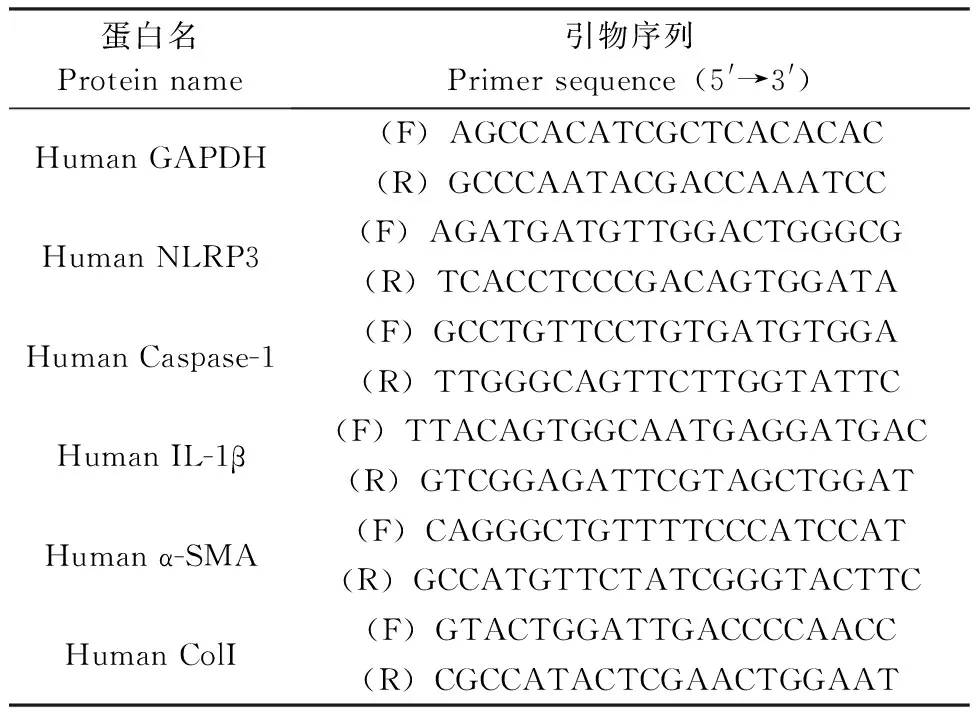
表1 实时定量PCR特异性引物序列Tab.1 Sequences of gene-specific primers for real time PCR assays
1.9 ELISA检测细胞IL-1β分泌
按1.6方法对细胞进行刺激,72 h后,取上清液,按照Human IL-1β ELISA检测试剂盒说明书进行检测,基本步骤为:试剂盒室温平衡20 min,将标准品倍比稀释为:0、15.5、31、62.5、125 pg/mL。按照实验要求,加入标准品和样品,加检测抗体,震荡混匀,盖上封板膜,37℃温育90 min。洗板5次,加HRP-链霉亲和素。盖上封板膜,37℃温育30 min,洗板5次。 加入TMB,37℃避光温育约20 min进行显色,终止液终止反应。在酶标仪上,读取检测波长450 nm和校正波长610~630 nm处读取各孔吸光度值并绘标准曲线,计算各孔细胞因子浓度。
1.10 CCK-8法检测细胞活性
收集细胞,用DPBS洗一遍,计数后完全DMEM培养液将细胞浓度调节至5×105/mL,以每孔100 μL的体积加至96孔板中。设置5组:PBS组、SWA (25、50、100 μg/mL)组,空白对照组。每组设置4个复孔。37℃,5% CO2,细胞恒温培养箱中培养24 h,于检测前4 h,每孔加入10 μL CCK-8溶液。继续孵育0.5~4 h,在0.5、1、2和4 h后分别用酶标仪检测在450 nm和大于600 nm的波长的吸光度。按细胞活率=(检测孔-空白孔)/(对照孔-空白孔)计算细胞活率。
1.11 检测细胞LDH实验
将各培养孔分成如下几组:无细胞的培养液孔 (背景空白对照孔),未经药物处理的对照细胞孔 (样品对照孔),未经药物处理的用于后续裂解的细胞孔 (样品最大酶活性对照孔),以及SWA (25、50、00 μg/mL)组。每组设置5个复孔。细胞贴壁后用DPBS洗涤一次,使用含1%血清的低血清培养液,37℃、5% CO2,细胞恒温培养箱中培养24 h,按照细胞LDH检测试剂盒说明书进行检测。细胞LDH释放(%)=(处理样本吸光度-样本对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100。
1.12 NAC抑制细胞内氧化应激实验
取对数生长期的LX-2细胞,分为对照组、NAC (N-乙酰半胱氨酸,N-acetylcysteine)组、SWA组、SWA+NAC组。NAC组和SWA+NAC组在刺激前30 min,每孔加入10 μmol/L NAC。每组4个复孔,之后加入相应刺激,放入37℃,5% CO2,细胞恒温培养箱中培养相应时间。提取细胞RNA、蛋白和上清进行相关检测。
1.13 细胞内活性氧检测实验
细胞按照合适的密度接种至培养板中,细胞完全贴壁后,DMEM培养基饥饿培养12 h。细胞分为2组:对照组和SWA组。继续正常培养24 h。去上清,用PBS漂洗2遍,加入含有10 μmol/L H2DCF-DA荧光探针的无血清DMEM培养液1 mL,37℃避光孵育20 min。PBS漂洗1次,胰酶消化细胞离心,使用PBS洗涤2次,加入1 mL PBS重悬细胞,吹打均匀,转移至流式管中。30 min内上流式检测,以激发波长488 nm,发射波长535 nm检测细胞内ROS水平。
1.14 统计学分析
2 结果
2.1 SWA刺激LX-2细胞后NLRP3、IL-1β、Caspase-1、α-SMA和ColⅠ mRNA的表达变化
如图1所示,采用25、50、100 μg/mL等不同浓度SWA刺激LX-2细胞24 h后,荧光定量PCR分析显示,当SWA浓度为100 μg/mL时,NLRP3炎症小体及其下游的Caspase-1和IL-1β的mRNA表达水平与对照组相比显著升高(P<0.05),同时发现LX-2细胞活化标志α-SMA和纤维化相关的ColⅠ基因的表达也显著升高(P<0.05)。
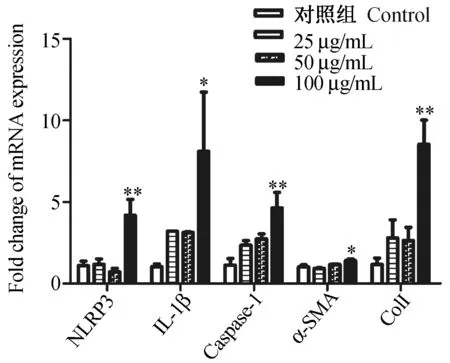
图1 SWA刺激LX-2细胞对NLRP3、IL-1β、Caspase-1、α-SMA和ColⅠ的mRNA的影响Fig.1 Effects of SWA stimulation on mRNA expression of NLRP3, Caspase-1, α-SMA and ColⅠ in LX-2 cells与对照组相比,*P<0.05;**P<0.01。 n=4。Compared with untreated control group, *P<0.05; **P<0.01. n=4.
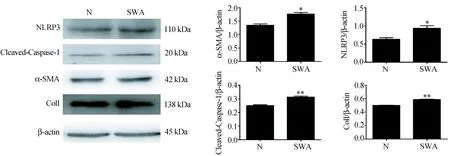
图2 SWA对LX-2细胞NLRP3、Cleaved-Caspase-1、α-SMA和ColⅠ蛋白表达的影响Fig.2 Effects of SWA stimulation on protein expression of NLRP3, Cleaved-Caspase-1, α-SMA and ColⅠ in LX-2 cells与对照组相比,*P<0.05;**P<0.01。Compared with untreated control group, *P<0.05; **P<0.01.
蛋白表达水平上,100 μg/mL浓度的SWA刺激均可以显著增加细胞NLRP3、Cleaved-Caspase-1、α-SMA和ColⅠ蛋白的表达,与对照组相比差异有统计学意义(P<0.05)(图2)。
采用ELISA法检测100 μg/mL浓度的SWA刺激后细胞培养上清中IL-1β的水平,结果显示LX-2细胞IL-1β的分泌明显增加,与对照组相比差异有统计学意义(P<0.05)。结果见图3。以上结果表明,SWA可以刺激LX-2细胞内NLRP3炎症小体活化,并诱导胶原生产。
2.2 SWA诱导LX-2细胞发生细胞焦亡
采用CCK-8检测SWA对LX-2细胞活力的影响,结果显示,随着SWA浓度的增加,LX-2细胞的活力逐渐下降(图4-A)。LDH检测结果显示,LX-2细胞LDH的释放随着SWA浓度的增加而增多(图4-B)。我们进一步检测了引起细胞焦亡的关键分子活化Caspase-1酶(Cleaved- Caspase-1)的表达,结果显示,当SWA浓度为100 μg/mL时,活化Caspase-1表达显著上升(P<0.05)(图4-C)。以上结果表明,SWA可以诱发LX-2细胞焦亡。
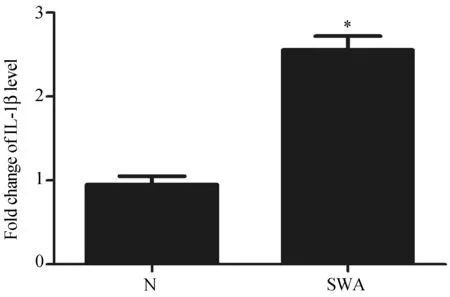
图3 SWA刺激对LX-2细胞IL-1β分泌的影响Fig.3 Effects of SWA stimulation on IL-1β production in LX-2 cells与对照组相比,*P<0.05。n=4。Compared with control group, *P<0.05. n=4.

图5 SWA刺激对LX-2细胞ROS释放的影响Fig.5 The expression of ROS in LX-2 cells infected with SWA与对照组相比,***P<0.001。n=4。Compared with control group, ***P<0.001. n=4.
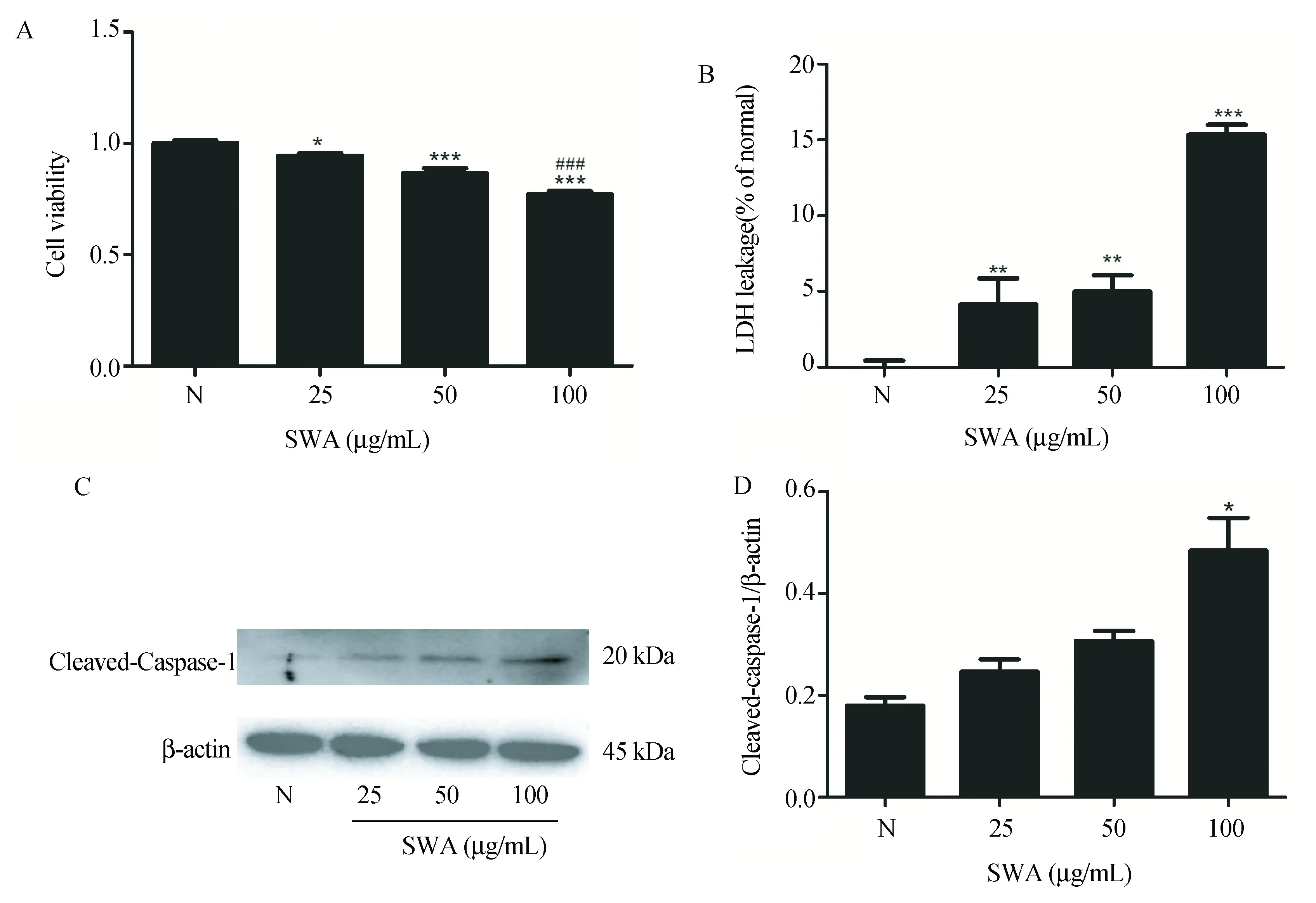
图4 SWA诱导LX-2细胞焦亡Fig.4 SWA promotes pyroptosis in LX-2 cellsA. CCK-8法检测SWA对LX-2细胞活力的影响;B. LDH法检测SWA对LX-2细胞毒性的影响;C. SWA对LX-2细胞Cleaved-Caspase-1蛋白表达的影响。与对照组相比,*P<0.05;**P<0.01;***P<0.001;与50 μg/mL SWA组相比,###P<0.001。n=4。A. Effects of SWA on cell viability in LX-2 cells by CCK-8 assay; B. Effects of SWA on Cytotoxicity in LX-2 cells by LDH assay; C. The protein levels of Cleaved-Caspase-1 in LX-2 cells infected with SWA. Compared with untreated control group, *P<0.05; **P<0.01; ***P<0.001; Compared with 50 μg/mL SWA group, ###P<0.001. n=4.
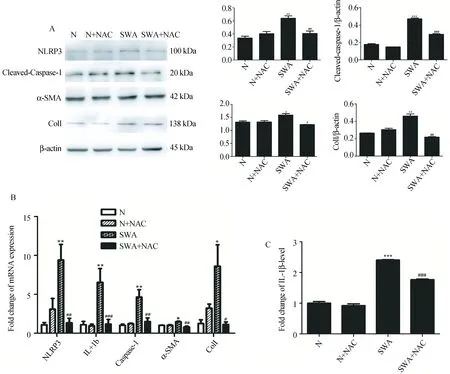
图6 NAC 抑制SWA诱导的LX-2细胞内NLRP3、IL-1β、Caspase-1、α-SMA、ColⅠ 的表达Fig.6 NAC inhibits SWA-induced the expression of NLRP3, IL-1β, Caspase-1, α-SMA and ColⅠ in LX-2 cellsA. NAC抑制ROS后SWA诱导LX-2细胞内NLRP3、IL-1β、Caspase-1、α-SMA、ColⅠ mRNA的表达; B. NAC抑制ROS后SWA诱导LX-2细胞内NLRP3、Caspase-1、α-SMA、ColⅠ蛋白的表达; C. NAC抑制ROS后SWA诱导LX-2细胞IL-1β的分泌. 与对照组相比,*P<0.05;**P<0.01;SWA组与SWA+NAC组,#P<0.05; ##P<0.01;###P<0.001。n=4。A: Effect of NAC on the mRNA expression of NLRP3, IL-1β, Caspase-1, α-SMA and ColⅠ in LX-2 cells induced by SWA; B: Effect of NAC on the protein expression of NLRP3, Cleaved-Caspase-1, α-SMA and ColⅠ in LX-2 cells induced by SWA; C. Effect of NAC on IL-1β production in LX-2 cells in LX-2 Cells induced by SWA. Compared with control group, *P<0.05; **P<0.01; ***P<0.001. SWA group vs SWA+NAC group, #P<0.05; ##P<0.01; ###P<0.001. n=4.
2.3 SWA诱导LX-2细胞ROS反应并介导NLRP3炎症小体活化和纤维化基因表达
细胞内ROS水平检测结果显示,SWA刺激可以显著上调LX-2细胞中ROS的水平,与对照组相比差异有统计学意义(P<0.05)。见图5。为进一步证明ROS反应对炎症小体活化的影响,采用ROS清除剂N-乙酰半胱氨酸(NAC)抑制LX-2细胞内氧化应激反应,观察到NAC可以降低细胞内NLRP3、IL-1β、Caspase-1、α-SMA和ColⅠ的mRNA和蛋白表达(P<0.05)(图6-A、6-B),同时可抑制LX-2细胞IL-1β的表达(P<0.05)(图6-C)。以上结果均说明,抑制ROS可以抑制LX-2细胞内NLRP3炎症小体活化和胶原表达,提示我们SWA可能是通过ROS诱发NLRP3炎症小体的形成,增加炎性细胞因子的释放导致肝脏局部炎症微环境的形成,最终引起肝脏纤维化。
3 讨论
NLRP3炎症小体是一种多蛋白复合物,炎症小体及其下游效应因子在肝脏炎症和肝纤维化发展中发挥着中心作用,靶向阻断该复合物可能是阻止或逆转纤维化发展的可行性策略 (Wreeetal., 2014;Mridhaetal., 2017)。现已知在日本血吸虫感染小鼠中HSCs中存在NLRP3炎症小体的活化,并且肝脏炎症与肝纤维化密切相关 (Mengetal., 2016; 温镇成等, 2017)。但这些研究均基于血吸虫虫卵沉积后的阶段进行的研究。事实上,在血吸虫成虫成熟至产卵前,肝脏炎性因子TNF-α的表达水平就已经显著上升,并已启动形成肉芽肿的炎症反应 (Amirietal., 1992; Leptaketal., 1997; Liangetal., 2012)。我们的前期研究也发现,血吸虫感染3周小鼠的肝脏中,虽然虫卵肉芽肿还未形成,却已经可以观察到炎性细胞浸润;同时发现HSCs已经开始活化,即α-SMA、胶原的基因表达水平开始上升(数据暂未发表)。而此时,虫源性的刺激因素主要是SWA。目前,对于SWA对HSCs中NLRP3炎症小体的活化和纤维化的影响还尚未有相关报道。本实验我们使用不同浓度SWA体外刺激LX-2细胞,发现NLRP3炎症小体表达上升,其下游活化的Caspase-1表达和IL-1β的分泌也升高。结果表明,LX-2细胞中NLRP3炎症小体可以被SWA活化,同时发现SWA可以诱导LX-2细胞活化(α-SMA的基因和蛋白水平上升)和胶原沉积(ColⅠ的基因和蛋白水平上升)。结果提示,在血吸虫感染致肝脏疾病中,血吸虫成虫抗原SWA也可能是HSCs中NLRP3炎症小体活化和胶原沉积的重要虫源性因素。
炎症小体形成所触发的炎症相关的细胞死亡过程被称为细胞焦亡 (Zhongetal., 2013;Jorgensenetal., 2015)。这个过程涉及Caspase-1的活化,IL-1β等细胞因子的形成,继而募集、激活其他免疫细胞,诱导趋化因子、炎症因子和粘附分子等的合成,最终形成“级联效应”,放大炎症反应,最终导致剧烈的炎症反应 (Coccoetal., 2014)。我们的实验观察到SWA可以降低LX-2细胞的活力,增加细胞LDH的释放和活化的Caspase-1的表达,并呈现一定的浓度依赖效应。初步表明,SWA可以诱发肝星状细胞的细胞焦亡。提示我们SWA对血吸虫感染过程中局部炎症微环境的形成有着重要的作用。
对于NLRP3炎症小体的激活机制目前主要有3种模型:溶酶体活性;离子通量,尤其是钾离子流出和活性氧(ROS)。ROS是NLRP3炎性体激活中常见的上游刺激信号 (Amer, 2011; Latz, 2010)。已有报道发现使用ROS抑制剂阻断,可以减少NLRP3炎症小体的活化和纤维化(Leptaketal., 1997; Wuetal., 2018)。我们的实验发现,SWA可以引起LX-2细胞中ROS的生成。为了进一步说明ROS参与了SWA诱导的LX-2细胞NLRP3炎症小体活化的过程,我们使用了NAC抑制了细胞ROS的产生,发现SWA诱导的LX-2细胞内NLRP3炎症小体的形成、Caspase-1的活化和IL-1β的分泌被显著抑制,同时α-SMA和ColⅠ表达也显著下调。这提示我们,LX-2细胞内ROS的产生可能是SWA诱导NLRP3炎症小体活化和纤维化的关键因素。
综上所述,本研究表明,SWA可以激活LX-2细胞内NLRP3炎症小体的活化,并诱导炎症因子和纤维化相关基因的表达。并且,SWA刺激可以诱导细胞内ROS反应,介导NLRP3炎症小体激活。提示我们,SWA诱导的LX-2细胞内NLRP3炎症小体的激活可能是血吸虫感染早期局部炎症和纤维化形成的关键机制之一。

