以乙脑减毒活疫苗SA14-14-2为骨架的重组嵌合登革4病毒的构建与鉴定*
解东洋 祝 琴 刘忠钰 赵 慧 邓永强叶 青 李晓峰 秦成峰1,**
(1. 安徽医科大学,安徽合肥 230032; 2. 军事科学院军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071; 3. 广州医科大学附属广州市第八人民医院,广东广州 510182)
登革病毒(dengue virus, DENV)属于黄病毒科黄病毒属,是一种单股正链的RNA病毒。自然界中的登革病毒包括4个血清型(DENV1,DENV2,DENV3,DENV4),均可引起温和的登革热(dengue fever, DF)以及严重的登革出血热(dengue hemorrhagic fever, DHF)和登革休克综合征(dengue shock syndrome, DSS)(Screatonetal.,2015;Guzmanetal.,2016)。目前登革病毒感染所致疾病是世界上分布最广、发病人数最多、危害最为严重的蚊媒病毒病,广泛流行于全球100多个国家,全球每年因登革病毒感染死亡的人数约为2.5万(Bhattetal.,2013)。在我国,登革1~4型病毒均有流行,流行区主要分布于广东、广西、云南、福建等南方省区。近年来,伴随着全球气候变暖等原因的发生,流行地区不断扩大,浙江、山东等地不断暴发输入病例导致的登革热本土流行(Lietal.,2018)。
登革疫苗的研发历来受到重视,并取得重要进展。近些年,以黄病毒减毒疫苗株的基因组为骨架构建嵌合病毒已成为研究登革病毒疫苗的一个新思路(Monathetal.,2015;Barrettetal.,2017)。其中赛诺菲巴斯德研发的以黄热疫苗株17D为骨架的嵌合登革四价疫苗已经获批上市(Heneinetal.,2017)。以登革病毒减毒株DENV4Δ30为骨架的嵌合疫苗株已经进入临床Ⅲ期研究,显示出巨大的发展前景(Pierceetal.,2017)。我国自主研制的乙脑减毒活疫苗 SA14-14-2 于1989年在中国被批准上市,已经有超过3亿儿童接种疫苗,该疫苗株具有良好的减毒特性和安全性,单次免疫能有效诱导产生保护性的中和抗体,而且免疫力持久(Wangetal.,2014;Wijesingheetal.,2014)。我们以该疫苗株为骨架,先后构建了登革2型病毒、寨卡病毒、西尼罗病毒等重组嵌合疫苗株,并完成了相应临床前研究(Lietal.,2013;Lietal.,2013;Wangetal.,2016; Wangetal.,2016;Lietal.,2018)。本研究中,我们以乙脑减毒活疫苗株SA14-14-2基因组为骨架,成功构建了嵌合登革4型疫苗侯选株(ChinDENV4),并对其生物学性质进行了评价,为新型登革病毒疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1主要细胞、病毒和载体:大肠杆菌 MC1061 感受态细胞、金黄地鼠肾细胞BHK-21、蚊C6/36细胞系由军事科学院军事医学研究院微生物流行病研究所病毒学研究室细胞库保存。DENV4-GZ30病毒株(GenBank号:JQ822247)由本室分离自中国广州并保存。乙脑病毒全长感染性克隆质粒pAJE70由本室构建保存(Yeetal.,2012),乙脑减毒活疫苗株 SA14-14-2 由成都生物制品研究所提供。
1.1.2主要试剂:Pure LinkTMRNA Mini Kit、Lipofectamine 3000购自Invitrogen公司,One Step Primescript RT-PCR kit、M-MLV reverse transcription polymerase、XhoⅠ、KasⅠ、BspEⅠ、SacⅡ、NruⅠ购自Takara公司,Wizard Plus SV Minipreps DNA Purification System、T4 DNA Ligase购自Promega公司,Alexa Fluor 488 标记山羊抗小鼠IgG购自北京中杉金桥公司。
1.2 引物
利用Primer 6.0软件,根据GenBank中DENV4-GZ30病毒株序列及日本脑炎病毒ORF设计引物,并在其两端引入酶切位点KasⅠ和BspEⅠ(引物序列斜体碱基为酶切位点), PCR引物见下表1。
1.3 嵌合病毒全长感染性克隆质粒的构建
构建嵌合病毒(ChinDENV4)时,去除了DENV4 prM/E基因序列中存在的酶切位点BspEⅠ,并在目标基因两端引入酶切位点KasⅠ、BspEⅠ,使得目的片段和骨架能被双酶切。将DENV4-GZ30病毒株RNA反转录成cDNA作为模板,以相应引物扩增片段D4-AE和D4-BF;以pAJE70作为模板,扩增片段D4-CD。利用融合PCR的方法将扩增所得3个片段融合成片段D4-AD。使用KasⅠ和BspEⅠ分别对pAJE70和D4-AD进行双酶切,对回收双酶切后所得目的片段用T4连接酶4℃过夜连接。将连接产物转化入大肠杆菌MC1061感受态细胞中,然后挑选菌落鉴定。最后,使用酶SacⅡ和NruⅠ对嵌合克隆质粒进行酶切鉴定。
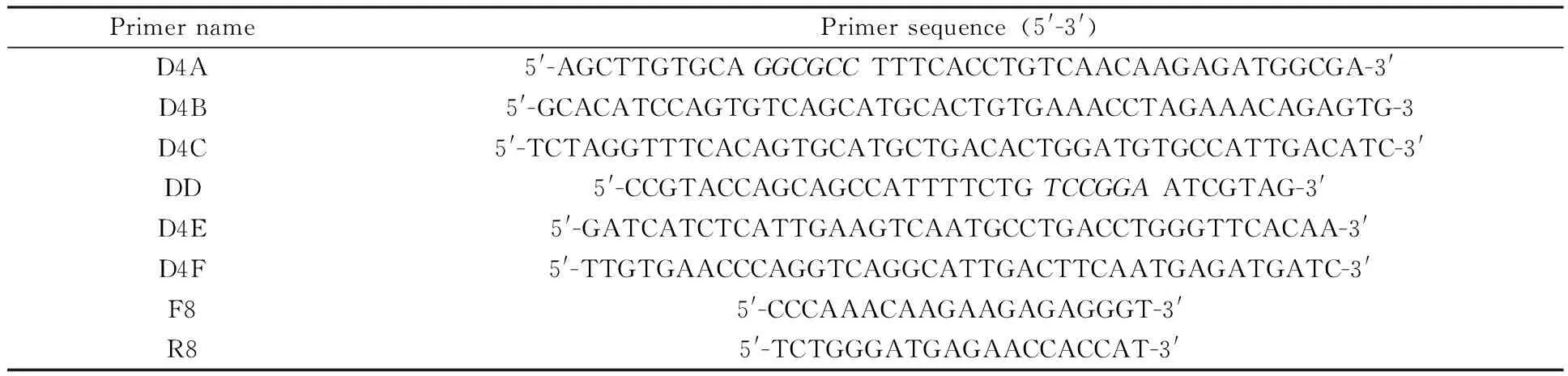
表1 实验所用引物
Restriction enzyme sites incorporated into primers are marked in italic.
1.4 体外转录与转染实验
克隆质粒pChinDENV4经线性化并纯化后,使用Sp6体外转录试剂盒,对其进行体外转录。将所得转录产物RNA使用脂质体转染法转入6孔板培养至长满 70%~80% 的BHK-21细胞内,置于37℃ CO2恒温孵箱中培养,每日观察细胞状态,查看细胞是否产生病变。
1.5 蚀斑形成实验
用细胞维持液将病毒液10倍倍比稀释;在单层致密的12孔细胞培养板中,加入500 μL不同稀释度的病毒悬液,37℃ 5% CO2孵箱内孵育1 h;弃去病毒液,每孔加入1 mL的含1%低熔点琼脂糖的DMEM培养基,37℃继续培养,每天按时观察;当细胞出现明显的病变现象时,取出细胞培养板,每孔加入1 mL的4%甲醛固定液,室温固定1 h,弃去固定液和琼盖,清水冲洗残余液;每孔加入1.5%结晶紫溶液500 μL,室温染色10 min,弃去结晶紫染液并用大量清水冲洗,待晾干计数出斑数并拍照。
1.6 间接免疫荧光实验
将细胞传至铺有玻璃片的24孔板中,在37℃ 5% CO2恒温孵箱中培养24 h至细胞长满70%左右;按照MOI=0.01稀释病毒并将病毒液接种于细胞中,37℃孵育1 h后,吸出原病毒液,换成病毒维持液,继续在孵箱中培养至72 h;取出玻璃片,放入丙酮玻璃盒内-20℃固定30 min,取出晾干后置于-20℃保存备用。按1∶500 稀释实验所用一抗(MAb 2B8和JN1),每孔200 μL加在玻璃片上,37℃孵育1 h,取出后清洗3次;使按1∶300稀释Alexa Flour 488标记羊抗鼠IgG二抗,每孔200 μL加在玻璃片上,37℃孵育1 h,取出后清洗3次;加入DAPI核染液,每孔加200 μL,室温孵育5 min;使用荧光显微镜进行拍摄,观察实验荧光结果。
1.7 生长曲线测定实验
传细胞至24孔板中,每孔加入500 μL细胞悬液;将细胞培养板置于37℃5% CO2恒温孵箱中至细胞长满80%左右;按照MOI=0.1用病毒维持液稀释病毒;每孔加入200 μL病毒稀释液,在恒温培养箱孵育1 h;弃去病毒液,加入病毒维持液继续培养,不同时间点取细胞上清液,用蚀斑法测定病毒滴度,绘制病毒生长曲线。
1.8 乳鼠神经毒力实验
将ChinDENV4病毒株和DENV4-GZ30病毒株,分别稀释至浓度为100、1000、10000和100000 PFU/mL,每组注射至一窝1日龄BALB/c乳鼠(10~11只),每只乳鼠注射20 μL,每天定时观察乳鼠死亡情况,并绘制颅内接种小鼠的生存曲线图。
2 结果
2.1 嵌合病毒基因组全长cDNA感染性克隆的构建
按照构建策略(图1),首先通过融合PCR方法获得了目的片段D4-AD;进一步对目的片段D4-AD和SA14-14-2感染性克隆质粒(pAJE70)进行双酶切,并对纯化后的酶切产物用T4连接酶连接,最终获得了携带有DENV4-prM/E的重组质粒pChinDENV4。
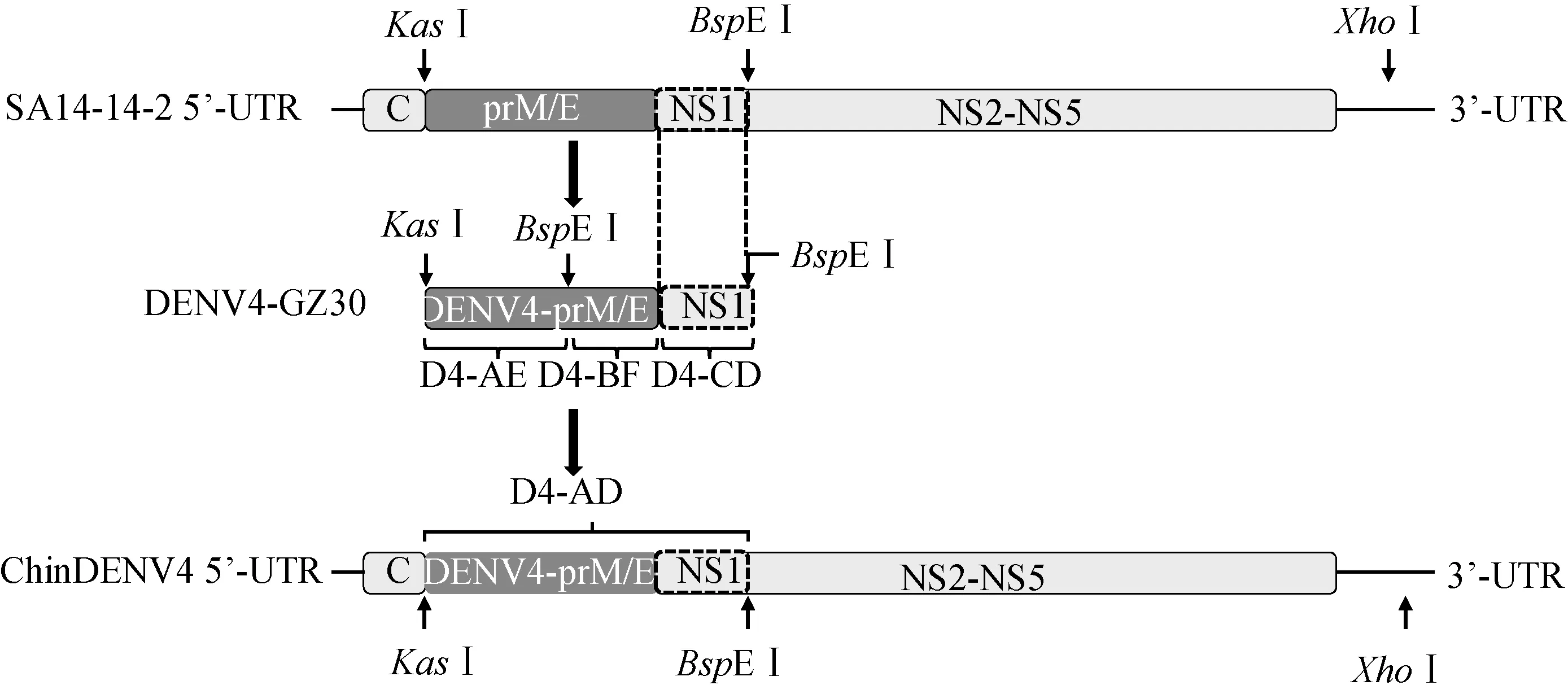
图1 嵌合病毒(ChinDENV4)的构建策略图Fig.1 Schematic diagram of ChinDENV4
使用SacⅡ和NruⅠ对pChinDENV4酶切,SacⅡ酶切后片段大小为10 927和2 624 bp,NruⅠ酶切后片段大小为7 385和6 166 bp。凝胶电泳鉴定显示(图2),酶切后片段大小正确,表明成功构建了重组质粒pChinDENV4。
2.2 嵌合病毒的拯救与鉴定
为拯救获得嵌合病毒,把pChinDENV4的体外转录产物、SA14-14-2病毒株核酸、DENV4-GZ30病毒株核酸分别转染至BHK-21细胞,孵育72 h后,与对照组细胞状态进行比较。可见转染组均出现细胞聚集、圆缩、成团出现空泡样变化并发生脱落,致使细胞出现典型病变现象(图3-A)。提取被嵌合病毒感染的细胞培养上清液总RNA,以F8和R8作为上下游引物,通过 RT-PCR方法扩增出病毒基因组目的片段,扩增片段大小为800 bp,电泳结果显示扩增片段正确,测序结果同时显示,扩增所得片段为病毒特异序列。上述实验结果表明成功获得了嵌合病毒ChinDENV4。
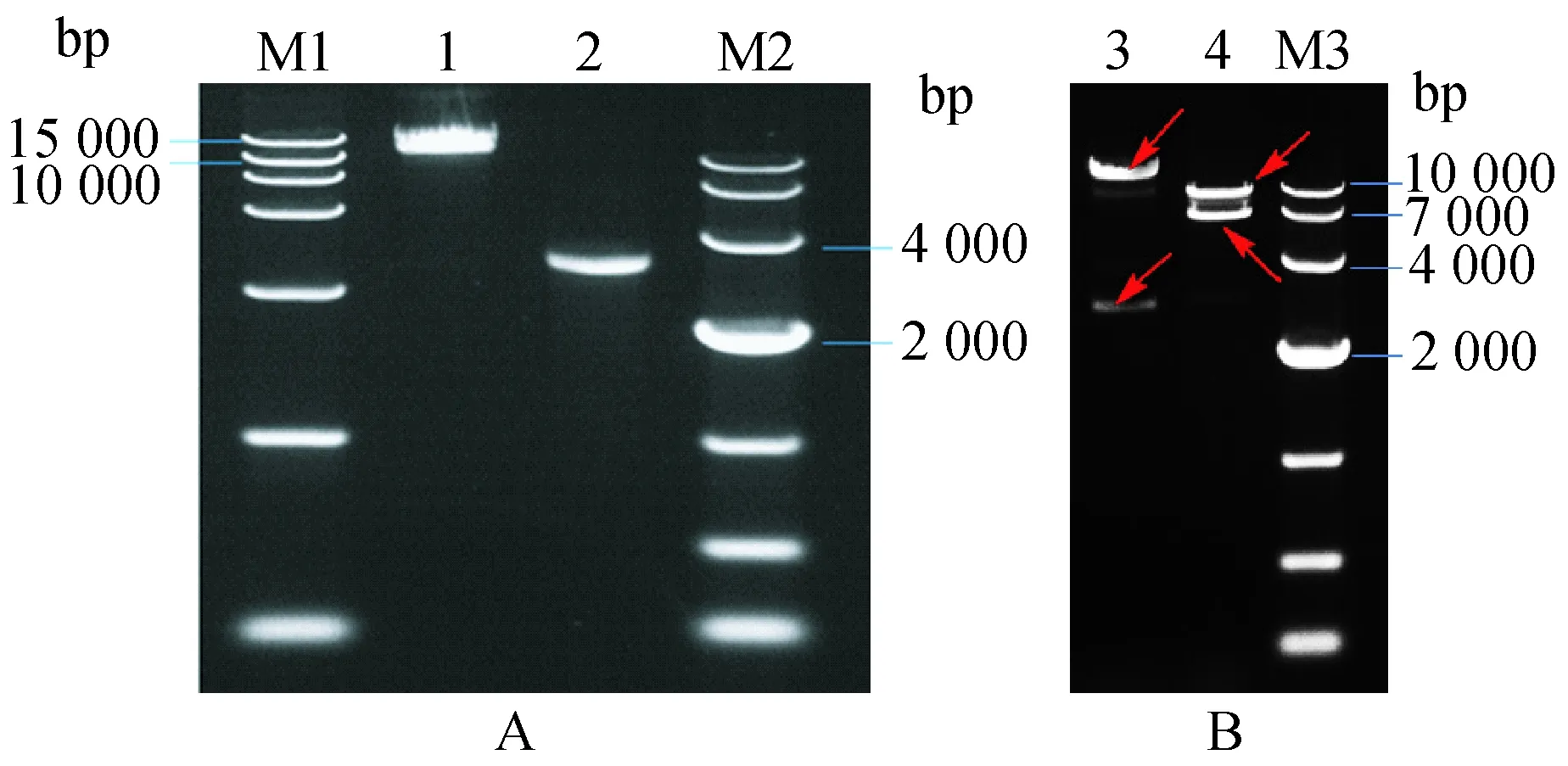
图2 融合片段和嵌合质粒酶切鉴定Fig.2 Identification by restriction enzyme digestionA.融合片段D4-AD和pAJE70双酶切纯化后片段鉴定. M1:DNA marker DL15000;1:pAJE70质粒双酶切回收鉴定;2:融合PCR产物双酶切回收鉴定; M2:DNA marker DL10000。B. 嵌合质粒酶切鉴定. 3:pChinDENV4的SacⅡ酶切鉴定;4:pChinDENV4的NruⅠ酶切鉴定:M3:DNA marker DL10000。A: Restriction enzyme digestion of overlapping PCR product D4-AD and pAJE70. 1: pAJE70 digested by KasⅠand BspEⅠ; 2: Overlapping PCR product digested by KasⅠand BspEⅠ; M1: DNA marker DL15000; M2: DNA marker DL10000. B: Identification of the pChinDENV4 by restriction enzyme digestion. M3: DNA marker DL10000;3: pChinDENV4 digested by SacⅡ; 4: pChinDENV4 digested by NruⅠ.
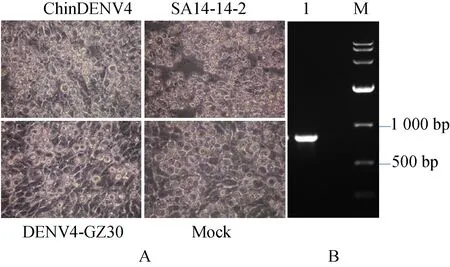
图3 乙脑登革嵌合病毒在BHK-21细胞上引起的细胞病变及病毒鉴定Fig.3 Identification of Chimeric virusA.乙脑登革嵌合病毒在BHK-21细胞上引起的细胞病变; B. 恢复病毒的RT-PCR鉴定.1: RT-PCR扩增的病毒特异序列片段;M: DNA marker DL10000。A: Chimeric virus induced CPE in BHK-21 cells. B: Identification of the chimeric virus by RT-PCR. 1: DNA fragments derived from RT-PCR with primer pairs F8/ R8; M: DNA marker DL10000.
2.3 ChinDENV4的蚀斑形态鉴定
将拯救的嵌合病毒株与其亲本病毒株SA14-14-2和DENV4-GZ30在BHK-21细胞上的蚀斑形态进行了比较,结果显示(图4),嵌合病毒株同样能够在 BHK-21 细胞上形成形态清晰、大小均一的蚀斑。并且与亲本病毒株形成的蚀斑形态相比,嵌合病毒蚀斑直径小于SA14-14-2株,而大于DENV4-GZ30株。
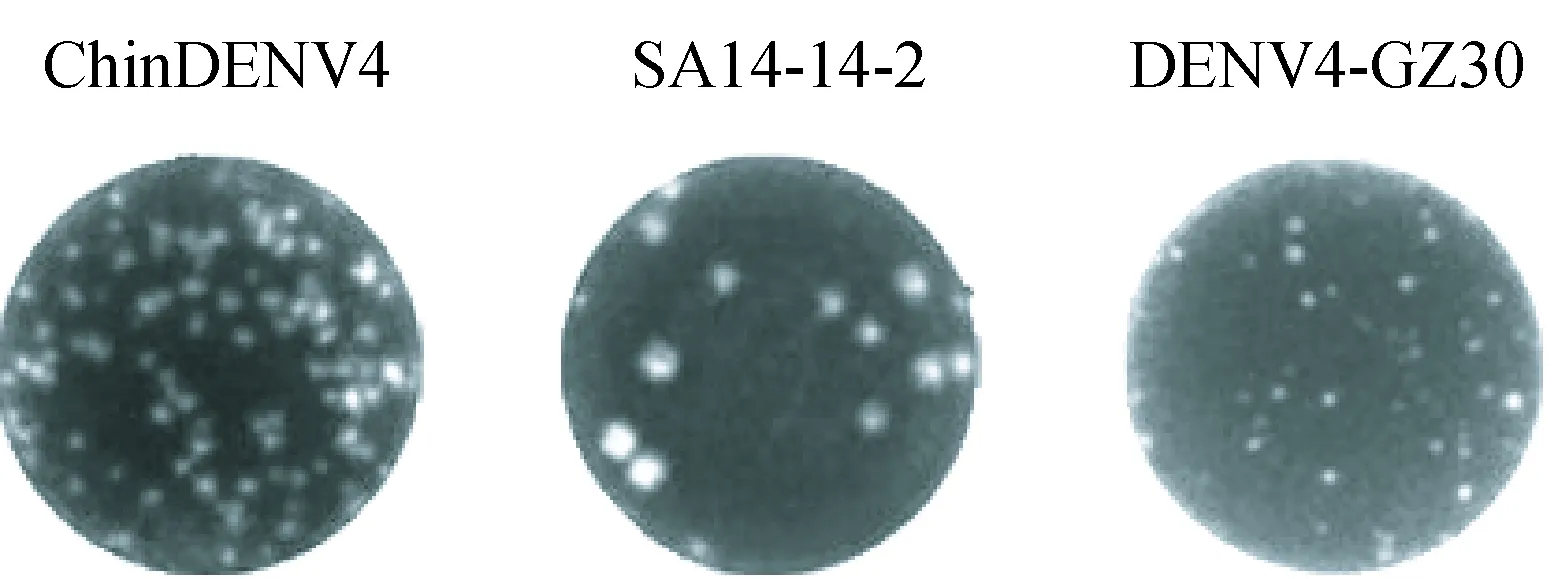
图4 嵌合病毒ChinDENV4与其亲本病毒株在BHK-21细胞上的蚀斑形态Fig.4 Plaque morphologies of ChinDENV4,SA14-14-2 and DENV4-GZ30 in BHK-21 cells
2.4 ChinDENV4的特异病毒蛋白分析
为了分析嵌合病毒在感染细胞中的病毒特异蛋白表达情况,用间接免疫荧光法对ChinDENV4、SA14-14-2和DENV4-GZ30感染72 h后的BHK-21 细胞的病毒蛋白进行鉴定,MOI=0.01。以登革4型 E 蛋白单克隆抗体MAb 2B8、乙脑NS1蛋白的 JN1为一抗,Alexa Fluor 488标记山羊抗小鼠作为二抗。结果显示(图5),亲本株SA14-14-2只能表达乙脑NS1蛋白,DENV4-GZ30只能表达登革E蛋白,而嵌合病毒株ChinDENV4能够同时表达登革E蛋白和乙脑NS1蛋白。
2.5 ChinDENV4和亲本株在不同细胞系中生长特性鉴定
按照MOI=0.1,将嵌合病毒株ChinDENV4和亲本病毒株SA14-14-2、DENV4-GZ30接种于BHK-21和C6/36细胞,在24、48、72、96 h分别收集细胞上清,使用空斑法测定各时间点细胞上清病毒滴度。实验结果表明(图6),ChinDENV4感染细胞48 h后病毒滴度达到峰值,分别为1.26×105和1.58×106PFU/mL,在BHK-21细胞上复制趋势与亲本株相似,在C6/36细胞上则比亲本株复制较快,提前达到峰值。
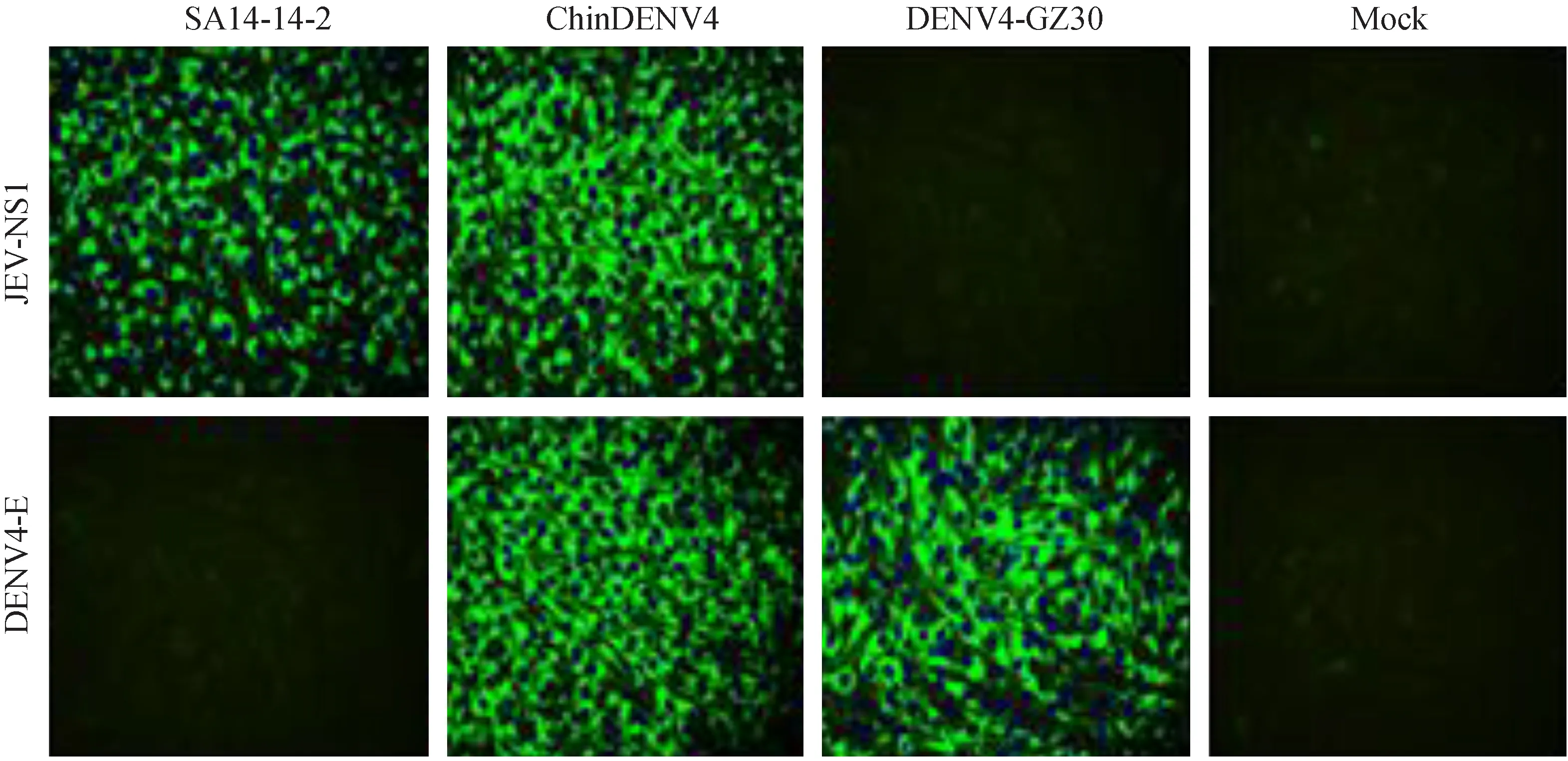
图5 嵌合病毒与其亲本病毒的间接免疫荧光鉴定Fig.5 Indirect fluorescence assay of ChinDENV4,SA14-14-2 and DENV4 virus recovery in BHK-21 cells
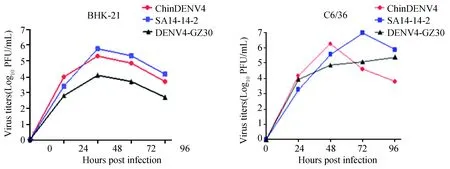
图6 嵌合病毒与亲本株在BHK-21、C6/36细胞上的生长曲线Fig.6 Growth curves of ChinDENV4, SA14-14-2 and DENV4-GZ30 in BHK-21 and C6/36 cells
2.6 ChinDENV4的乳鼠神经毒力评价
将相同剂量的ChinDENV4和DENV4-GZ30采用乳鼠颅内接种法对嵌合感染1日龄BALB/c乳鼠,观察并记录小鼠存活情况,评价ChinDENV4的乳鼠神经毒力。结果显示(表2),ChinDENV4的 LD50为6.32 PFU,而其亲本病毒DENV4-GZ30的 LD50为2.94 PFU,降低2倍以上,表明ChinDENV4神经毒力弱于DENV4-GZ30病毒株,具有减毒效果。
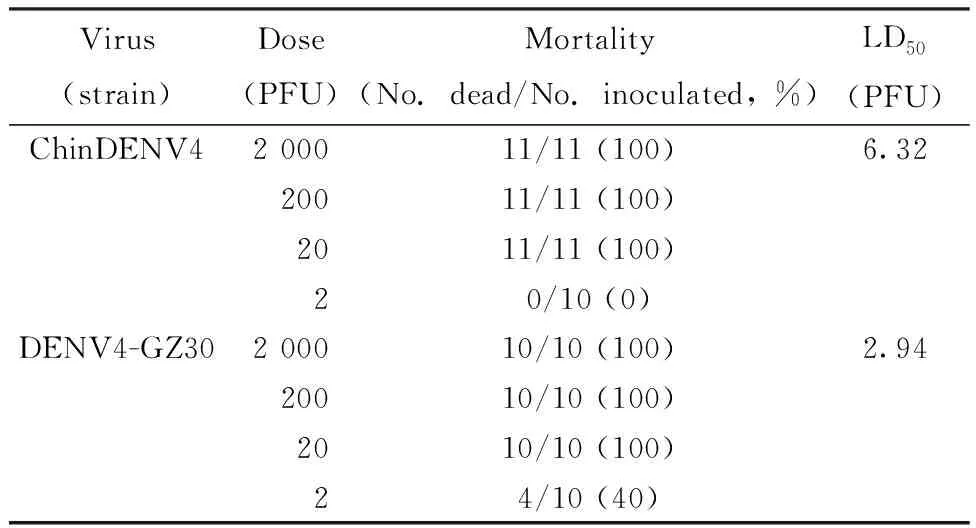
表 2 ChinDENV4 与其亲本病毒的乳鼠神经毒力Tab.2 Neurovirulence of ChinDENV4 and its parental viruses in suckling mice
3 讨论
SA14-14-2作为乙型脑炎病毒的减毒活疫苗,已经在中国、印度以及东南亚部分国家和地区接种使用,并且已经获得了世界卫生组织的认可并推荐使用。SA14-14-2的原型株为SA14,在俞永新教授带领下,其研究团队将SA14在原代地鼠肾细胞以及鼠脑中多次传代后,并通过噬斑分离得到(Eckelsetal.,1988)。与亲本病毒SA14相比,SA14-14-2的神经毒力以及神经侵袭力显著减弱,并具有很好的免疫原性,能提供长期有效的免疫保护(Yangetal.,2014)。
鉴于此,我们尝试以乙脑减毒活疫苗SA14-14-2为骨架通过反向遗传学技术成功构建了乙脑嵌合登革4型病毒,并对其蚀斑形态、生长曲线、特异蛋白表达与神经毒力进行了的评价。研究结果显示嵌合病毒的蚀斑直径小于乙脑减毒活疫苗株而与登革病毒之间差异小;在BHK-21和C6/36细胞中可有效复制,其乳鼠神经毒力也弱于亲本病毒。此外,我们选取的prM/E供体源自我国登革分离株,拯救获得的嵌合登革病毒有望刺激产生更有效的免疫保护效力。
理想的登革疫苗是能产生针对四种型别登革病毒感染的保护,而不会出现ADE现象。因此新型登革疫苗应为四价疫苗。此前,本实验室已经成功构建乙脑/登革2型嵌合疫苗候选株,并在小鼠及恒河猴模型中对病毒攻击具有良好的保护效果(Lietal.,2013),而本研究中我们构建了登革4型嵌合减毒疫苗株,并对其生物学特性进行了充分的鉴定,在此基础上,我们将进一步建立登革病毒1、3型嵌合疫苗株,从而为新一代登革四价疫苗的研制奠定关键的技术基础。

