妊娠晚期血脂水平与不同类型子痫前期相关性分析
蒋 静 沈孟荣 辛怀丽 吴利萍
脂代谢异常、凝血功能异常与子痫前期密切相关,且高血脂可激活脂质过氧化反应,引起内皮细胞损伤,并影响机体微循环,进而造成机体凝血功能障碍[1-2]。子痫前期临床分型较多,其中轻度子痫前期(mild preeclampsia,MPE)临床症状较轻,而晚发型重度子痫前期(late onset preeclampsia,LPE)、早发型重度子痫前期(early onset preeclampsia,EPE)病情严重,若未得到合理诊治,则能进展为子痫,威胁孕母及围产儿生命健康[3]。因此,及时评估子痫前期类型非常重要。基于此,本研究回顾性分析妊娠晚期子痫前期孕妇及同期无妊娠并发症的健康孕妇各102例临床资料,以分析血脂水平与不同类型子痫前期的相关性,为临床预测子痫前期的临床类型提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年6月至2018年6月亳州市人民医院102例妊娠晚期子痫前期孕妇临床资料,其中51例MPE(MPE组)、31例LPE(LPE组)、20例EPE(EPE组),并将同期102例无妊娠并发症的健康孕妇作为对照组。纳入标准:MPE、LPE、EPE患者均符合第8版《妇产科学》[4]诊断标准;年龄20~35岁;孕周≥28周;单胎妊娠;临床资料完整。排除标准:合并其他妊娠并发症;合并原发性高血压;伴肝、肾等重要器官功能障碍。MPE组年龄21~34岁,平均(28.45±5.12)岁;体质指数28~35 kg/m2,平均(31.65±3.12)kg/m2;产次0~3次,平均(2.09±0.51)次。LPE组年龄21~34岁,平均(28.57±5.09)岁;体质指数28~35 kg/m2,平均(31.79±3.22)kg/m2;产次0~3次,平均(2.12±0.50)次。EPE组年龄21~34岁,平均(28.69±5.03)岁;体质指数28~35 kg/m2,平均(31.83±3.34)kg/m2;产次0~3次,平均(2.15±0.53)次。对照组年龄21~34岁,平均(28.32±5.10)岁;体质指数28~35 kg/m2,平均(31.83±3.34)kg/m2;产次0~3次,平均(2.05±0.51)次。4组孕妇年龄、体质指数、产次等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法 病例组于入院第2天取空腹静脉血,健康对照组纳入同期产检空腹静脉血。使用全自动生化分析仪(美国贝克曼公司,型号:AU2700)检测4组血清总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平。

2 结果
2.1 4组对象血脂水平比较 4组对象血清HDL-C水平比较,差异无统计学意义(P>0.05);MPE组与对照组血清TC、TG、LDL-C水平比较,差异无统计学意义(P>0.05);LPE组及EPE组血清TC、TG、LDL-C水平均高于MPE组和对照组(P<0.05),且EPE组高于LPE组(P<0.05)。详见表1。
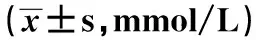
表1 4组血清TC、TG、HDL-C、LDL-C水平比较
注:与对照组比较,aP<0.05;与MPE组比较,bP<0.05;与LPE组比较,cP<0.05;TC为总胆固醇,TG为三酰甘油,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇,MPE为轻度子痫前期,LPE为晚发型重度子痫前期,EPE为早发型重度子痫前期
2.2 各血脂指标预测LPE的ROC曲线分析 血清TC、TG、HDL-C、LDL-C对预测LPE的AUC分别为0.592(P=0.123)、0.688(P=0.002)、0.446(P=0.361)、0.804(P<0.001);灵敏度分别为60.78%、56.86%、100.00%、78.12%;特异度分别为58.06%、77.42%、12.92%、78.15%;约登指数分别为0.189、0.343、0.129、0.563;其中以血清TG、LDL-C对预测LPE有意义。详见图1。
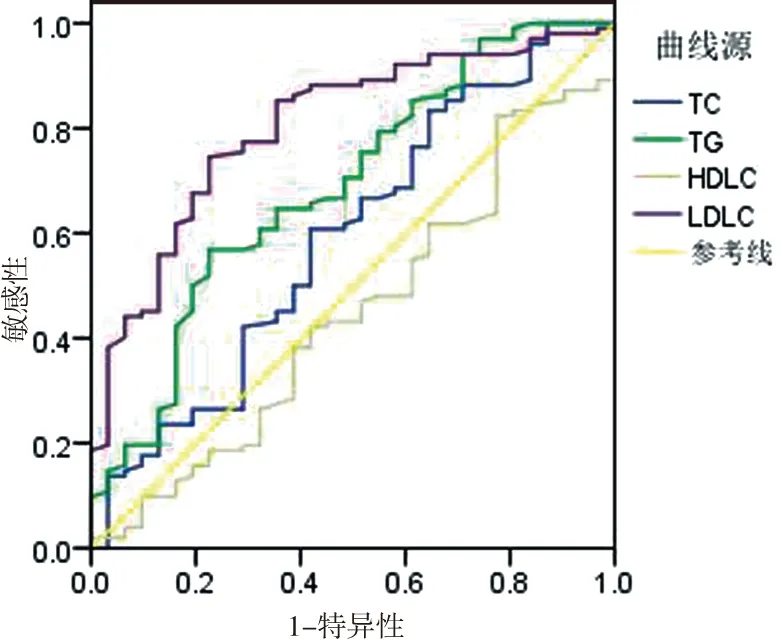
图1 血脂指标预测LPE的ROC曲线分析
2.3 各血脂指标预测EPE的ROC曲线分析 血清TC、TG、HDL-C、LDL-C对预测EPE的AUC分别为0.891(P<0.001)、0.973(P<0.001)、0.357(P>0.05)、0.894(P<0.001);灵敏度分别为77.45%、96.08%、100%、84.32%;特异度分别为95.00%、90.00%、35.00%、89.00%;约登指数分别为0.725、0.861、0.350、0.733;其中以TC、TG、LDL-C对预测LPE有意义,且各血脂指标预测EPE的AUC及约登指数均高于上述预测LPE。详见图2。

图2 各血脂指标预测EPE的ROC曲线分析
3 讨论
子痫前期病因复杂,免疫、遗传、胎盘异常等多种因素均与子痫前期的发生密切相关[5]。子痫前期有不同临床类型,处理和妊娠结局不同[6]。因此,预测子痫前期的临床类型,并及时予以相应干预,对改善母婴结局有一定意义。虽然正常妊娠孕妇体内脂代谢可出现一系列适应性变化[7],但当脂代谢严重障碍引起血脂代谢超出限定范围时,可造成动脉血管壁平滑肌细胞增生、血管收缩、脂质沉积、血小板聚集等一系列临床变化,并损伤血管内皮细胞[8],故脂代谢与子痫前期的发生具有一定相关性。对此,本研究就血脂指标评估预测子痫前期临床类型的可能性进行分析。
常用脂代谢指标中TC、TG及LDL-C升高均提示脂质堆积[9],HDL-C可辅助乳糜微粒及极低密度脂蛋白胆固醇合成,减少游离胆固醇沉积于血管壁[10]。本研究中4组对象血清HDL-C水平无显著差异,考虑此结果与脂质代谢紊乱病理变化过程复杂有关,子痫前期早期HDL-C可出现升高,但随着病情发展,HDL-C分泌受到抑制,使不同类型子痫前期患者HDL-C水平趋于相似[11]。另外,MPE组与对照组血清TC、TG、LDL-C水平也无显著差异,提示血脂代谢异常与MPE相关性较小,分析其原因可能与MPE血管内皮损伤较轻,而机体脂代谢异常不明显[12]有关。
本研究还发现,LPE组血清TC、TG、LDL-C水平均高于MPE组和对照组,且血清TG、LDL-C对预测LPE的AUC为0.688、0.804,也提示血脂代谢异常对预测LPE的发生有一定作用。不仅如此,EPE组血清TC、TG、LDL-C水平均高于MPE组和对照组,且对预测EPE的AUC分别为0.891、0.973、0.894,显著高于LPE组。即血脂代谢异常与EPE的发生相关性更高,对预测EPE更有价值。推测此结果由以下3个因素共同作用引起:①血脂异常可导致胎盘功能不良,促进胎盘血管细胞损伤及凋亡,使子痫前期发生更早,出现EPE[13];②脂代谢异常导致的脂质堆积也能增加血栓发生风险,使机体凝血功能障碍,并导致绒毛浸润异常,引起胎盘浅着床,增加胎盘缺血、缺氧现象,使胎盘局部氧化应激及免疫损伤增强,诱发EPE[14];③而LPE胎盘功能改变较小,与机体系统性疾病相关,为一种疾病与机体长期耐受最终失衡的温和状态,故血脂代谢异常程度可较轻,相关性也不及EPE[15]。
综上所述,妊娠晚期TC、TG、LDL-C水平与LPE及EPE均有相关性,但血脂水平与EPE的相关性更高。

