长链非编码RNA ATB调控miR-144对胶质瘤迁移和侵袭的影响
雷 波 詹 傲 张 召 张孝礼 万晓强
胶质瘤是人类最致命的恶性肿瘤之一,每年导致超过40万人死亡[1],5年生存率低于15%[2]。目前,常用的胶质瘤经典肿瘤标志物有血清鳞状细胞癌抗原(serum squamous cell carcinoma antigen,SCCA)、碳水化合物抗原(carbohydrate antigen ,CA)19-9、癌胚抗原(carcinoembryonic antigen ,CEA),但在早期诊断中缺乏敏感性和特异性[3-4]。因此,探索新的标志物对早期发现胶质瘤十分重要。长链非编码RNA(long-chain non-coding RNA ,lncRNA)长度超过200个碱基,缺乏蛋白质编码能力,通过调控致癌和肿瘤抑制途径在肿瘤发生、发展和转移中发挥关键作用[5-6]。lncRNA在多种肿瘤中常表达失调,其异常表达可作为多种人类恶性肿瘤如乳腺癌、肺癌、肝癌、结肠癌的潜在诊断或预后生物标志物[7-11]。本研究探讨长链非编码RNA ATB(long-chain non-coding RNA ATB,lncRNA ATB)在胶质瘤中的表达情况及调控miR-144对胶质瘤迁移和侵袭的影响。
1 材料与方法
1.1 病理组织收集 收集2017年1月至2018年1月乐山市人民医院术前病理检查确诊为胶质瘤并行手术切除的肿瘤组织30份,同时取距癌灶2 cm的癌旁正常组织30份。取材后将组织样品迅速放在入液氮中保存,至RNA提取。所有患者术前未行新辅助化疗、放疗,无手术禁忌证,并随访其生存时间和状态。本研究通过院伦理委员会审批,患者及家属术前均签署知情同意书。
1.2 细胞培养 人胶质瘤细胞株U87、U251、SHG44和SWO-38购于上海复旦大学细胞研究所。1640培养基和0.25%胰酶购于美国 Gibco公司,胎牛血清购于美国海克隆公司,si-ATB购于上海吉玛有限公司。U87、U251、SHG44和SWO-38胞均培养于含10%胎牛血清和1%青链霉素的培养基中,置于5% CO2、37℃培养箱中,每隔3 d换液1次,待细胞铺满培养瓶底进行传代。以下所有试验均取处于对数生长期的细胞。
1.3 细胞转染 使用PBS缓冲液将细胞清洗干净,重复3次,胰酶消化细胞2 min,转移至无菌15 mL离心管,离心并计数细胞,以每孔4×105个细胞接种于6孔板中,使融合率达70%左右,使用无血清培养基按3 μL/L进行稀释转染试剂,37℃孵育20 min,用无血清培养基分别将si-ATB和对照组按50 μmol/L浓度稀释,常温下孵育5 min,最后与转染试剂等体积分别混匀,37℃培养箱继续培养。12 h后,观察转染细胞状态,并将无血清培养基更换为完全培养基,继续培养,继续培养48 h后,提取细胞RNA,验证转染效率。实验分为慢病毒转染实验组和空白病毒转染组,转染si-ATB为实验组,转染空白慢病毒为对照组。
1.4 定量实时PCR分析 定量实时聚合酶链式反应反应条件为:95℃预变性10 min,95℃15 s,60℃15 s,45个循环,获取荧光信号温度为60℃。普通DNA PCR检测,以GAPDH为内参,采用2-△△Ct方法进行统计。ATB序列:正向5’-AAATATGGCGGCGTCTA CACGGA-3’,反向5’-TCCAGAACCCTCTGACATTTGCCT-3’;miR-144引物序列:正向5’-AATCAGAGTACATGCGACTGAGA-3’, 反向5’-GCTGTATCCTTCGCTGTTTCC-3’。
1.5 平板克隆细胞实验 首先消化并计数细胞,以5 000个/孔细胞数接种于96孔板中,每组3个复孔,37℃培养箱培养;待细胞贴壁,观察细胞状态,吸出培养基,避光条件下,分别加入慢病毒转染的细胞中,37℃孵育24 h;检测不同组细胞的克隆形成数目,并统计分析。
1.6 Transwell侵袭实验 将5×104个转染慢病毒后的细胞置于上室,并加入Matrigel基质胶,将10%FBS的培养基置于下室中。在37℃下孵育24 h后,细心去除上膜表面的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净后,于倒置显微镜下计数。
1.7 双荧光素酶报告基因检测实验 ATB基因野生型3’UTR、突变型3’UTR片段,两端均设计XbaⅠ酶切位点,插入荧光素酶基因质粒构建 pGL3-3’UTR野生型(wild type,wt)、pGL3-3’UTR突变型(mutant type,mut), 取生长状态良好的细胞,质粒转染后48 h根据操作说明,裂解细胞,加入荧光素酶底物,检测荧光素酶活性。
1.8 裸鼠肿瘤异种移植模型 将si-ATB组和对照组U87细胞按1×106/孔浓度分别注射到4~6周龄裸鼠的腋窝下。饲养8周后检测两组裸鼠异种移植物的体积和质量生长情况。

2 结果
2.1 lncRNA ATB在胶质瘤组织中表达及和生存率之间的关系 通过qPCR检测lncRNA ATB在胶质瘤组织中和癌旁正常组织中的表达差异,癌组织中lncRNA ATB的相对表达量高于癌旁正常组织[(3.84±0.32)比(1.21±0.15),t=12.670,P=0.003]。同时对患者进行随访,通过Kaplan-Meier生存分析发现,lncRNA ATB的表达水平与胶质瘤患者的生存情况相关(χ2=9.348,P=0.016),见图1。

图1 lncRNA ATB表达水平与胶质瘤患者的生存情况分析
2.2 lncRNA ATB在细胞株中的表达水平及慢病毒转染情况 通过qPCR实验检测lncRNA ATB在不同胶质瘤细胞株中的表达情况,结果显示,lncRNA ATB在U87细胞株表达水平相对升高,与其他细胞株相比,表达水平差异有统计学意义[(2.12±0.32)比(3.36±0.35)比(1.26±0.23)比(0.86±0.11),t=12.516,P=0.023;t=14.112,P=0.011;t=11.957,P=0.005]。通过使用si-ATB1和si-ATB2转染胶质瘤U87和U251细胞后,lncRNA ATB的相对表达量降低,差异有统计学意义[U521si-ATB1:(1.01±0.02)比(0.56±0.02),t=23.029,P=0.005;U521si-ATB2:(1.01±0.02)比(0.43±0.01),t=43.078,P=0.003;U87si-ATB1:(1.03±0.01)比(0.44±0.02),t=46.561,P=0.003;U87si-ATB2:(1.03±0.01)比(0.49±0.03),t=37.912,P=0.004]。
2.3 双荧光素酶实验检测lncRNA ATB和miR-144之间的关系 通过检测到lncRNA ATB与miR-144具有相似的结合位点,两者可能存在内在调控关联。为进一步验证lncRNA ATB与miR-144之间的联系,通过双荧光素酶实验进行检测。过表达miR-144后,野生型lncRNA ATB的荧光素酶活性受到明显抑制[(1.95±0.05)比(0.83±0.15),t=37.064,P=0.002],而对突变型lncRNA ATB的荧光素酶活性影响不大[(1.93±0.02)比(2.01±0.05),t=1.752,P=0.149],显示miR-144可以直接与lncRNA ATB结合位点结合并影响荧光素酶活性。
2.4 ATB对细胞株增殖能力的影响 通过平板克隆实验检测lncRNA ATB对胶质瘤细胞株U87和U251增殖能力的影响。首先使用特异的干扰RNA(si-ATB)抑制胶质瘤细胞中lncRNA ATB的表达,在转染si-ATB 24、48和72 h后,U87和U251细胞的增殖能力低于各自对照组[U521si-ATB1:(0.56±0.05)个 比(0.23±0.02)个,t=34.762,P=0.003;U521si-ATB2:(0.56±0.05)个 比(0.19±0.04)个,t=48.180,P=0.002;U87si-ATB1:(0.50±0.06)个 比(0.18±0.02)个,t=51.309,P<0.001;U87si-ATB2:(0.50±0.06)个 比(0.21±0.05)个,t=39.030,P=0.003]。详见图2。

图2 lncRNA ATB对胶质瘤细胞U87和U251增殖能力的影响
2.5 lncRNA ATB对胶质瘤细胞株凋亡行为的影响 用流式细胞术检测lncRNA ATB对胶质瘤细胞凋亡的影响。lncRNA ATB的下调提高了U251[(14.2±0.5)% 比 (7.2±0.4)%比(4.6±0.3)%;t=13.324、P=0.0347,t=10.471、P<0.001]和U87[(13.9±0.7)% 比 (10.1±0.3)% 比 (5.6±0.4)%;t=14.760、P=0.033,t=16.682、P=0.002]凋亡百分比。详见图3。
2.6 lncRNA ATB对细胞株侵袭能力的影响 抑制lncRNA ATB 72 h后,U251细胞[(186.4±12.4)个 比 (73.6±8.6)个 比 (62.6±5.6)个;t=10.269、P<0.001,t=11.587、P=0.001]和U87细胞[(192.2±15.3)个 比(63.6±6.3)个 比(68.3±7.6)个;t=14.432、P<0.001,t=13.783、P<0.001]的侵袭能力降低。详见图4。
2.7 lncRNA ATB对裸鼠移植瘤的影响情况 通过裸鼠异种移植肿瘤生长测定移植瘤体积和质量情况。将si-ATB转染的U87细胞分别注射入裸鼠,在注射后28 天,将小鼠处死并取肿瘤。与对照组相比,si-ATB组平均肿瘤体积小于对照组[(846.3±26.3)mm3比 (306.5±19.9)mm3,t=15.332,P<0.001],且si-ATB组平均肿瘤质量也低于对照组[(0.62±0.23)g 比 (1.52±0.24)g,t=10.580,P<0.001]。详见图5。
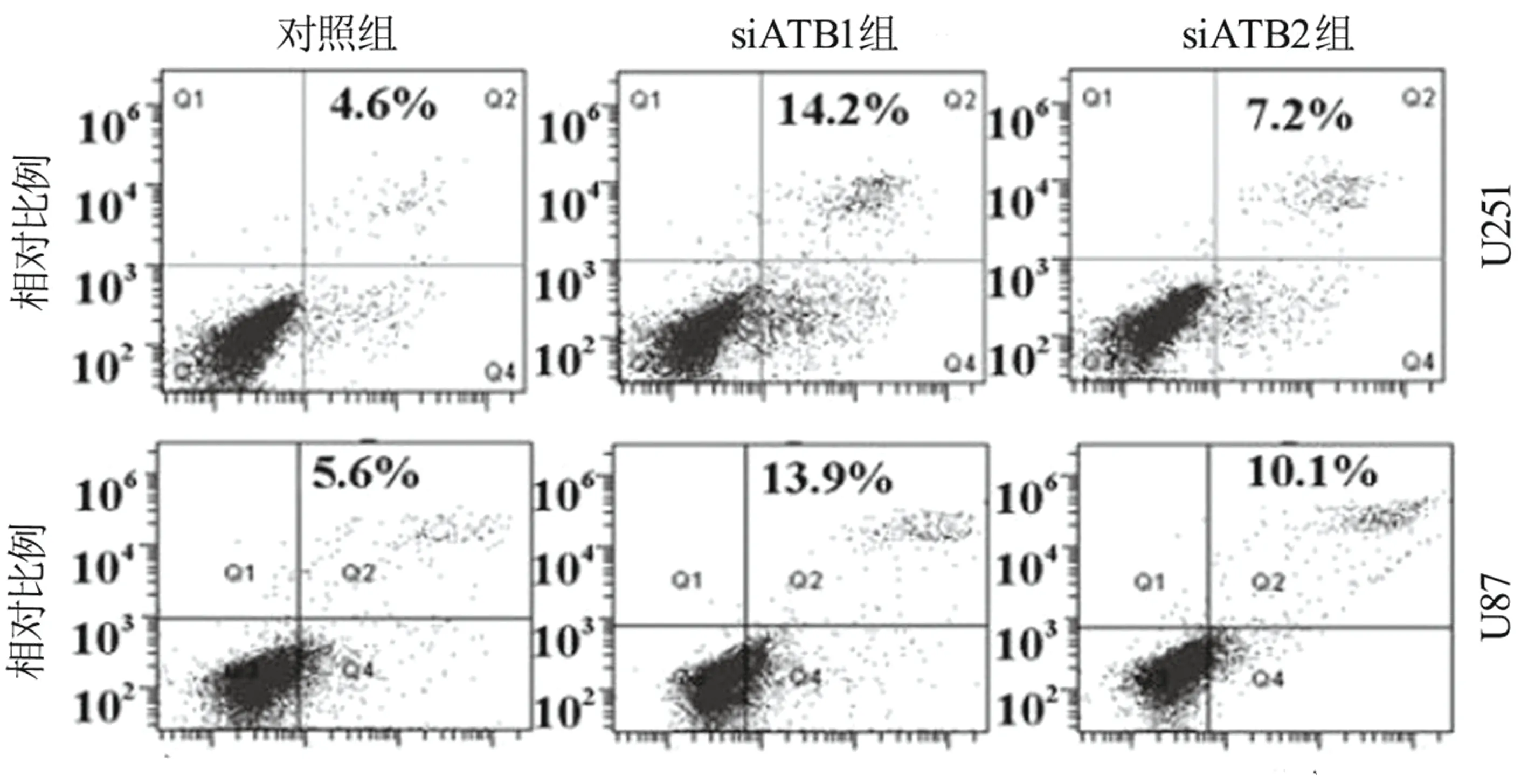
图3 lncRNA ATB对胶质瘤细胞U87和U251凋亡的影响

图4 lncRNA ATB对胶质瘤细胞株侵袭能力的影响

图5 lncRNA ATB对胶质瘤细胞裸鼠成瘤模型的影响
3 讨论
lncRNA ATB作为癌症发生和发展过程中的关键调控分子[12-13],其可能会成为胶质瘤最有潜力的治疗靶点。lncRNA作为一种新型肿瘤标志物,检测血循环中RNA已成为非侵入性诊断应用的新方向[14]。然而,目前关于早期检测胶质瘤患者血循环中lncRNA水平的研究较少,本研究就此开展此项实验。
有报道指出,lncRNA ATB在乳腺癌,结、直肠癌,食管鳞状细胞癌中上调,并且促进肿瘤侵袭和转移以及影响生存率[15]。本研究首次证明了lncRNA ATB在胶质瘤中的调控方式,并揭示lncRNA ATB表达与胶质瘤的侵袭性生物学行为相关,同时在动物体内检测lncRNA ATB的表达下调可以直接影响胶质瘤细胞的成瘤能力。此外,lncRNA ATB表达高的患者的淋巴结转移多,晚期和组织学分化程度高于lncRNA ATB表达低的患者[13]。
lncRNA ATB在体外调节多种肿瘤细胞的增殖、侵袭和凋亡[13]。lncRNA ATB在乳腺癌细胞中的表达促进了细胞侵袭,lncRNA ATB的敲低降低了乳腺癌细胞侵袭能力,同时抑制了细胞生长,调节了细胞周期进程并诱导细胞凋亡,并且在多种肿瘤组织中都存在lncRNA ATB的表达异常[15-17]。本实验证实siRNA介导的ATB导致胶质瘤细胞增殖、集落形成效率和侵袭能力显著降低及细胞凋亡显著增加,推测lncRNA ATB调控miR-144的表达影响胶质瘤的发展。
本研究表明,lncRNA ATB在胶质瘤患者中存在过表达状态,且在一定程度上表明预后差,通过诱导肿瘤细胞增殖和侵袭并减少癌细胞凋亡来促进肿瘤的发展。此外,lncRNA ATB可能通过靶向调控miR-144的表达参与下游信号通路的介导,lncRNA可能是未来胶质瘤治疗中有价值的预测标志和新的治疗靶标。

