磁共振扩散加权成像对肝细胞癌化疗栓塞术后疗效的随访价值
李 爽 刘 影 吕维富
肝细胞癌(hepatocellular carcinoma,HCC)已成为我国肿瘤相关死因中第二大恶性肿瘤,且发病率和死亡率呈逐年上升趋势,严重威胁我国人民的生命健康[1-2]。HCC起病隐匿、早期难以发现,虽然手术切除是主要治疗方式,但患者5年生存率不足15%[3],70%~90%的患者发现时往往已到中晚期,失去了手术切除的最佳时机。由于经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)具有创伤小、适应症广、并发症少、术后不良反应轻等优点,成为不可手术切除HCC患者姑息治疗的首选方式[4]。但是,TACE术后肿瘤完全坏死率仅为22%~29%[5],复发率较高,需多次介入治疗,因此需要有效的随访方式客观评价术后疗效。近年来,磁共振弥散加权成像(diffusion-weighted imaging,DWI)可以在肿瘤形态学改变前通过表观弥散系数(apparent diffusion coefficient,ADC)定量反映组织结构及细胞功能改变[6],在评价肝细胞癌TACE术后疗效方面的应用日趋广泛。本研究选取HCC患者为研究对象,探讨DWI在HCC化疗栓塞术后疗效评估中的随访价值,现报道如下。
1 资料与方法
1.1 一般资料 选取安徽省立医院2014年1月至2016年12月收治的经临床或病理检查确诊的52例HCC患者为研究对象,其中18例依据美国肝病研究学会制定的原发性肝癌诊断标准临床诊断[7],另外34例经皮穿刺活检病理证实。其中男性41例(78.85%),女性11例(21.15%),年龄38~76岁,平均(58.3±11.8)岁;TACE治疗前,20例(38.46%)乙肝表面抗原(HBsAg)阳性,38例(73.08%)甲胎蛋白(alpha-fetoprotein, AFP)≥400 ng/L;根据肝功能Child-Pugh分级标准[8]:A级24例(46.15%),B级28例(53.85%);初诊时每例患者病灶1~4个不等,共计发现68个病灶,其中位于肝右叶43个(63.24%),肝左叶22个(32.35%),肝尾叶3个(4.41%);病灶直径1.0~13.9 cm,平均(8.9±2.5)cm,单发者44例(84.62%),多发者8例(15.38%);肝癌分类中,巨块型12例(23.08%),结节型38例(73.08%),小癌型2例(3.85%);主要表现为上腹部疼痛、腹部包块、消瘦乏力、门静脉高压等;TACE术依据2011版原发性肝癌诊疗规范[9],每例患者均经1~3次TACE治疗(46例接受1次TACE治疗,4例接受2次,2例接受3次);所有研究对象均签署知情同意书,并经医院伦理委员会批准。
1.2 纳入排除标准 纳入标准:①所有患者均经血清AFP、影像学检查或经皮穿刺病理学确诊,无法行外科手术切除;②肝功能Child-Pugh评分在B级及以上(即A、B级患者);③无严重心、脑、肺、肾等重要脏器功能障碍;④无MRI平扫、增强以及DWI扫描检查禁忌;⑤无相关药物过敏史;⑥依从性高,自愿签署知情同意书。排除标准:①有严重的凝血功能障碍、出血倾向、合并感染或多脏器功能衰竭;②肝癌分型为弥漫型或伴有全身广泛转移者;③肝功能Child-Pugh评分为C级,临床症状表现严重肝硬化及腹水;④对碘对比剂过敏;⑤依从性差,不能完成随访者;⑥既往存在门静脉高压引发的上消化道出血病史。
1.3 方法
1.3.1 MRI扫描 采用Siemens Trio 3.0 Tesla超导型磁共振扫描仪和体部相控阵柔软线圈扫描,患者检查前6~8 h禁食水,取仰卧位扫描肝脏。扫描参数:T1WI采用快速扰相梯度回波序列,TR 180.0 ms,TE 3.5 ms,层厚6.5 mm,间隔2 mm,矩阵320×320,视野40 cm×30 cm,激励次数2次;T2WI采用呼吸触发快速自旋回波序列,TR 4 500.0 ms,TE 87.8 ms,层厚6.5 mm,间隔2 mm,矩阵256×256,视野38 cm×38 cm,激励次数2次;DWI采取单次激发自旋回波-平面回波(SE-EPI)序列,扩散敏感梯度因子b值取0、600、1 000 s/mm2,同时在X、Y、Z轴3个方向上施加敏感梯度脉冲,TR 4 800.0 ms,TE 120.0 ms,层厚6.5 mm,间隔2 mm,视野45 cm×45 cm,矩阵256×256,激励次数2次。动态增强扫描采用三维容积式插入法屏气检查序列,肘静脉推注对比剂钆喷酸葡胺(Gd-DTPA) 10 mL,流速2.5 mL/s,追加15 mL生理盐水,分别于注射后20 s、60 s、120 s采集肝脏动脉期、门静脉期、延迟期的图像。检查结束后,所得图像传输到工作站,由2名影像科副主任医师以上人员利用Function 2.0软件包独立盲法阅片与分析,并获得肿瘤病灶的ADC参数图,分别利用感兴趣区(region of interest,ROI)于病灶直径的最大层面上测量实性部分的ADC值,尽量避开胆管、血管及有伪影的区域,在同一病灶的不同区域分别测量3次,最终ADC值为2名医生测得ADC的平均值。
1.3.2 MRI随访 所有患者于术前、术后4~6周行上腹部MRI平扫及DWI检查,术后4个月行MRI增强扫描,分析TACE治疗前后病灶的坏死、复发、转移情况以及ADC值,上述检查均在1周内完成。基于TACE治疗后4个月的MRI动态增强扫描结果,按照美国肝病研究学会颁布的改良实体肿瘤疗效评价标准(modified response evaluation criteria in solid tumor,mRECIST)[10],靶病灶直径之和的增加量超过自随访以来最小值的20%或出现新的病灶定义为进展,将研究对象分为进展组和稳定组,分析两组TACE治疗前后病灶形态、信号特点、强化情况以及ADC值。

2 结果
2.1 疗效评价 TACE治疗4个月后行动态增强MRI扫描,参照mRECIST 1.1标准,52例HCC患者中,评价为稳定病例20例,进展病例32例,两组患者术前年龄、性别、肿瘤数目、Child-Pugh分级、血清AFP等基线资料差异无统计学意义(P>0.05),均衡可比,详见表1。
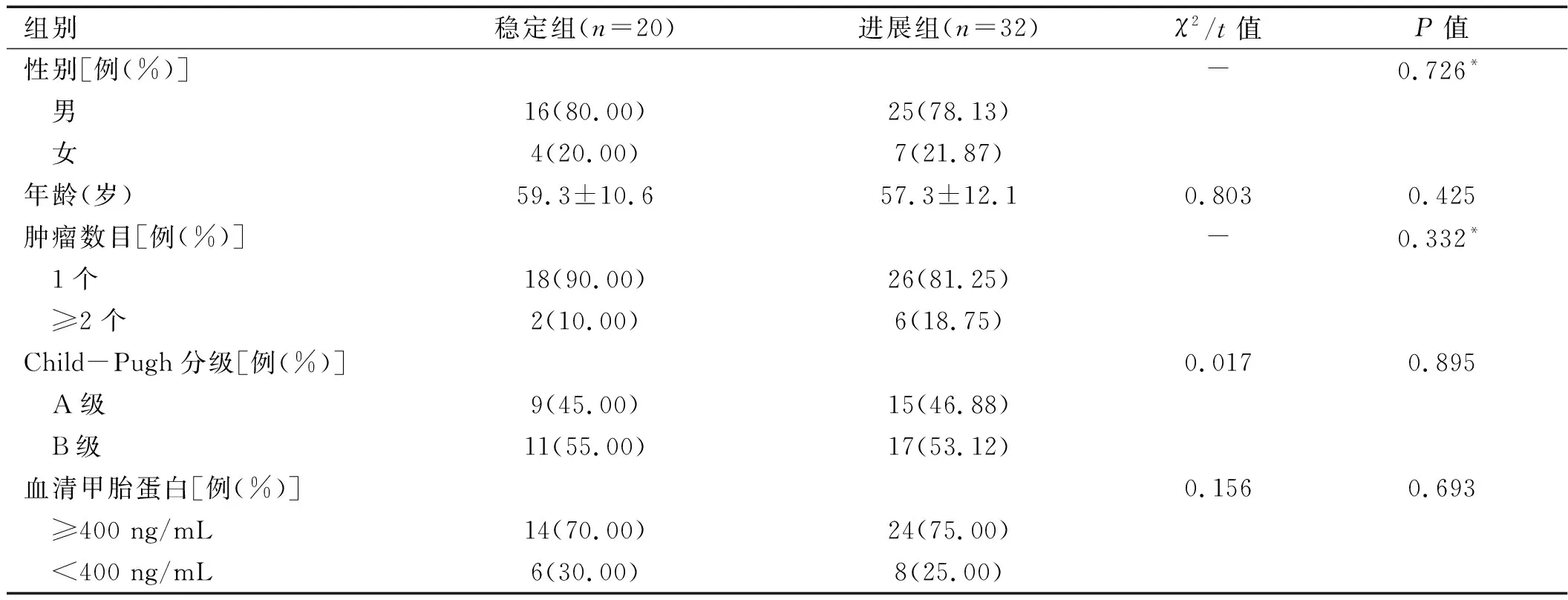
表1 稳定组与进展组患者的基线资料对比
注:*采用Fisher确切概率法
2.2 信号特点 TACE术前,肿瘤病灶以等或稍长T1信号、稍长T2信号为主,信号均匀或混杂,部分病灶内出现囊变坏死区,表现为长T1、长T2信号;病灶于DWI图上表现为均匀或不均匀高信号,于ADC图上表现为低信号,动态增强扫描动脉期病灶均匀或不均匀明显强化,门脉期强化减退,至平衡期信号低于正常肝实质。TACE术后,平扫示碘油沉积区呈等或稍长T1、T2信号,信号均匀或欠均,DWI序列上呈等或稍低信号,动态增强扫描各期均无强化,表示肿瘤未进展,见图1。MRI平扫中病灶于T1WI和T2WI序列上信号表现多样,病灶范围扩大或新发病灶,DWI序列上病灶呈不均性高信号,而于ADC图表现为混杂低信号,动态增强扫描动脉期病灶内可见明显强化,门脉期及平衡期强化减退,见图2。
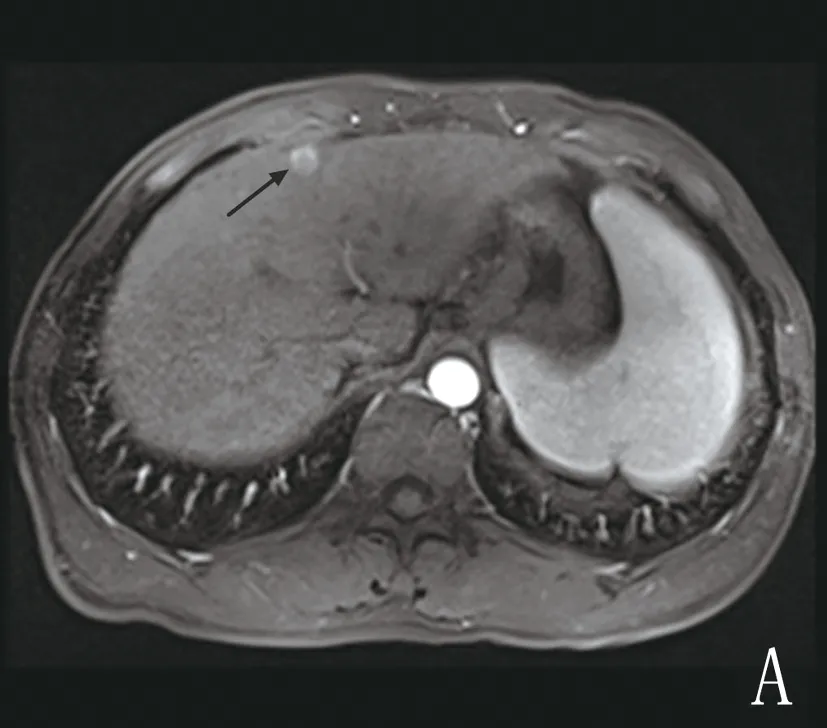
图1 稳定组患者不同时期影像学表现(箭头所示)
注:A为术前动脉期病灶明显强化;B为术后6周动脉期病灶未见强化;C为术前DWI序列病灶呈高信号;D为术后6周DWI序列病灶呈等信号
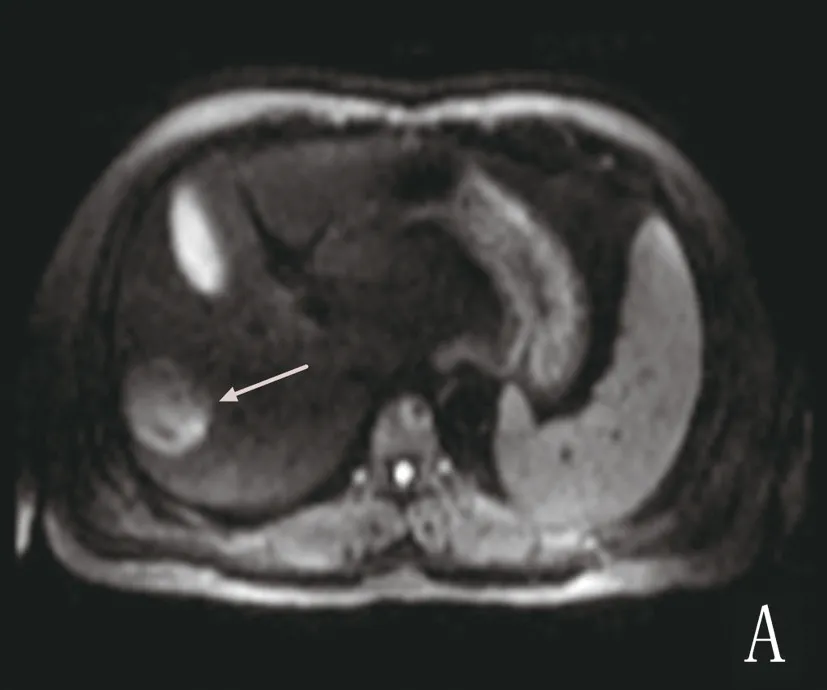
注:A为术前DWI序列病灶呈高信号;B为术后6周DWI序列病灶呈不均匀等信号;C为术后4个月动态增强MR,肝脏膈顶部新发病灶,动脉期明显不均匀强化;D为术后DWI序列新发病灶呈高信号
2.3 TACE治疗前后肿瘤病灶ADC值 TACE术前,稳定组肿瘤病灶的ADC值为(1.24±0.13)×10-3mm2/s,进展组为(1.22±0.21)×10-3mm2/s,差异无统计学意义(t=0.722,P=0.473);TACE术后4~6周,稳定组肿瘤病灶的ADC值为(1.78±0.16)×10-3mm2/s,进展组为(1.29±0.35)×10-3mm2/s,稳定组较术前升高(t=5.915,P=0.006),进展组与术前差异无统计学意义(t=1.062,P=0.292),稳定组手术前后ADC的增加值高于进展组 (t=8.763,P<0.001)。
2.4 DWI的诊断效能 利用ROC确定鉴别稳定组和进展组ADC的最佳截断值为1.28×10-3mm2/s,此时曲线下面积为0.773(95%CI:0.637~0.891,P=0.013),灵敏度和特异度分别为76.3%、68.9%,见图3。
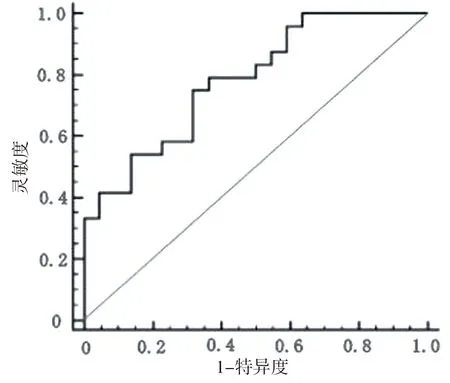
图3 鉴别稳定组和进展组的ROC曲线
3 讨论
HCC超过90%的血供来源于肝动脉,而肿瘤边缘地带主要由门静脉供血,经肝动脉化疗栓塞术可致病灶获得最大面积的缺血坏死,但肿瘤边缘的碘油难以完全沉积,介入术后癌灶有强烈的血管生成行为,极易形成侧支循环,削弱了对肿瘤的抑制作用,单纯TACE治疗常致肿瘤坏死不彻底,患者中位生存期仅为6~20个月。癌灶内碘油的沉积情况与术后生存期有强烈的相关性[11],重复的TACE治疗可能加重肝功能损伤,因此,选择合理的方式早期预测TACE的疗效有助于避免不必要的重复治疗、指导后续治疗计划制定。
DWI是目前唯一一种可提供细胞膜完整性信息、检测活体组织内水分子扩散运动的无创性功能成像技术[12],可利用ADC值定量反映活体组织正常结构及病灶血管灌注速度和范围,ADC值越大,其组织内水分子扩散运动越强。栓塞介入治疗前,HCC肿瘤细胞排布密实,细胞间隙较小,限制了水分子扩展,癌灶在DWI图像上呈高信号,由于肿瘤病灶具有较高活性,在T1WI和T2WI序列上均呈等或长信号;TACE术后,碘油沉积区由于同时存在肿瘤完全坏死组织和肿瘤活性组织,T1WI、T2WI以及DWI序列上信号表现多样,肿瘤完全坏死区域由于病灶坏死并纤维素沉着、肉芽组织形成,肿瘤细胞结构崩解,细胞膜通透性增加,水分子扩散加剧,T1WI、T2WI序列上呈等或稍长T1、T2信号,DWI序列上呈低信号;肿瘤残余或复发区域内肿瘤细胞排列紧密,活性较高,细胞间隙中水分子运动受限,磁共振平扫呈长T1、低T2信号,DWI图像上仍可产生高信号。
TACE术后整个肿瘤的ADC值高低与肿瘤坏死程度呈正相关[13],笔者发现,TACE术后,稳定组较术前ADC值升高,而进展组手术前后ADC值无明显差异,这与Mannelli等[14]的研究报道一致,可能由于稳定组术后肿瘤坏死率较高,肿瘤活性成分较少,多数肿瘤细胞发生液化性坏死,水分子自由扩散能力增强,ADC值较术前会出现明显升高,而进展组术后肿瘤残余或复发病灶较多,导致ADC值升高不明显或无变化[15]。笔者认为,经TACE治疗后肿瘤ADC值的早期增高或许可作为早期评价HCC患者TACE疗效的可靠生物学标志。此外,本研究发现,ADC的最佳截断值为1.28×10-3mm2/s,此时判断进展的灵敏度和特异度分别为76.3%、68.9%,比有关文献报道略低,可能由于本研究为回顾性分析,易产生选择性偏移,此外,ROI、b值大小的选择、MRI的场强以及成像参数的不同等也会对结果产生一定影响[16]。
综上所述,DWI扫描操作简单、无射线损伤,可敏感显示肝癌病灶TACE术后早期超微结构中微观变化,能够定性、定量的评价术后疗效评估,有助于为HCC患者制定适当的、个体化的治疗计划提供科学依据,具有较高的应用价值,值得临床推广运用。

