Peg-IFNα-2b单药或联合阿德福韦对前C区/BCP区突变慢性乙型肝炎患者疗效比较研究
汪 波,刘艳艳,李家斌,2
乙型肝炎病毒(Hepatitis B virus,HBV)感染依然是一项严峻的全球性公共卫生问题,每年因HBV感染相关性肝病死亡人数多达百万[1]。当前,核苷酸类似物(nucleoside analogues,NAs)和聚乙二醇干扰素(pegylated interferon alfa,Peg-IFNα)是治疗慢性乙型肝炎(chronic Hepatitis B,CHB)的两类主要药物,但两者在临床应用上均存在一定局限性。NAs直接抑制病毒复制,降低病毒载量,但对cccDNA作用甚微,可能需要终身服药[2]。Peg-IFNα通过促进细胞毒性T细胞裂解感染肝细胞,并促进多种细胞因子的释放控制病毒复制,具有免疫调节和抗病毒的双重功效,但有限疗程(48周),仅25%~30%的患者可获得持久的治疗应答[3]。有研究[4-5]报道,HBV前C区(PC)区(G1896A)和基本核心启动子区(BCP)区(A1762T/G1764A)突变可终止或抑制HBeAg的合成,存在此变异的患者在Peg-IFNα治疗结束后,容易复发或转变为HBeAg阴性CHB患者。尽管当前指南对Peg-IFNα联合NAs治疗CHB持谨慎态度,但是对于存在PC/BCP区相关变异患者能否受益于联合治疗至今鲜有报道。因此,该研究通过分析Peg-IFNα-2b单药或联合阿德福韦(adefovir,ADV)治疗PC/BCP区相关突变的HBeAg阳性CHB患者的疗效情况,为当前CHB患者个体化治疗提供新的依据及指导方向。
1 材料与方法
1.1病例资料选择2012年6月~2014年7月安徽医科大学第一附属医院感染科收治的乙肝e抗原(HBeAg)阳性初治CHB患者,共89例。入选标准按照《慢性乙型肝炎防治指南》[6]:① 乙肝表面抗原(HBsAg)和HBeAg两项均阳性并且>6个月。② 乙肝病毒(HBV) DNA ≥20 000 IU/ml;2×正常值上限(upper limits of the normal,ULN)≤谷丙转氨酶(alanine aminotransferase,ALT)≤10×ULN;③ 血清总胆红素<2×ULN; ④ 排除其他病毒感染、精神病史、自身免疫疾病、失代偿肝硬化等。本试验获得安徽医科大学第一附属医院医学伦理委员会批准,并与患者签署知情同意书。
1.2实验方法
1.2.1分组 89例CHB初治患者随机接受单药治疗(单用Peg-IFNα-2b)或联合治疗(Peg-IFNα-2b+ ADV)。单药组给予Peg-IFNα-2b (爱尔兰先灵葆雅公司) 1.5 μg/kg,1次/周(皮下注射);联合组给予Peg-IFNα-2b 1.5 μg/kg,1次/周(皮下注射),并口服ADV(10 mg/d)。
1.2.2实验室检测 89例患者基线时血清标本均提取HBV DNA模版、PCR扩增和测序分析突变情况;对于测序失败的20例样本进行PCR产物TA克隆,每个样本挑取16个克隆测序分析突变有无,TA克隆与测序部分由深圳华大基因公司(BGI)完成。HBV DNA定量采用Roche Cobas TaqMan48(美国Roche公司),检查下限为20 IU/ml,检测上限为1.70E+8 IU/ml。HBsAg、HBeAg和HbeAb检测均采用Roche Diagnostics(美国Roche公司),HBsAg检查下限为0.05 IU/ml,HBeAg<1 COI为阴性,>1 COI为阳性;HBeAb<1 COI为阳性,>1 COI为阴性。HBV基因型送检上海之江生物有限公司。
1.2.3治疗应答及突变的定义 前12周每位患者每4周随访1次,12周之后每位患者每12周随访1次,直至72周结束。HBeAg血清转换:出现HBeAg阴性(<1 COI)、HbeAb阳性(<1 COI)。联合应答:HBeAg血清转换,并且HBV DNA<2 000 IU/ml,并伴有ALT低于正常值上限。关于突变:PC为只存在PC区G1896A位点突变,BCP为只存在BCP区A1762T/G1764A位点的双突变,Both为PC和BCP两种突变均存在,见表1。
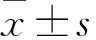
2 结果
2.1患者基线特征89例CHB初治患者中,73例(82%)为PC/BCP区突变(非野生型,Non-WT)患者,16例(18%)为野生型(WT)患者。Non-WT中33例患者接受单药治疗(单用Peg-IFNα-2b),40例患者接受联合治疗(Peg-IFNα-2b+ADV)。WT中11例患者接受单药治疗,5例患者接受联合治疗。WT和Non-WT患者中的单药组和联合组分别在年龄、性别、ALT、HBV DNA、HBeAg、HBsAg、基因型构成比、PC/BCP突变构成比方面差异无统计学意义(P>0.05),见表1。
2.2随访结束时应答情况Non-WT患者(n=73)中,单药组与联合组患者在48周HBeAg血清转换率、联合应答率上差异无统计学意义(P>0.05);72周随访结束时,两组患者在HBeAg血清转换率上差异无统计学意义(P=0.519),但在联合应答率上差异有统计学意义(P=0.028),见表2;单药组48周获得联合应答的患者3例在72周时全部复发(HBV DNA>2 000 IU/ml);联合组48周联合应答的患者8例在72周保持联合应答仍有6例(75%)。联合组72周时出现HBsAg清除患者2例(5 %),而单药组未发现HBsAg清除患者。对于WT患者(n=16),不管在48周或72周时,单药组和联合组的HBeAg血清转换率和联合应答率上差异均无统计学意义(P>0.05),见表2。
2.3Non-WT患者中单药组和联合组治疗结束和随访结束时ALT、HBVDNA、HBsAg和HBeAg水平的比较治疗结束时,联合组ALT、HBV DNA 和HBeAg均值水平均低于单药组,差异有统计学意义(P<0.05);但是随访结束时,联合组较单药组在ALT、HBV DNA、HBsAg和HBeAg水平上差异无统计学意义(P>0.05)。见表3。
3 讨论
HBV虽然是一种DNA病毒,但是它的复制却经过RNA中间产物介导,由于DNA聚合酶缺乏校正功能和病毒高复制率双重因素,HBV在复制过程中容易产生突变[7]。文献[4-5,8]报道,HBV PC/BCP区相关变异可以对Peg-IFNα的疗效产生影响,其中以G1896A和A1762T/G1764A突变位点最为重要。存在相应突变的HBeAg阳性CHB患者虽然在治疗结束后可以获得较高的HBeAg血清转换率,但是多数患者随访后会发生病毒学的反弹,最终可能发展为HBeAg阴性CHB患者[5]。这对CHB患者的个体化治疗提出了挑战。

表1 患者基线特征

表2 Non-WT和WT患者48周和72周治疗应答情况[n(%)]

表3 Non-WT患者中单药组与联合组血清标志物比较
改变治疗策略,最大限度地提高CHB患者治疗结束后的持续应答率是当前国内外众多专家共识。本研究随访结束时联合治疗组和单药组均获得了较高的HBeAg血清转换率(37%vs30%),但在联合应答率上联合治疗组明显高于单药组(35%vs12%)。这说明PC/BCP区突变的HBeAg阳性CHB患者不管是单药治疗还是联合治疗均较易出现HBeAg的血清学转换,但联合治疗可以明显降低随访后的病毒学反弹率。其中的机制可能与ADV降低病毒载量,增强机体对Peg-IFNα-2b应答存在一定关系[9]。在机体免疫清除HBV过程中需要固有免疫和适应性免疫的协调配合,而研究[10]表明HBV具有潜在抑制固有免疫能力,并且高水平的HBsAg和HBeAg与T细胞的耗竭存在关系。Peg-IFNa-2b可以通过促进CD56bright(高表达CD56)NK细胞的增殖及IL-15的表达,上调TNF相关凋亡诱导配体(TRAIL)和IFN-γ,引起感染肝细胞的凋亡从而降低病毒载量及HBsAg水平[11]。但是Peg-IFNa-2b对CD8+T细胞的作用与NK细胞存在存在差异,研究[12]报道在Peg-IFNa-2b治疗过程中可以导致CD8+T细胞的耗竭,此外HBV-特异性CD8+T细胞始终处于低频状态,未能观察到其功能的恢复。相反,核苷类似物治疗过程中可以观察到CD8+T细胞的恢复,但未见对NK细胞功能有恢复作用[12],其中的作用机制仍未完全清除,可能与直接抑制病毒复制,促进CD4+Th1细胞分化进而促进CD8+T细胞的分化激活有关。存在PC/BCP突变的CHB患者在Peg-IFNα-2b治疗过程中,HBV DNA载量降低较慢常保持高水平,这可能限制了CD8+T细胞恢复,从而限制了机体免疫对Peg-IFNa-2b的疗效;而在治疗过程中联合ADV可明显降低病毒载量,从而帮助恢复CD8+T功能。正是两者不同而又互补的免疫修复机制,为联合治疗控制HBV感染提供了依据。本研究突变组中2例(5%)HBsAg清除患者均接受联合治疗,作为抗病毒治疗的理想终点,Peg-IFNα-2b联合ADV对存在PC/BCP区突变的HBeAg阳性CHB患者的HBsAg清除率依然较低,与以往的干扰素单药治疗类似。
Peg-IFNα-2b联合ADV可以提高联合应答率,相关结论是否可以推广到Peg-IFNα联合拉米夫定、恩替卡韦或替诺福韦仍不清楚,这有待进一步的研究与验证。关于Peg-IFNα联合NAs的时机,各国学者对CHB患者也进行了诸多探索:序贯治疗(先接受Peg-IFNα或NAs一段时间治疗,再转变为另一种药物)、添加治疗(Peg-IFNα或NAs治疗过程中添加另一种药物)或本试验的双重治疗(Peg-IFNα与NAs同时联合)。是否每种治疗策略对PC/BCP区突变的HBeAg阳性CHB患者疗效均相同,仍有待更大的前瞻性多中心研究。
综上所述,本研究显示Peg-IFNα-2b联合ADV,可明显提高PC/BCP区突变的HBeAg阳性CHB患者随访后联合应答率。对于临床实验室检测存在PC/BCP区突变的CHB患者,建议在常规Peg-IFNα-2b治疗方案上增加ADV进行治疗。

