突触和自噬功能受损参与七氟烷引起的APP/PS1小鼠认知障碍
耿鹏程,张继千,谭其莲,程 丹,戴 伟,刘学胜
阿尔茨海默病(Alzheimer’s disease,AD)是老年痴呆的主要病因,以进行性认知功能减退为主要临床特征[1]。研究[2]表明自噬功能受损参与AD病理过程,AD大脑中突触功能受损可能是AD学习记忆障碍的原因[3]。术后认知功能障碍(postoperative cognitive dysfunction,POCD)是一种常见的手术麻醉后的中枢神经系统并发症,主要表现为焦虑、精神错乱以及学习记忆功能下降等[4]。POCD与AD都有学习记忆功能障,并且大量实验室研究[5]表明麻醉后大脑中AD病理标志物β淀粉样蛋白(β amyloid,Aβ)产生增多;已经出现AD病理变化的大脑在麻醉后会出现怎样的变化,通过前期研究[6]显示AD模型小鼠吸入七氟烷后的确出现认知功能进一步减退,但是其具体机制还不清楚,该实验主要探讨七氟烷麻醉后AD小鼠海马中Aβ表达、突触和自噬功能的变化。
1 材料与方法
1.1材料
1.1.1实验动物 32只、6~7月龄、雄性、SPF级、APPswe/PSEN1dE9(APP/PS1)双转基因AD模型小鼠购自南京大学动物模式中心,体质量35~43(39.6±2.5)g。所有小鼠饲养在温度、湿度、灯光受调控的房间,食物和水充足。
1.1.2主要试剂及来源 Aβ抗体(免疫印迹1 ∶1 000,免疫荧光1 ∶100,ab11132)、p62抗体(1 ∶1 000,ab56416)、Alexa Fluor 568(1 ∶500,ab175473) 和Alexa Fluor 488(1 ∶500,ab150077)购自英国Abcam公司;突触后密度蛋白95(postsynaptic density protein 95, PSD95)抗体(1 ∶1 000,3409S)购自美国CST公司; LC-3抗体(荧光1 ∶2 000,免疫印迹1 ∶200,NB100-2220)购自美国Novus Biologicals公司;溶酶体相关膜蛋白1(lysosomal associated membrane protein 1,LAMP1)(1 ∶100,sc20011)购自美国Santa Cruz公司;BCA试剂盒(P0010S)购自上海碧云天生物公司。
1.1.3主要仪器 Olympus BX53荧光显微镜(奥林巴斯公司);Amersham Imager 600凝胶成像仪(美国通用公司);Allegra64R离心机(美国贝克曼库尔特公司);Zeiss LSM710共聚焦显微镜(德国Zeiss公司);Morris水迷宫系统(上海吉量软件科技公司)。
1.2方法
1.2.1实验分组及麻醉药物处理 APP/PS1小鼠随机分为两组:对照组(n=16)和七氟烷组(n=16)。小鼠置于20 cm×8 cm×8 cm透明自制麻醉箱内,盒两端各有一小孔,一端接七氟烷麻醉挥发罐输入60%空氧混合气(60%氧气、40%氮气)和七氟烷(日本Maruishi Pharmaceutica公司),另一端接麻醉气体监测仪(0hmeda,美国Detax公司)监测麻醉气体和氧气浓度。七氟烷组吸入3%七氟烷4 h,载气为60%空氧混合气,流量3 L/min,结束后载气洗脱15 min。麻醉过程中,麻醉箱外包裹加热毯,温度探头检测小鼠直肠温度,维持温度37~38 ℃,维持小鼠自主呼吸。对照组置于麻醉箱内,不吸入七氟烷,只吸入60%空氧混合气4 h,流量为3 L/min。
1.2.2Morris水迷宫实验 吸人七氟烷或氧气后24 h,各组随机取10只小鼠,进行水迷宫实验。Morris水迷宫为圆形水池直径为120 cm,高60 cm,平台高度50 cm,直径10 cm,平台低于水面1 cm,池壁放置参照物,平台屏蔽剂为白色二氧化钛。水槽等分为4个象限,水槽中心上方放置摄像头计时跟踪小鼠游泳轨迹。实验期间参照物保持不变,保持安静,水温20~22 ℃。水迷宫实验共需5 d,第1~4 天为训练期,第5天为空间探索实验。训练期每只小鼠进行水迷宫训练,4次/d,每次间隔10 min让小鼠休息,记录小鼠分别从4个象限找到平台所需的时间。若90 s内小鼠未找到平台,引导小鼠找到平台,时间计为90 s。取4次找到平台所需时间的平均值作为潜伏期(escape latency)。空间探索实验:去除平台,将小鼠从平台对侧象限面向池壁放入水中,记录90 s内小鼠在原平台所在象限的停留时间(target quadrant time)和穿台次数(platform crossing times),计算平台所在原象限停留时间百分比(目标象限停留时间÷90×100%)。
1.2.3Western blot 吸入氧气或者七氟烷后24 h,每组5只小鼠采用腹腔注射戊巴比妥钠100 mg/kg麻醉后断头取脑,冰上分离出海马组织,置于冷冻管中放入液氮速冻保存。将取出的海马加入裂解液中裂解,冰上玻璃匀浆器匀浆1 min,离心后取上清液,分装,加入样品缓冲液并煮沸10 min,通过BCA法定量。使用聚丙烯酰胺凝胶电泳分离样品蛋白,将电泳后的凝胶与NC膜叠在一起,在350 mA条件下转移至膜上,将膜置于5%脱脂牛奶中封闭1 h,之后加入一抗4 ℃过夜,次日在摇床上用TBST洗膜3次,之后加入二抗37 ℃孵育1 h,TBST洗膜3次后,将ECL显色液加入膜上并在凝胶成像仪下显影。
1.2.4免疫荧光 经左心室注入PBS缓冲液,剪开右心耳使血液流出,灌注PBS 30 ml后注入4%多聚甲醛,随后完整取出大脑,放入4%多聚甲醛中固定4 h,之后30%蔗糖脱水过夜,在冰冻切片机(SLEE,德国)下切取8 μm冠状面大脑切片,PBS浸洗10 min后再用0.1%TritonX-100透膜7 min,TBST洗3次后,用2%BSA(牛血清蛋白)封闭1 h,加入一抗4 ℃条件下孵育过夜,次日TBST洗3次,后加入二抗,在37 ℃孵育1 h,TBST洗3次后使用DAPI染核7 min,TBST洗3次后,80%甘油封片,通过共聚焦显微镜观察。
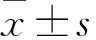
2 结果
2.1七氟烷影响APP/PS1小鼠认知能力APP/PS1小鼠进行连续5 d水迷宫实验,前4天为训练期,经过重复测量数据的双因素方差分析,对照组和七氟烷组的平均逃避潜伏期在组间(对照组vs七氟烷组)和时间上的交互作用差异具有统计学意义(F=6.84,P<0.01),事后检验表明训练第3天和第4天平均逃避潜伏期差异具有统计学意义(第3天:44.9 s±10.1 svs69.7 s±11.5 s,P<0.001;第4天:38.2 s±11.9 svs60.8 s±13.7 s,P<0.001),七氟烷组表现为更长的潜伏期;见图1A。两组小鼠在游泳速度上差异无统计学意义(0.167 m/s±0.035 m/svs0.163 m/s±0.036 m/s,P>0.05),排除运动能力对实验的影响,见图1B。第5天为探索实验,对照组和七氟烷组小鼠目标象限停留时间百分比(25.8%±5.93%vs17.8±4.75%,P<0.05)和穿台次数(1.8±1.03次vs0.8±0.63次,P<0.05)差异均有统计学意义,七氟烷组目标象限停留时间和穿台次数更少,见图1C、1D。
2.2七氟烷影响APP/PS1小鼠海马PSD95表达PSD95是维持突触后部功能的一个重要的蛋白,Western blot结果表明对照组与七氟烷组APP/PS1小鼠海马中PSD95水平差异具有统计学意义(P<0.05),对照组小鼠海马中PSD95明显高于七氟烷组,见图2。
2.3七氟烷影响APP/PS1小鼠海马细胞内Aβ表达淀粉样蛋白前体通过β和γ淀粉酶剪切形成大量Aβ沉积是AD病理特征之一,Western blot表明对照组和七氟烷组APP/PS1小鼠海马中Aβ水平差异具有统计学意义(P<0.01),七氟烷明显增加Aβ水平,见图3。
2.4七氟烷对APP/PS1小鼠海马自噬水平影响微管相关蛋白轻链3(microtubule related protein light chain 3,LC3)是自噬体的标志物,当自噬过程被激活,LC3Ⅰ被剪切行成分子量较小的LC3Ⅱ,并且聚集到自噬体膜表面,进而包裹待降解物形成完整的自噬体。Western blot结果表明,对照组和七氟烷组APP/PS1小鼠海马中LC3Ⅱ蛋白水平(P<0.01)差异具有统计学意义,七氟烷组LC3Ⅱ水平明显增多,见图4。
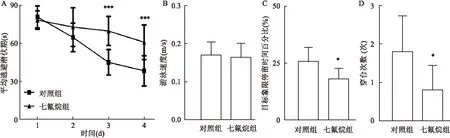
图1 3%七氟烷麻醉4 h对APP/PS1小鼠空间学习记忆能力影响
A:两组小鼠连续4 d训练期平均逃避潜伏期;B:两组小鼠游泳速度;C:第5天的探索实验中两组小鼠在90 s内目标象限停留时间百分比;D:探索实验中两组小鼠90 s内穿过原平台所在区域次数;与对照组比较:*P<0.05,***P<0.001

图2 60%氧气或3%七氟烷麻醉4 h后APP/PS1小鼠海马中PSD95表达
A:PSD95和β-actin的免疫印迹条带;B:PSD95光密度值标准化后的统计结果;与对照组比较:*P<0.05
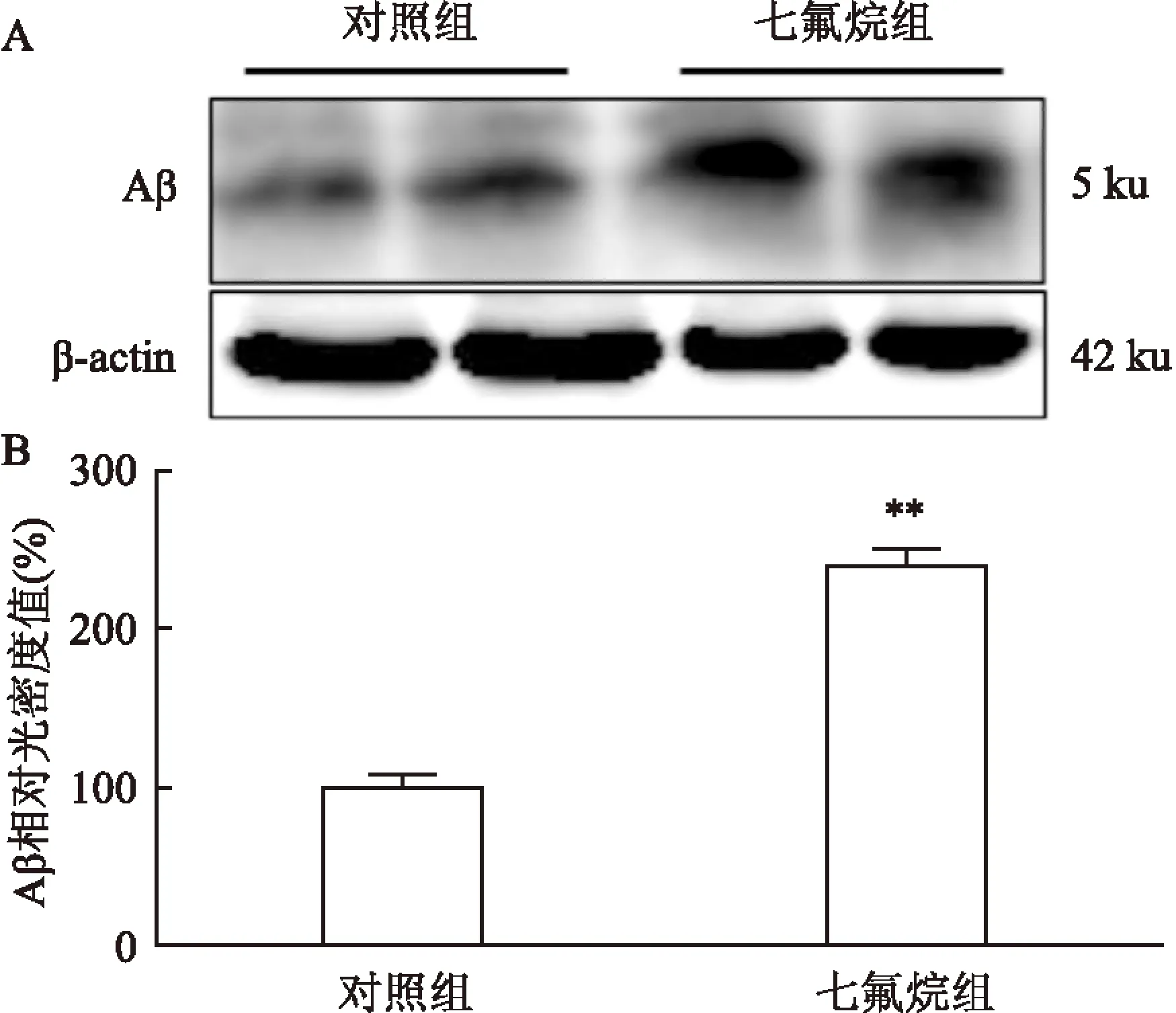
图3 两组小鼠海马中Aβ表达
A: Aβ和β-actin免疫印迹条带;B:Aβ光密度值标准化后的统计结果;与对照组比较:**P<0.01
图4 两组小鼠海马中LC3表达水平
A: LC3Ⅱ、LC3Ⅰ及β-actin免疫印迹条带;B:LC3Ⅱ光密度值标准化后的统计结果;与对照组比较:**P<0.01
2.5七氟烷影响溶酶体功能p62是自噬的的底物蛋白,LAMP1是溶酶体膜的标志蛋白,通过免疫荧光染色及共聚焦显微镜观察Aβ和LAMP1的位置,结果显示两种蛋白存在共定位(橙色荧光),说明Aβ存在溶酶体中,见图5A。通过Western blot检测对照组和七氟烷组小鼠海马中p62水平,两组差异具有统计学意义(P<0.05),七氟烷组p62明显增多,见图5B、5C。

图5 Aβ与溶酶体共定位情况及两组小鼠海马中p62表达
A:共聚焦显微镜观察Aβ和溶酶体共定位 ×400;蓝色荧光:细胞核;红色:Aβ;绿色:LAMP1;橙色:Aβ和LAMP1共定位(白色箭头);B: p62及β-actin的免疫印迹条带;C: p62光密度值标准化后的统计结果;与对照组比较:*P<0.05
3 讨论
全身麻醉对大脑功能的影响一直是麻醉领域研究的热点,由于患者的年龄、合并症、手术类型、围术期用药以及对POCD诊断标准的不同等等,这些混淆因素都使得全身麻醉药物与POCD的关联充满了不确定性。动物研究[7]表明存在神经退行性疾病的大脑更容易受到麻醉药物的影响。七氟烷是目前临床上最常用的吸入麻醉药之一,有研究[8]表明POCD可能与临床麻醉中应用七氟烷有关。APP/PS1小鼠是一种APP和PS1突变基因共同表达的AD模型小鼠,在6~7月时大脑开始出现Aβ斑块沉积,7月出现轻度认知功能障碍,可用来模拟AD的发病过程[9],该实验证明了3%七氟烷全身麻醉可以加重APP/PS1小鼠认知功能障碍,说明存在AD风险的患者在七氟烷全麻后可能会加重或者加速AD的进程。
突触在学习记忆的形过程成中具有重要作用,PSD95是神经元的支架蛋白,存在多个结构域,参与了细胞内蛋白和蛋白之间的连接,PSD的厚度以及相变可能是突触可塑性形成的基础[10]。早在1998年就有研究[11]表明突变的PSD95可以损伤小鼠LTP和学习记忆能力。该研究表明七氟烷引起APP/PS1小鼠PSD95减少,可能是其认知损伤的原因。在AD发展过程中,突触功能受损与认知功能障碍形成密切相关,老年斑的主要构成成分Aβ可能具有突触毒性,AD患者和AD模型动物大脑中越靠近老年斑的突触丢失越严重[12]。结合上述结果七氟烷引起海马中Aβ增多可能是PSD95减少的原因。
自噬是真核细胞中非常重要的生物学过程,与人类的生理学和病理学过程密切相关,正常的自噬功能通过消化降解错误折叠蛋白、损坏的细胞器及病原等物质维持细胞功能以及抵御不利因素的伤害。胞质中存在的均匀分布的LC3Ⅰ,在自噬体起始复合物开始形成后与磷脂酰乙醇胺(PE)偶联形成LC3Ⅱ,泛素化的蛋白通过LC3Ⅱ结合到自噬体上使自噬体延长, LC3Ⅱ蛋白的积累变化是反映自噬流的常用方法[13]。p62可以作为自噬的底物,p62蛋白通过LC3结合基团连接LC3,并随着自噬体在自噬溶酶体中降解,抑制自噬功能引起p62增多[14]。该实验显示七氟烷麻醉的APP/PS1小鼠海马中LC3和p62蛋白水平相比氧气组小鼠明显增多,说明七氟烷使自噬受损。在AD大脑中自噬功能受损导致Aβ降解受阻,细胞内Aβ增多[2]。电针刺改善AD大脑中自噬功能有助于Aβ的降解,而阻断自噬则削弱其作用[15]。3%七氟烷损伤自噬功能可能是七氟烷引起Aβ增多的原因。
综上所述,该实验结果显示3%七氟烷引起APP/PS1小鼠空间学习记忆障碍,同时引起细胞内Aβ升高、自噬和突触功能受损;推测自噬受损引起Aβ增多,进而减少PSD95水平损伤突触功能可能是七氟烷引起APP/PS1小鼠记忆损伤的分子机制,接下来需要使用一些特异性阻断剂或激活剂研究这些分子之间的关联。

