长链非编码RNA在胃癌中作用的研究进展
高 敏,刘文博 综述 顾康生 审校
据全国肿瘤登记中心最新数据估计[1],2015年中国胃癌(gastric cancer, GC)新发病例约67.9万例,胃癌死亡病例约49.8万例,严重危害我国人民健康。手术切除是目前治疗胃癌主要手段之一,然而由于胃癌早期缺乏特异性,加之确诊胃癌的胃镜检查为有创检查,多数患者确诊时已处于进展期,从而失去了手术治愈的最佳时机,除手术以外,术后化疗是治疗胃癌的主要手段。化疗效果成为改善胃癌患者预后的关键因素,然而,广泛见之于临床的化疗耐受性是抗肿瘤化疗无效的最常见原因,更为严峻的是,缺乏有效预测胃癌对于化疗药物耐受性的方法,致使患者接受盲目和过度化疗再所难免[2]。因此,在阐明胃癌耐药形成机制的前提下,发展能有效预期化疗耐受性的分子标记,是成功进行化疗的必要前提。因而,寻找与胃癌发生发展、化疗疗效及预后相关的生物标志物变得非常有必要。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200 nt的RNA分子,不具有编码蛋白质的功能。起初lncRNA一度被认为是基因组中的“垃圾”,转录的“噪音”[3],但是随着高通量测序等生物信息学技术的发展,发现lncRNA在包括肿瘤在内的许多疾病中发挥着重要的生物学功能,其转录本有可能作为信号分子、诱饵分子、引导分子和支架分子四种模式发挥作用[4]。根据lncRNA基因在基因组上的位置可分为五类:基因间lncRNA(long intergenic lncRNA,lincRNA)、内含子区lncRNA、正义lncRNA、反义lncRNA、双向lncRNA[5]。目前研究[3, 6]显示,lncRNA主要在表观遗传水平、转录水平和转录后水平三个层面调控胚胎发育、细胞增殖、转移和分化等各种生命活动。近年来,有研究[7-9]证实,lncRNA与肿瘤发生发展、化疗敏感性及预后等均具有相关性。尽管关于lncRNA的研究不断深入,但对于绝大多数lncRNA的功能仍然知之甚少,本文就与胃癌相关的lncRNA研究现状做一综述,以期为胃癌的诊疗及预后判断的研究提供参考。
1 lncRNA对胃癌细胞增殖、凋亡的影响
通常,人体特定组织器官中的细胞类型和数目是相对恒定的,这种恒定性主要取决于贯穿生命过程中的细胞增殖、分化以及凋亡之间的动态平衡,而这一动态平衡一旦被打破,就会导致包括恶性肿瘤在内的疾病的发生、发展。近些年,随着对lncRNA的深入研究,结果显示一些lncRNA的异常表达能够干扰胃癌细胞凋亡,促进其无限增殖,从而导致胃癌的发生。
Yang et al[10]通过qRT-PCR发现H19在GC组织和细胞中过表达,细胞实验证实H19的异位表达促进AGS细胞增殖,而H19 siRNA促成AGS细胞凋亡,可能与H19导致部分p53失活所致。最近,Yan et al[11]实验证明H19和miR-675在GC组织和细胞系中相对表达增加,且其过表达促进细胞增殖并抑制细胞凋亡,而敲低H19和miR-675则可抑制细胞增殖而促进细胞凋亡。进一步通过荧光素酶报告基因验证miR-675的直接靶标为FADD,并通过H19/miR-675轴抑制FADD的表达,从而抑制胱天蛋白酶裂解(包括胱天蛋白酶8和3)。另外,研究者通过裸鼠移植瘤实验表明H19/miR-675轴在体内亦发挥相同的作用[11]。因此,H19可能通过H19/miR-675/FADD/caspase8/caspase3轴发挥作用,从而有望成为GC的潜在治疗靶标。Hu et al[12]研究发现结直肠肿瘤差别表达基因(colorectal neoplasia differentially expression, CRNDE)在GC组织和细胞中表达上调,MTT测定显示CRNDE过表达促进细胞增殖,敲低CRNDE则抑制细胞增殖,探索其机制发现CRNDE可能通过竞争性结合miR-145促进GC细胞增殖。另外,其研究还显示通过上调CRNDE表达,E2F3表达显著增加,而shCRNDE显著降低E2F3表达。因此,CRNDE可能通过CRNDE/miR-145/E2F3信号通路促进GC的发生。Huang et al[13]研究表明linc00673在GC中显著上调,敲除linc00673抑制细胞增殖和侵袭并诱导细胞凋亡,而linc00673过表达具有相反的作用。研究者通过荧光素酶报告基因和ChIP测定证实SP1可以直接结合linc00673启动子区域的SP1结合位点并激活其转录,而SP1激活的linc00673则发挥促进GC发生发展的致癌功能。另外通过linc00673还可能作为组蛋白去甲基化酶(lysine specific demethylase,LSD1)和组蛋白甲基转移酶(enhancer of zeste homolog 2,EZH2)的支架抑制锌指样转录因子2(kruppel-like factor 2,KLF2)和大肿瘤抑制因子2(large tumor suppressor kinase 2,LATS2)表达,进一步促进GC的发生。
当然,亦有一些lncRNA可以干扰GC细胞增殖,促进其凋亡。Zhang et al[14]研究发现linc00628通过抑制癌细胞的增殖、迁移和集落形成,在GC中作为抑癌基因发挥作用,并且通过小鼠异种移植模型,发现linc00628还可以抑制体内肿瘤生长。进一步研究[14]证实linc00628主要位于细胞核中并与EZH2相互作用,通过调节Lys27位点三甲基化组蛋白H3(histone H3 methylated Lys27,H3K27me3)水平调节基因表达,同时,linc00628的过表达也可以诱导GC细胞中的G0/G1停滞,从而发挥抑癌基因的作用。
2 lncRNA对胃癌细胞转移的作用
转移是恶性肿瘤最具特征性的表现,也是绝大多数肿瘤患者致死因素,肿瘤转移是多因素、多基因相互协调作用的多阶段过程。近年来,研究者们探索了lncRNA在胃癌转移过程中的调控作用,以期未来人类能够在阻断肿瘤转移上取得突破性进展。
Liu et al[15]通过功能获得和缺失实验证明了lncRNA XLOC_010235(XLOC)的过表达可以显著影响多种上皮细胞间质转化(epithelial-mesenchymal transition,EMT)相关分子(包括E-钙黏蛋白、N-钙黏蛋白和波形蛋白等)的表达水平而促进GC转移。进一步研究其转移机制,显示基因Snail1的mRNA水平在胃癌组织高表达,且Snail1表达与胃癌组织中XLOC转录水平呈正相关性,通过Western blot分析验证了Snail1在蛋白质水平上亦呈正相关性。所以,Snail1在mRNA和蛋白水平上均受到XLOC的正调控。因此XLOC与Snail1相互作用介导EMT促进GC细胞转移。Du et al[16]研究表明,TRERNA1在GC组织中显著上调,与GC淋巴结转移相关,经体外和体内实验发现,TRERNA1促进GC细胞侵袭转移。机制探索显示,TRERNA1通过招募到EZH2来表征性调节CDH1基因的表达,并通过各种分子机制促进EMT,从而在GC进展和转移中发挥作用。Yu et al[17]研究发现,linc00261在胃癌组织中的表达水平显著下调,其表达水平与肿瘤进展及临床分期呈负相关,linc00261在GC中主要通过降低Slug蛋白的稳定性和抑制EMT来发挥抑制GC转移的作用,其低表达提示GC患者预后不良。Qi et al[18]研究证明lncRNA MALAT1招募EZH2抑制PCDH10并促进胃癌转移。近期,有研究[19]显示MALAT1 在血管生成过程中也发挥重要作用,利用150例GC标本的原位杂交和CD31/高碘酸-希夫双重染色显示MALAT1表达与血管生成拟态(vasculogenic mimicry,VM)和内皮细胞的密度密切相关。敲低MALAT1显著降低GC细胞迁移、侵袭、致瘤性、转移和VM,同时限制人脐静脉内皮细胞(HUVEC)血管生成和增加血管通透性。此外,MALAT1可以通过VE-钙黏蛋白/β-连环蛋白复合物和ERK/MMP和FAK/paxillin信号通路促进VM和血管生成来促进GC中的致瘤性和转移,因此,高MALAT1水平可以作为GC远处转移的潜在生物标志物。
3 lncRNA对胃癌化疗耐药的影响
化疗是大多数晚期肿瘤患者最重要的治疗手段,然而化疗耐药的产生往往是治疗恶性肿瘤最大的障碍,因此,研究化疗耐药的机制以及如何克服化疗耐药性是肿瘤治疗中亟待解决的难题。当然,lncRNA作为当前科学界的明星分子,其在胃癌中的异常表达亦与化疗耐药具有显著的相关性。
Shang et al[20]研究发现,尿路上皮癌胚抗原1(urothelial carcinoma antigen,UCA1)在胃癌组织和细胞中高度表达,其高表达水平与胃癌的恶性病理特征呈正相关性,沉默UCA1显著抑制胃癌BGC-823和SGC7901细胞的增殖。此外,沉默UCA1可抑制胃癌阿霉素(ADR)耐药细胞(SGC7901/ADR)对阿霉素的耐药性。进一步探索其机制显示,沉默UCA1可诱导SGC7901/ADR细胞的晚期凋亡,上调裂解蛋白表达以及抑制抗凋亡蛋白Bcl-2表达,因此,UCA1作为致癌基因可调控GC细胞恶性增殖以及可能通过凋亡途径介导阿霉素耐药性。Lan et al[21]研究发现在INK4位点的反义非编码RNA(antisense noncoding RNA in the INK4 locus,ANRIL)在顺铂(DDP)和5-氟尿嘧啶(5-FU)耐药患者的GC组织以及GC细胞系中高度表达。另外,用ANRIL siRNA转染并用DDP和5-FU处理的BGC823/DDP和BGC823/5-FU细胞分别显示出存活率降低、侵袭能力减弱以及凋亡性肿瘤细胞的比例增多。通过测量BGC823/DDP和BGC823/5-FU细胞对DDP和5-FU的IC50值,评估敲低ANRIL对多药耐药(multidrug resistance,MDR)的影响,结果显示,沉默ANRIL降低了GC细胞的IC50值。此外,qRT-PCR和Western blot显示,ANRIL基因敲低降低MDR1和MRP1(均为MDR相关基因)的表达,回归分析显示,ANRIL的表达与MDR1和MRP1的表达呈正相关性,总而言之,GC细胞中ANRIL的敲低可抑制MDR的发生,为GC治疗逆转MDR提供了有效的靶标。Shang et al[22]研究证实癌症易感候选基因9(cancer susceptibility candidate 9,CASC9)在GC细胞及组织中高表达,且与肿瘤大小、浸润深度、淋巴结转移等均具有较好的相关性。此外,研究[22]通过MTT法测定显示紫杉醇和阿霉素在耐药细胞系BGC823/DR和SGC7901/DR细胞的IC50值较其在BGC823和SGC7901细胞中的IC50值显著增高,表明CASC9过表达可能参与GC细胞的化学耐药。敲低CASC9抑制耐药GC细胞的生长和侵袭以及化学耐药性,并能恢复GC细胞对紫杉醇和阿霉素的化疗敏感性。通过Western blot实验测定BGC823/DR和SGC7901/DR细胞在CASC9敲除前后的MDR1表达水平,表明CASC9的敲低与MDR表达呈正相关性。总之,lncRNA CASC9在GC中过表达,可以促进GC细胞增殖及紫杉醇和阿霉素的化疗耐药,为胃癌治疗提供新靶点。
4 血液及胃液中lncRNA在胃癌中作用
由于GC的诊断金标准为胃镜下取材活检,切取组织时为侵入性手段,增加了患者的痛苦体验,不利于多次取材监测患者的肿瘤动态变化。因此,寻找可以代替GC组织活检,并具有高度灵敏性和特异性的肿瘤标志物十分有意义,而血液、胃液中稳定存在的lncRNA,有望成为GC诊断及肿瘤动态监测的分子标志物。
Zhou et al[23]在70对GC患者和正常对照者中验证了lncRNA H19表达水平在GC患者血浆中显着升高,进一步通过ROC曲线分析显示,ROC曲线下面积(AUC)为0.838,因此,H19高表达有助于GC的早期诊断。此外,术后样本中H19的血浆水平显着低于术前样本。所以,血浆H19可以作为GC诊断和监测术后肿瘤动态的潜在生物标志物。Jin et al[24]利用qRT-PCR用于大规模分析GC患者血清lncRNA HULC表达,可靠地检测到循环HULC,并显示其在GC患者中上调。血清HULC表达水平与肿瘤大小、淋巴结转移、远处转移以及幽门螺杆菌感染相关。HULC ROC的AUC达0.888,高于CEA(0.694)和CA72-4(0.514)。并通过随访检测和Kaplan-Meier曲线分析显示HULC是GC预后的良好预测指标。Shao et al[25]证实相较于癌旁组织,lncRNA线粒体RNA处理核糖核酸内切酶RNA组分(RNA component of mitochondrial RNA processing endoribonuclease, RMRP)表达水平在GC组织中显著降低,与Borrmann分型、侵袭深度、淋巴结转移、周围神经侵袭以及CEA和CA199表达密切相关。通过克隆测序技术证实血浆、胃液中也存在RMRP,且表达相对稳定,经ROC曲线分析血浆、胃液RMRP作为GC筛查标志物具有较高的灵敏度和特异性。进一步研究其机制显示,RMRP可充当miR-206海绵,通过调控下游靶基因Cyclin D2表达发挥其调控细胞周期的效应,在GC中发挥抑癌作用,因此,血浆及胃液RMRP有望成为胃癌筛查和预后的潜在标志物。
5 lncRNA对胃癌预后的影响
由于lncRNA在GC细胞增殖与凋亡、转移以及化疗耐药中均发挥了重要作用,因而在某种程度上,lncRNA对GC的预后也产生一定的影响,因此,通过干预GC中lncRNA的表达来改善患者的预后,提高生存率,有望成为GC治疗的一种新策略。
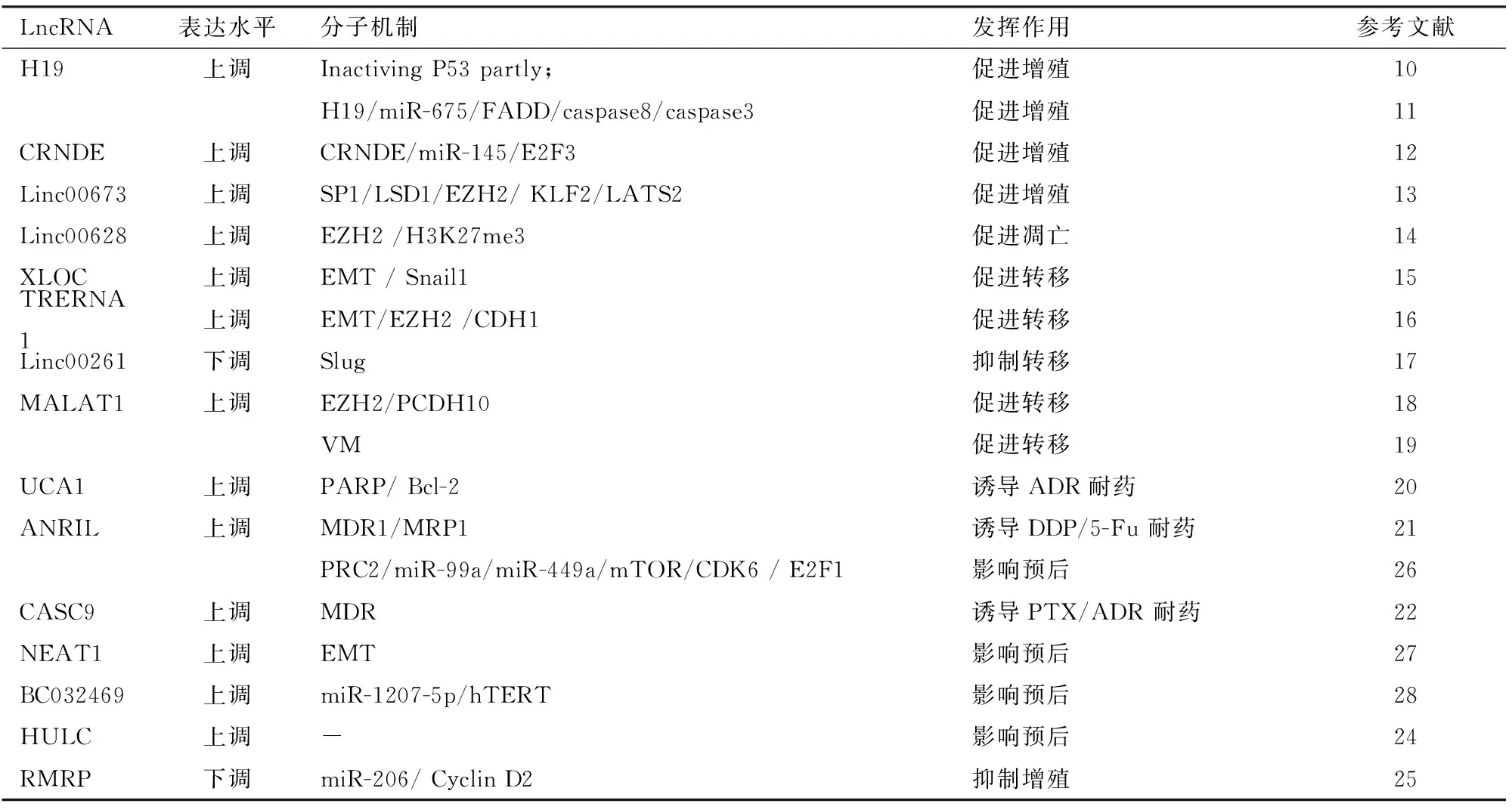
表1 长链非编码RNA在胃癌中的作用
Zhang et al[26]研究显示,与相应非肿瘤组织而言,ANRIL在GC组织中表达上调,与肿瘤大小和TNM分期相关,可作为GC总生存期的独立预后因子,而且ANRIL可以在体外和体内调节细胞生长。此外,研究者证明ANRIL可以通过结合PRC2表观遗传沉默miR-99a/miR-449a,从而调节哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和CDK6/E2F1通路,这在一定程度上可以解释ANRIL介导细胞生长调节。通过ANRIL沉默miR-449a释放E2F1表达,同时上调的E2F1反过来促进ANRIL表达,从而形成正反馈环,继续促进GC细胞增殖。因此,ANRIL可以在表观遗传学水平与microRNAs相互作用,影响GC的预后。有研究[27]证实,富含核富集的转录物1(nuclear enriched abundant transcript1,NEAT1)在GC组织和细胞系中过表达,并与临床分期、组织学类型、淋巴结转移及远处转移相关,与低表达NEAT1的患者相比,高表达 lncRNA NEAT1的患者预后更差。单因素和多因素Cox回归分析显示,NEAT1过表达是GC患者预后不良的独立预后因素。Lü et al[28]报道了BC032469在GC组织中过表达,其表达水平与GC患者肿瘤大小、分化程度、生存期呈正相关性,下调BC032469在体外和体内显著抑制细胞增殖。深入研究其机制显示,BC032469可以直接结合miR-1207-5p,并有效地作为miR-1207-5p的海绵来抑制端粒酶催化亚单位基因(hTERT)下调。因此,BC032469可以作为内源性竞争性RNA(ceRNA)起作用以抑制miR-1207-5p依赖性hTERT下调,这表明其可能作为胃癌预后不良的生物标志物。
6 小结与展望
综上所述,lncRNA在胃癌的发生发展过程中发挥了重要作用,其既可作为原癌基因促进肿瘤的发生发展,亦可作为抑癌基因来抑制肿瘤的进展与转移,还可以调节肿瘤细胞对化疗药物的敏感性,以及在GC的预后判断中发挥重要作用(表1)。因此,通过检测胃癌相关lncRNA的表达有望为胃癌患者的诊断、治疗以及预后判断提供依据。虽然在肿瘤组织中越来越多异常表达的lncRNA被发现,但是,其发挥生物学功能的具体分子机制,以及如何将基础研究向临床应用转化,仍然是该研究领域所面临的巨大挑战。而且,目前在lncRNA研究领域,尚无统一的命名原则,且关于lncRNA的数据库还不够完善,以及用于研究lncRNA的新技术不多等难题都需要进一步的探索,因此关于lncRNA能否在临床领域得以应用,还有很长的路要走。

