血清TNF-α及MGP水平与维持性血液透析患者心脏瓣膜钙化的关系
王 珺,韩林子,张 森,王德光
维持性血液透析(maintenance hemodialysis,MHD)患者常出现骨以外的软组织钙化,包括血管钙化和心脏瓣膜钙化(cardiac valve calcification,CVC)。心脏瓣膜钙化是新发心血管事件和心血管死亡的独立危险因素,也是动脉粥样硬化、左心室肥厚、动脉钙化等心血管疾病发病率和死亡率的强烈预测因子[1]。
研究[2]表明,MHD患者体内存在微炎症状态并可能参与血管钙化的形成。肿瘤坏死因子(tumor necrosis factor alpha,TNF-α)是一种具有多种生物学效应的细胞因子,也是被证实的在体内外可促进血管钙化的炎症因子。但TNF-α与心脏瓣膜钙化的关系尚无相关研究;基质Gla蛋白(matrix Gla protein,MGP)是血管平滑肌细胞分泌合成的蛋白,具有抑制血管钙化的作用,参与多种血管病理生理过程。该研究测定MHD患者血清中TNF-α和MGP水平,并探讨其与心脏瓣膜钙化的关系。
1 材料与方法
1.1病例资料病例组选自2016年7月~2016年10月在安徽医科大学第二附属医院肾脏内科病房住院的MHD患者66例。入选标准:① 年龄≥18岁;② 充分透析,每周3次,每次至少4 h;③ 规律血液透析3个月或以上。排除标准:① 急性期感染;② 存在先天性瓣膜畸形、风湿性心脏瓣膜病或行人工瓣膜置换者;③ 合并严重心功能不全、严重肝病或恶性肿瘤者。MHD患者再根据有无心瓣膜钙化分为钙化组(30例)和非钙化组(36例)。对照组选择同期健康体检人群31例,年龄、性别、体质量指数(body mass index,BMI)均与病例组相匹配,无高血压、糖尿病、结缔组织病、慢性肾脏病等病史,体检肝肾功能、尿常规均正常。人口统计学、临床和实验室数据均通过医院检查记录以及问卷调查获得。
1.2空腹静脉血样标本的处理静脉血标本均清晨空腹采取,离心后收集血清分装于1.5 ml的EP管中,-80 ℃冰箱冻存。使用前取出至4 ℃冰箱中溶解,待完全溶解后作为实验样本。
1.3ELISA检测血清TNF-α及MGP测定严格遵照ELISA试剂盒说明书执行,在酶标仪(Infinite F50)450 nm波长分别检测TNF-α及MGP的吸光度(optical density, OD)值。以标准物浓度为横坐标,OD值为纵坐标,绘制标准工作曲线,建立拟合标准曲线的方程式,将样本的OD值代入方程式,计算出样本的浓度。ELISA试剂盒购自于武汉Bio-Swamp公司。
1.4诊断标准根据2009年改善全球肾脏病预后组织(KDIGO)建议,采用超声心动图法(西门子ACUSON+S 2000)检测心脏瓣膜钙化[3]。钙化标准:主动脉瓣瓣膜、二尖瓣瓣膜可探及1个或多个点状或团状回声增强,直径超过1 mm。
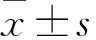
2 结果
2.1一般临床资料病例组66例,年龄20~80(53.7±14.2)岁。原发病:慢性肾小球肾炎32例(48.48 %),高血压肾病9例(13.64 %),糖尿病肾病7例(10.61 %),多囊肾7例(10.61 %),狼疮性肾病3例(4.55 %),其他8例(12.12 %)。对照组为31例,年龄、性别及BMI均匹配的健康人群。在病例组中,心瓣膜钙化者占45.45 %,显著高于健康人群,差异有统计学意义(P<0.001)。见表1。而在MHD患者中,瓣膜钙化组平均年龄、透析龄均显著高于非瓣膜钙化组,差异有统计学意义(P<0.05)。而这两组的其他实验室指标包括血红蛋白、白蛋白、三酰甘油、总胆固醇、血钙、血磷、甲状旁腺激素、碱性磷酸酶、C反应蛋白比较,差异均无统计学意义。见表2。
2.2血清TNF-α及MGP水平比较病例组血清TNF-α水平显著高于对照组,MGP水平低于对照组,差异有统计学意义(P<0.001)。MHD患者心脏瓣膜钙化组血清TNF-α水平高于非钙化组(P=0.027),MGP水平低于非钙化组(P=0.001),差异有统计学意义。见表1、表2。
2.3MHD患者血清TNF-α及MGP水平与临床指标的相关性血清MGP水平与年龄(r=-0.224,P<0.05)、碱性磷酸酶(r=-0.269,P<0.05)、TNF-α呈负相关性(r=-0.242,P<0.05);而血清TNF-α水平与年龄、透析龄、血红蛋白、三酰甘油、总胆固醇、血钙、血磷、钙磷乘积、甲状旁腺激素、碱性磷酸酶均无相关性(P>0.05)。见表3。

表1 研究对象的人口学特征及重要指标

表2 MHD患者心脏瓣膜钙化组与非钙化组的比较
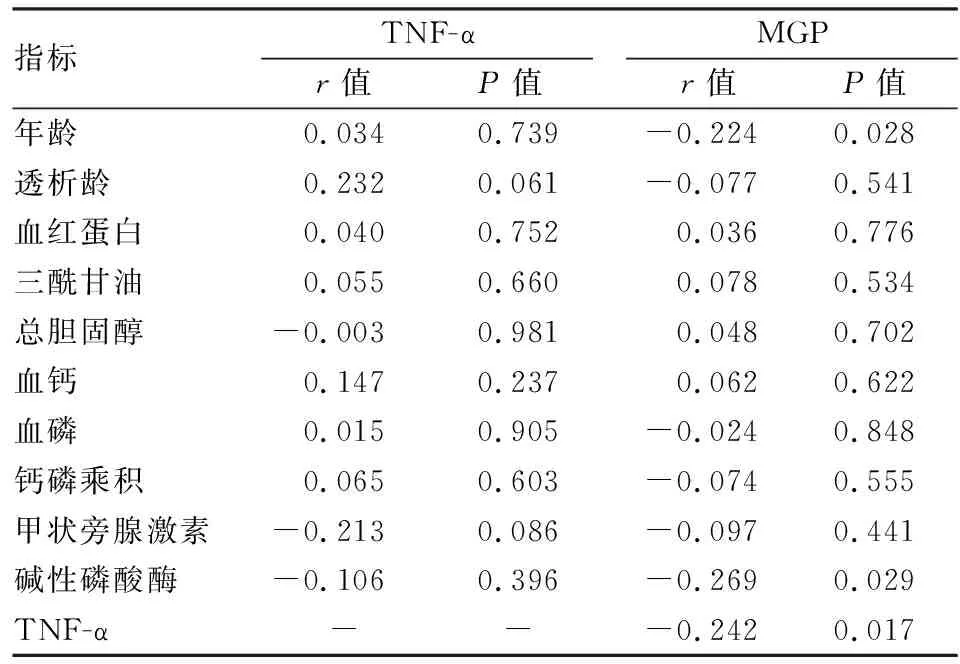
表3 TNF-α及MGP与MHD患者临床指标的相关性
2.4MHD患者心脏瓣膜钙化的多因素Logistic回归分析以瓣膜钙化有无为因变量,多因素Logistic回归分析显示,透析龄、血清TNF-α水平是CVC的危险因素(P<0.05,P<0.01),而MGP是CVC的保护因素(P<0.05)。校正年龄、性别、BMI、高血压、糖尿病、血红蛋白、白蛋白、C反应蛋白、三酰甘油、总胆固醇、钙磷乘积、甲状旁腺激素、碱性磷酸酶后,透析龄每增加1个月,CVC发生风险升高5.3 %;血清TNF-α每增加1 pg/ml,CVC发生风险升高9.9 %;血清MGP每增加1 ng/ml,CVC发生风险减少56.0 %。见表4。
3 讨论
心血管疾病(cardiovascular disease,CVD)是MHD患者常见的并发症和首要死亡原因,而心脏瓣膜钙化是预测MHD患者心血管疾病和全因死亡的独立危险因素[4]。研究[5-6]显示,心脏瓣膜钙化在MHD患者中的发生率为25.5%~58%,该研究显示,MHD患者心脏瓣膜钙化的发生率为45.45%,且远高于健康人群,与既往研究[5-6]结果基本一致。CVC可致斑块破裂、心肌缺血或梗死,晚期可能出现心律失常甚至心力衰竭等严重后果。本研究同贾凤玉 等[7]研究均显示,心脏瓣膜钙化的患者透析龄显著大于非瓣膜钙化患者。且透析龄越长,CVC发生率越高。研究[8]显示,MHD患者发生CVC与钙磷代谢紊乱、高甲状旁腺激素血症、高C反应蛋白密切相关,但该研究并未显示明显相关性。可能与该研究样本量较小,且研究对象有一定特殊性(均为MHD住院患者、病情较重)有关。
随着年龄增长,骨矿含量逐渐减少,软组织钙化出现,故有学者认为瓣膜钙化与衰老相关,衰老过程伴有细胞内钙含量的增多,钙从骨骼向软组织转移[9]。该研究显示,心脏瓣膜钙化的MHD患者年龄显著高于非瓣膜钙化患者,也进一步验证瓣膜钙化与衰老相关的观点。
在全身或局部没有急性感染迹象时,尿毒症患者血清炎症标志物水平仍轻度升高,称之为“微炎症状态”,其实质是免疫炎症,具有相对隐匿且持续的特点[10]。该研究结果表明MHD患者体内呈微炎症状态。笔者认为,在血液透析过程中,反复穿刺动静脉瘘管、透析液和透析膜的生物不相容性、透析液中内毒素污染、透析用水不纯、血管通路感染尤其是深静脉置管的感染是引起MHD患者血清炎症因子水平升高的主要原因。在该研究中,伴有CVC的患者血清TNF-α水平明显升高,揭示TNF-α在瓣膜钙化过程中起重要作用,具体作用机制需进一步研究证实。
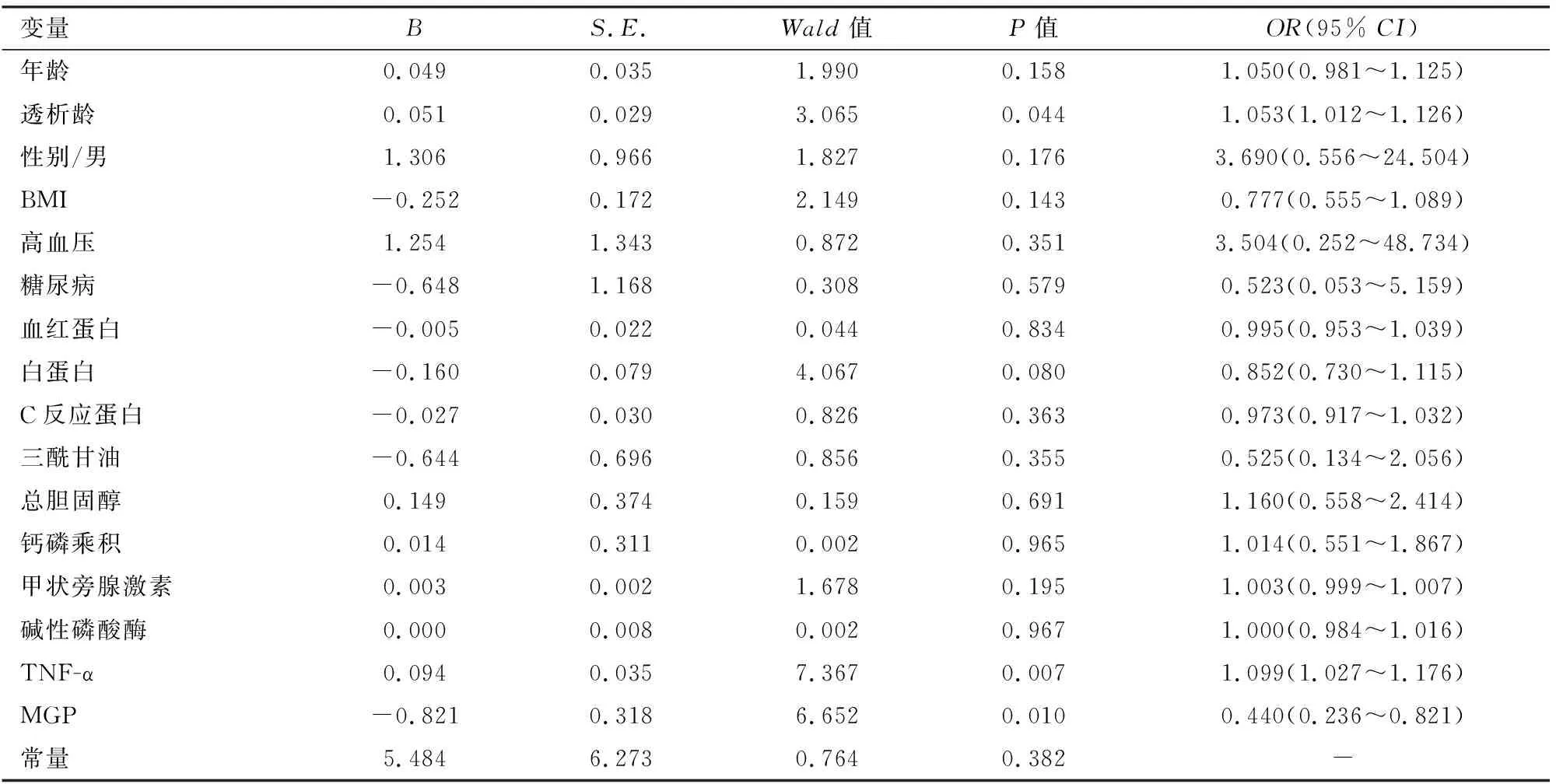
表4 心脏瓣膜钙化的多因素Logistic回归分析
MGP是维生素K依赖性循环蛋白,相对分子质量约10 000 bp。体内MGP缺乏的小鼠出生后约2个月就出现了广泛性的动脉钙化,最终导致血管破裂而死亡,揭示了MGP参与了动脉钙化的抑制过程,是体内研究发现的第一个血管钙化抑制因子[11]。其主要作用机制可能为:① MGP与羟磷灰石结合直接抑制羟磷灰石的增加以及钙的沉积;② MGP可与BMP-2结合,使其功能丧失,从而抑制血管平滑肌细胞(vascular smooth muscle cell,VSMC)向成骨样细胞表型转换;③ MGP可能通过抑制VSMC的凋亡(使VSMC维持收缩表型)而直接抑制血管钙化的发生和发展[12]。MGP主要分布在软骨、骨髓和动脉壁,在心脏也呈高水平表达。该研究说明了MGP的表达上调限制了瓣膜钙化的发生。Venardos et al[13]发现,分别从钙化和非钙化的瓣膜中分离出瓣膜间质细胞进行体外培养,钙化的瓣膜间质细胞MGP表达水平明显减少。这些证据均表明,MGP是心脏瓣膜钙化的抑制因子,其具体发病机制有待进一步研究。
随着年龄增大,MGP表达下降甚至失活,机体失去钙化防御机制,开始出现异位钙化。碱性磷酸酶是一组同工酶,骨特异性碱性磷酸酶可表达于成骨细胞、软骨细胞或有钙化倾向的细胞如钙化的VSMC,在组织钙化的发展中起重要作用。高血清碱性磷酸酶被认为是MHD患者冠状动脉钙化的独立危险因素[14],但该研究并未显示碱性磷酸酶在CVC组有显著升高,可能是其他种类碱性磷酸酶代偿的结果。
多因素Logistic回归分析显示, MHD患者的透析龄及血清TNF-α均为心脏瓣膜钙化发生的独立危险因素,校正其他相关因素后,透析龄每增加1个月,心脏瓣膜钙化发生风险升高5.3 %;血清TNF-α每增加1 pg/ml,心脏瓣膜钙化发生风险升高9.9%,而血清MGP每增加1 ng/ml,心脏瓣膜钙化发生风险减少56.0 %,说明MGP是心脏瓣膜钙化的保护性因素。

