硫辛酸胺对损伤血管内膜增生的影响及机制
汪 洋,鲍得俊,程传东,董永飞,魏祥品,牛朝诗,傅先明,汪业汉
介入手术是治疗心脑血管疾病重要手段, 但术后引起的血管内膜损伤后再狭窄是困扰介入治疗的难题[1], 而内膜增生(intimal hyperplasia,IH)是血管介入术后再狭窄的病理基础[2]。研究[3]显示血管内皮细胞(endothelial cells,ECs)凋亡减弱了血管内皮层的屏障作用,加速斑块的形成。ECs凋亡后,又可以启动凝血机制在病变局部形成血栓,加重血管腔狭窄[4]。目前,一些相应的抑制ECs凋亡的药物被应用到临床。硫辛酸胺 (α-lipoic acid-plus,LAP) 是硫辛酸(α-lipoic acid,LA)的衍生物,可抑制蛛网膜下腔出血(subarachnoid hemorrhage,SAH)引起的氧化应激,进而抑制神经细胞的凋亡,与最常见的抗氧化剂LA相比,LAP的抗凋亡作用更强[5]。该研究拟通过球囊压迫法建立颈动脉内膜损伤动物模型,再予以LAP干预,探讨LAP对IH的影响及其作用机制。
1 材料与方法
1.1药品与试剂活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)试剂盒购自南京建成生物工程研究所;TUNEL试剂盒购自美国Sigma公司;LAP由大连美仑生物科技有限公司合成,纯度100%。Western blot和免疫荧光一抗:Cathepsin B/D、Caspase-3购自英国Abcam公司;Western blot二抗:HRP标记的山羊抗兔、山羊抗小鼠二抗购自美国Santa Cruz公司;免疫荧光二抗:Alexa Fluor-488 donkey anti-rabbit IgG 抗体、Alexa Fluor-488 donkey anti-goat IgG 抗体购自美国Invitrogen公司。
1.2实验动物成年健康雄性SD大鼠由上海实验动物研究中心提供,雄性,300~350 g。所有动物实验遵照国家实验动物饲养和使用指南,术前单笼饲养,保持室温18~22 ℃,自由饮食饮水,安静、避光环境中饲养。
1.3方法
1.3.1动物模型的建立 10%水合氯醛(药物效量:4 ml/kg)对SD大鼠进行腹腔注射麻醉。麻醉成功后,将大鼠仰卧于操作台上,颈部去毛备皮,安尔碘常规消毒。正中偏右0.5 cm切开皮肤,切开颈前肌,牵开胸锁乳突肌,找到颈动脉分叉处,游离颈内、颈外、颈总动脉。显微镜下血管夹夹住颈总动脉,在颈外动脉上剪开一个缺口,球囊装置塞入缺口沿着管腔一直到达颈总,松开血管夹,球囊装置继续向前,大约离分叉处2 cm左右,注射器注水使球囊充盈,关闭阀门,然后沿着管腔来回滑动3次,造成颈动脉内膜损伤。抽出球囊中的水,退出导管,显微镜下缝合颈外动脉上的缺口[6]。
1.3.2实验分组和处理 SD大鼠48只,随机分为4组,假手术组:12只,只分离颈动脉;血管损伤组:12只,显微镜下利用球囊压迫法建立大鼠颈动脉损伤模型;LAP低剂量组:12只,模型建立后6 h,将LAP(100 mg/kg)与2 ml的甲基纤维素(浓度为0.5%)混合,通过胃管给药,连续3 d,每天给药一次;LAP高剂量组:12只,模型建立后6 h,将LAP(150 mg/kg)与2 ml的甲基纤维素(浓度为0.5%)混合,通过胃管给药,连续3 d,每天给药一次。
1.3.3氧化应激水平的测定 用ROS、MDA、SOD、GSH-Px试剂盒来进行氧化应激水平的测定。显微镜下剥除损伤区域血管内皮层,加入适量生理盐水研磨成匀浆,4 ℃、10 000 r/min离心10 min,取上清液分装,分别用作ROS、MDA、SOD、GSH-Px的分析,匀浆中的蛋白浓度由考马斯亮蓝法试剂盒测定。ROS含量的测定选用ROS检测探针DCF-DA,混合液的荧光强度由荧光酶标仪(FilterMax F5, Molecular Devices)来测定,最佳激发波长为485 nm,最终的ROS的测定结果以荧光强度/mg蛋白表示,根据试剂盒中提供的步骤,类似地测定MDA含量、SOD、GSH-Px的活性。
1.3.4Western blot法 显微镜下取适当长度的颈动脉内皮研磨,加入裂解液,离心,4 ℃过夜;Bradford比色法测定总蛋白浓度;制胶,15%分离胶,5%浓缩胶;蛋白样品100 ℃变性5 min,上样30 μg;恒压60 V进胶,当溴酚蓝前沿刚进入分离胶后,恒压100 V跑胶;用转移槽恒流转膜,2 h;用丽春红染液将PVDF膜染色,据目标蛋白分子量将膜进行适当剪切;用PBS浸泡使膜上的丽春红颜色褪去;用含5% BSA的PBST溶液在室温下封闭1 h;用含3 % BSA的PBST溶液稀释一抗(1 ∶1 000),与含目标蛋白的PVDF膜在4 ℃孵育过夜;用PBST浸泡膜1次,10 min;用PBS浸泡膜2次,每次10 min;用PBS稀释二抗(1 ∶5 000),室温孵育1 h;用PBS浸泡膜3次,每次10 min;ECL 化学发光底物法暗室中显色;扫描保存实验结果,用QUANTITY ONE(v4.6.2)凝胶电泳图象分析软件,分析结果。
1.3.5免疫荧光共染 取4 μm的血管石蜡切片,70 ℃烘片2 h,经二甲苯、乙醇脱蜡水化;切片置于10 mmol/L柠檬酸盐缓冲液(pH 6.0)中行抗原修复,微波炉加热(95 ℃),30 min,自然冷却至室温;PBS浸泡3次,每次5 min;0.2% TRItion X-100透化2 min;PBS浸泡3次,每次5 min;0.5%天空蓝浸泡10 min;PBS浸泡3次,每次5 min ;10%血清封闭液封闭20~30 min;加一抗(1 ∶100)4 ℃过夜;恢复室温,PBST浸泡3次,每次5 min;加相应二抗(1 ∶200)37 ℃孵育30 min~1 h(避光),恢复室温,PBST浸泡3次,每次5 min;防淬灭封片剂封片;共聚焦显微镜下观察并拍照。
1.3.6HE染色 取4 μm的血管石蜡切片,70 ℃烘片2 h,经二甲苯、乙醇脱蜡水化;梯度酒精脱脂。将切片依次放入100%、95%、80%乙醇中各3 min,最后放入自来水中2 min;苏木精染色30 s;蒸馏水洗片2 min;0.5%盐酸酒精分化3 s;自来水洗片2 min; 80% 乙醇中15 s;伊红染色1 min(不可超时);蒸馏水速洗;脱水,将切片依次放入80%、95%、100%乙醇中各15 s,最后放入二甲苯中10 min;将切片放置通风橱中干燥,滴加中性树脂封片;显微镜下观察并拍照。
1.3.7TUNEL染色 根据TUNEL试剂盒实验步骤进行染色:① 取4 ~ 6 μm的石蜡切片,预热70 ℃烤片2 h, 在二甲苯及梯度酒精(100%、95%、90%、80%、70%)溶液中脱蜡;② 预处理:在37 ℃避光保温箱中,切片浸没孵育在蛋白酶K溶液(10~20 μg/ml in 10 mol/L TRIs/HCl,pH 7.4~8)浸泡30 min;③ PBS溶液冲洗3次,每次5 min;④ 在37 ℃的避光保温箱中,滴加TUNEL工作溶液,孵育60 min;⑤ PBS溶液冲洗3次,每次5 min;⑥ 暗室中常温风干,滴加抗淬灭荧光封片剂,加盖玻片封存。
2 结果
2.1损伤血管氧化应激水平测定假手术组中ROS、MDA水平很低,而损伤组ROS、MDA水平显著上升,为对照组的(1.370±0.101)、(1.432±0.089)倍(F=12.32、10.14,P<0.05);干预组中,LAP能显著抑制ROS、MDA 的上调,为损伤组的(0.784±0.081)、(0.681±0.078)倍(F=7.75、P<0.05,F=14.67、P<0.01);同时SOD、 GSH-Px在损伤后活性显著下降,为对照组的(0.509±0.213)、(0.588±0.093)倍(F=22.69、P<0.01,F=24.35、P<0.01),但LAP能显著抑制SOD、GSH-Px的下调,为损伤组的(1.364±0.112)、(1.417±0.056)倍(F=7.45、P<0.05,F=16.78、P<0.01),其变化趋势与ROS、MDA含量的变化趋势相反。不同剂量的LAP抗氧化应激的能力无明显差异,见图1。
2.2血管内皮组织中的CathepsinB/D、Caspase-3的表达Western blot 结果显示,与假手术组比较,损伤组内皮组织中CathepsinB/D,Caspase-3的蛋白水平明显上升(F=19.35、P<0.01,F=23.65、P<0.01,F=7.86、P<0.05),LAP能够显著抑制CathepsinB/D,Caspase-3的水平(F=21.73、P<0.01,F=11.54、P<0.05,F=8.95、P<0.05);高剂量的LAP较低剂量LAP能发挥更强的效应(F=9.39,P<0.05,F=17.15、P<0.01),见图2。利用免疫荧光方法检测了血管内皮层中CathepsinB/D表达,损伤组中内皮组织中CathepsinB/D的表达较假手术组轻度增多,但应用LAP干预后,内皮组织中的CathepsinB/D显著下调,见图3、4。
2.3TUNEL染色结果与假手术组比较,损伤组内皮层中的ECs凋亡率显著升高(F=14.35,P<0.01),LAP处理显著地降低了ECs的凋亡率(F=7.76、P<0.05,F=25.63、P<0.01)。验证了LAP通过抑制凋亡,保护ECs的作用,见图5。
2.4HE染色结果血管损伤后3周,损伤节段血管内可见明显的内膜增厚,有效管腔面积低于假手术组,为假手术组的(0.764±0.201)倍(F=17.84,P<0.01),LAP可显著被抑制IH,有效抑制管腔狭窄,为损伤组的(1.231±0.359)倍(F=7.26,P<0.05)。结果表明LAP能够抑制损伤血管IH及管腔狭窄,见图6。
3 讨论
内皮损伤是介入治疗的特异性损伤,也是一种严重的并发症,内皮损伤与血管内血栓和再狭窄形成密切相关,而促进血管内皮再生,短时间内恢复内皮完整性有助于预防血管再狭窄。当血管内皮损伤后,延迟性再内皮化和IH将会变得不可避免,同时对血管的再狭窄率和血栓的形成发挥很大的作用。目前,文献[7]报道已经有很多有效的干预措施及药物来预防血管损伤后的IH。例如,血管周围应用雷帕霉素可对血管IH呈现持续的抑制作用。在损伤血管局部使用胰岛素可显著减少增生内膜的厚度,增加管腔面积而不影响全身的血糖水平,同时平滑肌细胞的增殖和迁移受到了抑制,因此,胰岛素涂支架对血管内手术后的再狭窄提供了保护效应[8]。近年来,ECs凋亡引起延迟再内皮化引起了重视,有多种信号通路参与ECs凋亡,如Ox-LDL可通过PERK/eIF2α/CHOP ER-stress信号通路诱导ECs凋亡[9]。有文献[10]证实内皮抑素特异性抑制ECs生长、迁移,诱导ECs凋亡,抑制损伤血管的再内皮化,参与了再狭窄形成。另外,有文献[11]证实姜黄素可抑制ECs的凋亡来促进血管损伤区域再内皮化,继而抑制血管IH。在前期研究中,Svensson et al[12]已经在实验中论证了miR-125a在ECs中过表达可抑制ECs的增殖和分化,同时下调Bcl-2 和Caspase-3蛋白水平,激活内部凋亡通路,加速ECs的凋亡,因此,应用miR-125a 抑制剂可能是增加ECs增殖及分化,促进血管损伤后再内皮化的一种重要方法。当血管内皮损伤后,部分红细胞粘滞在受损的内皮层,继而发生分解产生血红蛋白,血红蛋白的分解产物亚铁血红素在血红素加氧酶的作用下生成二氧化碳和胆绿素,随之生成具有催化作用的活性铁,此反应中通过Fenton反应也有大量的ROS的产生[13]。Yu et al[14]前期试验已经证实细胞的溶酶体内存在一个不稳定、氧化活性铁池,如果细胞遭受到外界氧化应激损伤时,溶酶体内铁将会增加细胞损伤的危险。同时,笔者在之前的试验中证实了SAH后早期脑损伤与神经元与小胶质细胞的凋亡密切相关,其具体表现为SAH后神经细胞内溶酶体膜的通透性增加,破裂的溶酶体数目增多,释放的Cathepsins将进一步级联放大溶酶体外的凋亡信号。但这一过程可能有自由铁的参与,溶酶体酸性环境和高水平的自由铁促进了Fenton反应,产生了氧化能力更强的羟自由基,损伤并破坏溶酶体膜。而一种亲溶酶体内铁的螯合剂LAP,作为LA的衍生物,结构中含有巯基,可靶向与溶酶体内铁反应,稳定溶酶体膜,抑制Cathepsins介导的凋亡通路,减轻神经细胞的凋亡,起到脑保护的作用[5]。众所周知,溶酶体和Cathepsins能级联放大溶酶体外的凋亡信号在多种疾病中已经被证实[15]。
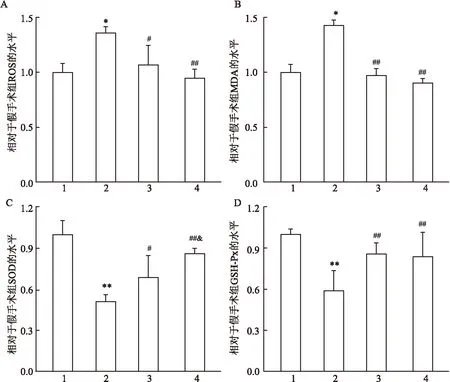
图1 损伤血管的氧化应激水平
A:ROS;B:MDA;C:SOD;D:GSH-Px; 1:假手术组;2:血管损伤组;3:LAP低剂量组;4:LAP高剂量组;与假手术组比较:*P<0.05,**P<0.01;与血管损伤组比较:#P<0.05,##P<0.01;与低剂量组比较:&P<0.05
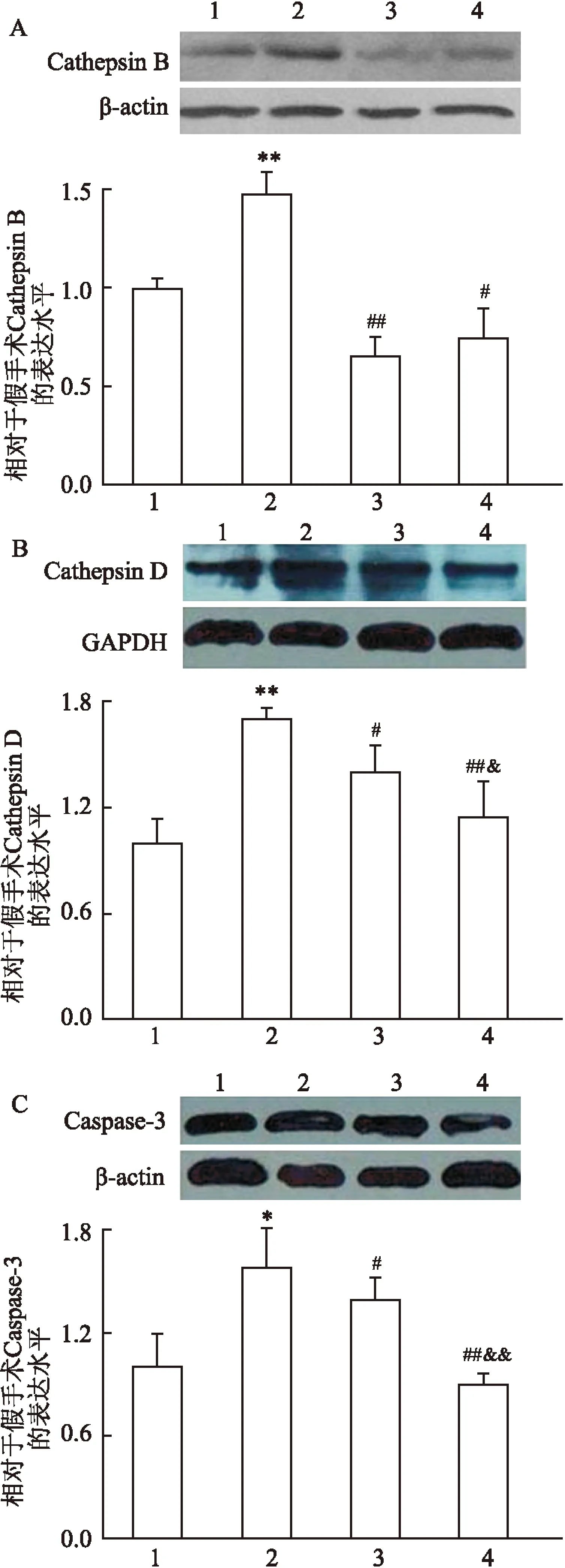
图2 Western blot检测CathepsinB/D和Caspase-3的表达水平
A:Cathepsin B; B:Cathepsin D; C:Caspase-3; 1:假手术组;2:血管损伤组;3:LAP低剂量组;4:LAP高剂量组;与假手术组比较:*P<0.05,**P<0.01;与血管损伤组比较:#P<0.05,##P<0.01;与低剂量组比较:&P<0.05
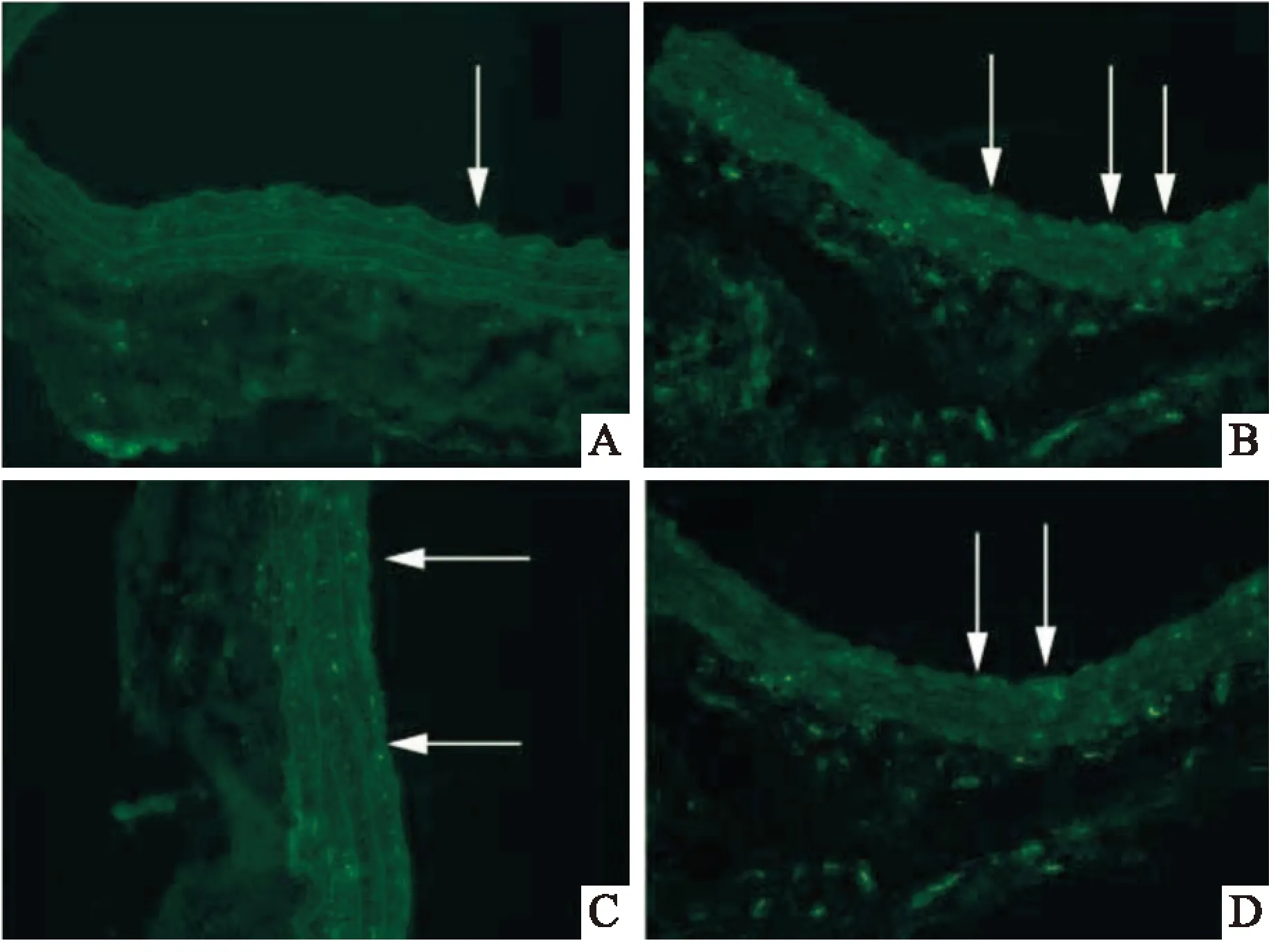
图3 免疫荧光法检测Cathepsin B的表达水平×400
A:假手术组;B:血管损伤组;C:LAP低剂量组;D:LAP高剂量组
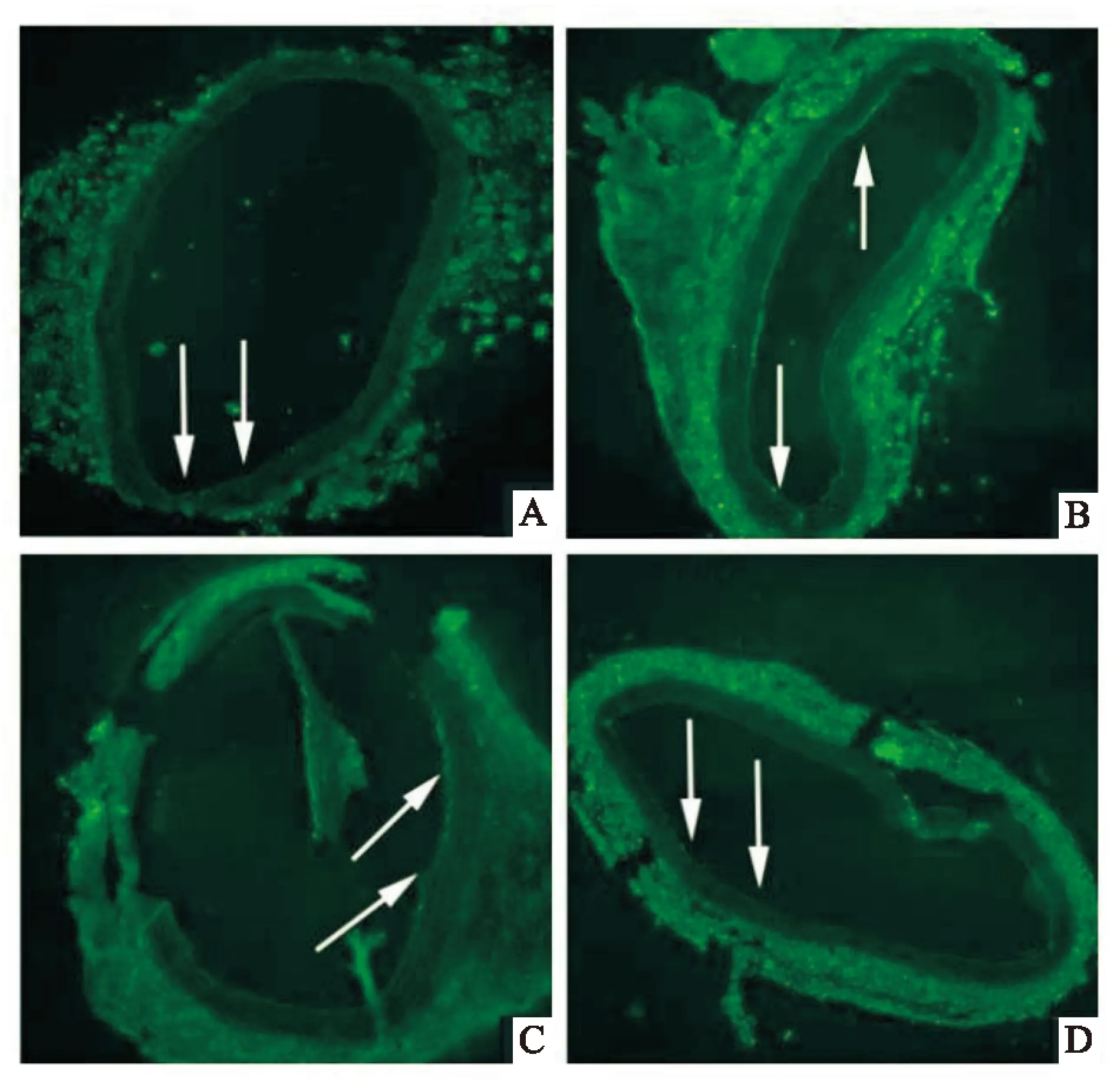
图4 免疫荧光法检测Cathepsin D的表达水平 ×100
A:假手术组;B:血管损伤组;C:LAP低剂量组;D:LAP高剂量组
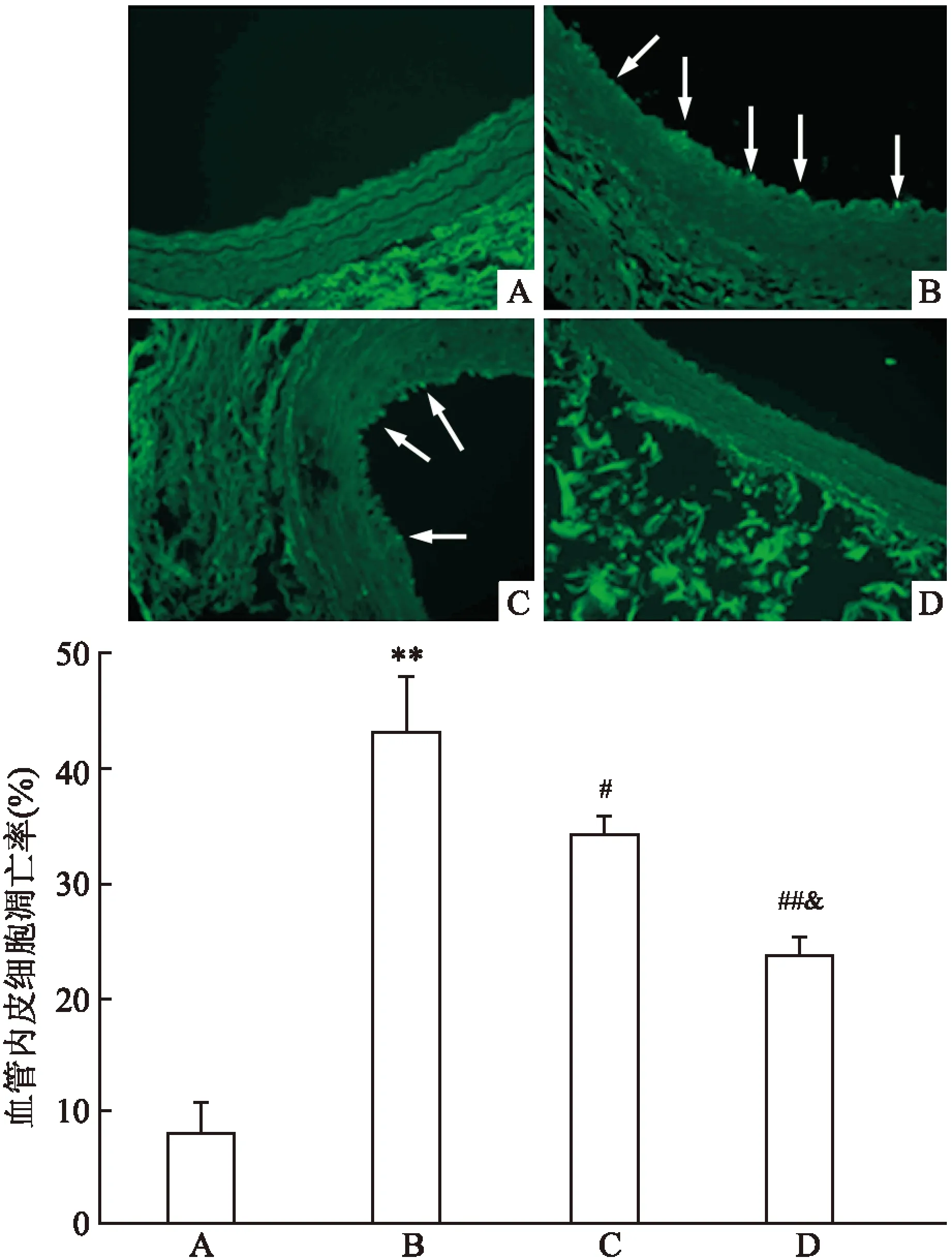
图5 TUNEL染色标记凋亡的内皮细胞 ×400
A:假手术组;B:血管损伤组;C:LAP低剂量组;D:LAP高剂量组;与假手术组比较:**P<0.01;与血管损伤组比较:##P<0.01,#P<0.05;与LAP低剂量组比较:&P<0.05
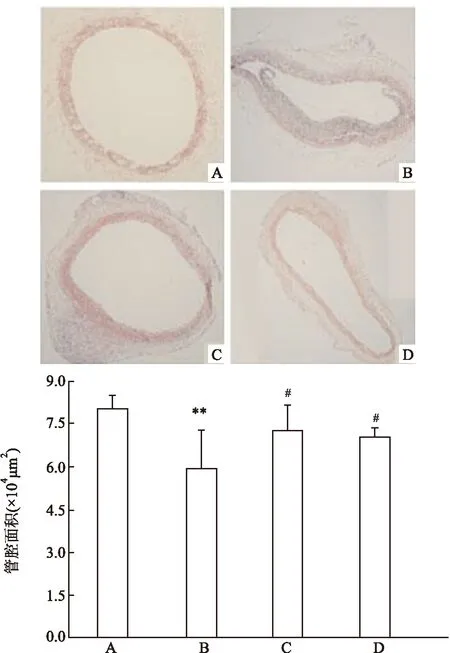
图6 HE染色评估内膜增生及管腔狭窄情况 HE×100
A:假手术组;B:血管损伤组;C:LAP低剂量组;D:LAP高剂量组;与假手术组比较:**P<0.01;与血管损伤组比较:#P<0.05
综上所述,ECs凋亡在血管内膜损伤后再内皮化及IH过程中受到广泛重视,一些相应抑制ECs凋亡的药物被应用到临床。但在血管内膜损伤中,Cathepsins介导的ECs凋亡通路却很少被探讨,本次实验结果提示当血管内膜损伤72 h后,损伤血管内皮层的氧化应激水平、CathepsinB/D、Caspase-3的表达水平及ECs凋亡率明显上调,但LAP能显著抑制氧化应激水平、ECs凋亡率及上述蛋白的表达;当血管内膜损伤3周后,HE染色结果显示损伤节段血管可见明显的内膜增厚,导致管腔狭窄。而LAP可显著抑制IH,减轻血管腔的狭窄。因此,LAP抑制大鼠颈动脉球囊损伤后IH,其可能机制为LAP不仅因为其抗氧化的特性,还特异性抑制溶酶体内Cathepsins介导的凋亡通路,减少ECs的凋亡,加速损伤区域内皮修复,从而抑制IH。因此,像此类能抑制溶酶体内Cathepsins的药物,将会成为治疗血管内膜损伤中延迟再内皮化及内膜过度增生的一种新的策略。

