基质金属蛋白酶的研究进展*
刘明明, 李爱玲, 修瑞娟
(中国医学科学院微循环研究所, 卫生部微循环重点实验室, 北京 100005)
基质金属蛋白酶(matrix metalloproteinases,MMPs)是自然界进化中高度保守的一类蛋白酶,属锌依赖性内肽酶家族,能降解细胞外基质(extracellular matrix,ECM)的几乎所有成分及髓磷脂、生长因子、细胞因子和细胞黏附分子等[1]。ECM通过释放信号分子为组成机体的重要细胞单位和组织单元提供结构支撑。细胞和组织与ECM之间的相互作用可参与并影响机体大多数生理活动[2]。正常生理情况下,MMPs表达水平极低,而在炎性因子、生长因子、高糖和氧化应激等环境及病理条件下MMPs表达水平显著上调。因此,MMPs在ECM和组织重构、器官发生发育、血管形成、免疫炎症、细胞迁移、增殖和细胞凋亡等生理和病理过程中发挥重要作用。近年随着对MMPs基础研究的不断深入,其在诸多疾病进程中的作用越来越受到临床和基础领域学者的重视。
1 MMPs的结构、分类和功能
1.1MMPs的结构 人体内表达25种MMPs,包括5个共同的结构域:信号肽(~20氨基酸)和前肽(~80氨基酸)、催化结构域(~170氨基酸)和血红素结合蛋白样C末端结构域(~200氨基酸),后者通过铰链区连结于催化结构域。MMPs活性依赖于锌离子(Zn2+),其催化结构域有2个Zn2+结合区和1个钙离子(Ca2+)结合区,2个Zn2+结合区中,1个为催化性结合区,位于MMPs酶活性中心内,通过保守序列HEXGHXXGXXH中组氨酸与Zn2+结合,参与MMPs催化过程;另1个为结构性结合区[3]。信号肽可引导翻译产物至胞浆内质网。前肽含有保守的Pro-Arg-Cys-Gly-Val/Asn-Pro-Asp序列,其中的半胱氨酸残基是MMPs酶原活化的关键位点,故前肽序列的裂解对于MMPs激活至关重要。铰链区位于催化区和血红素结合蛋白样C末端结构域之间,通过二硫键与血红素结合蛋白区末端氨基酸残基相连[4],可能与MMPs激活过程中分子折叠有关,见图1。血红素结合蛋白样C末端结构域与MMPs底物特异性有关,同时参与MMPs与组织金属蛋白酶抑制物(tissue inhibitor of matrix metalloproteinases,TIMPs)的结合。此外,部分MMPs家族成员存在弗林蛋白酶激活序列RRKKR,与该类MMPs酶原直接激活有关。
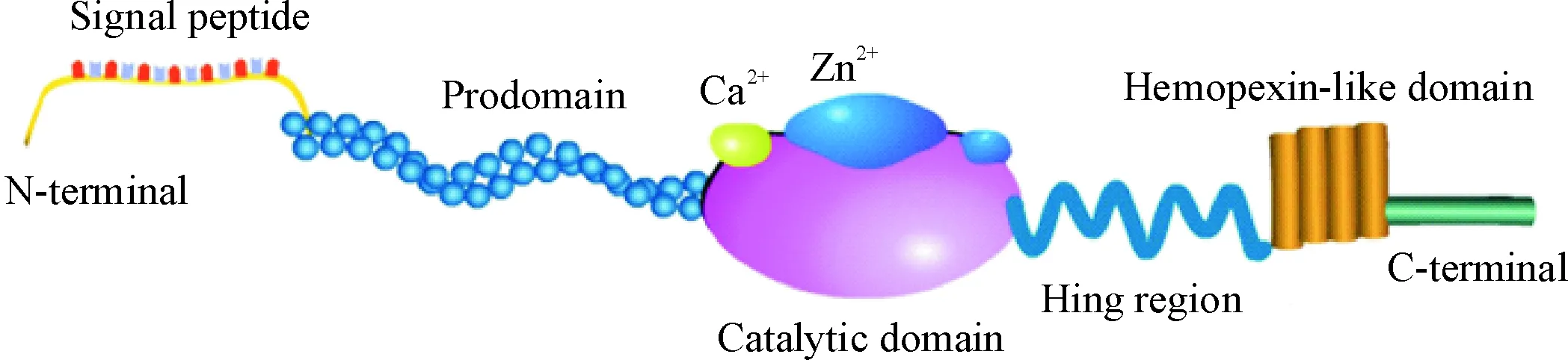
Figure 1.The structure of the matrix metalloproteinases.
图1基质金属蛋白酶结构示意图
1.2MMPs的分类 根据底物的不同,MMPs可分为胶原酶(collagenases),明胶酶(gelatinases)、间质溶素(stromelysins)、膜型基质金属蛋白酶(membrane-type MMP,MT-MMP)和其它类型基质金属蛋白酶。MMPs酶分型、编号、全酶及活性酶分子量、主要酶分布及酶切底物见表1[5]。
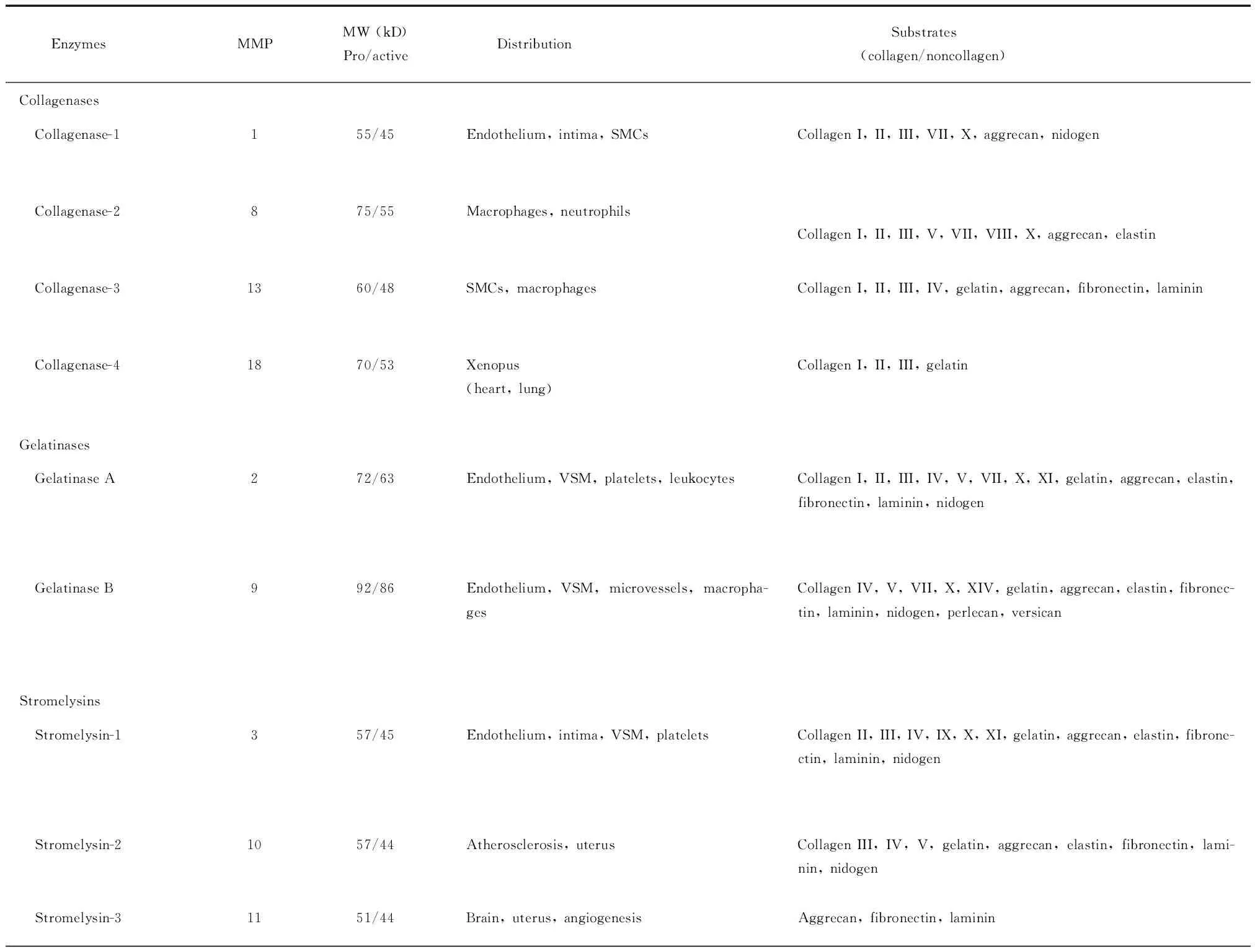
表1 MMPs酶分型、编号、分子量、主要酶分布及底物
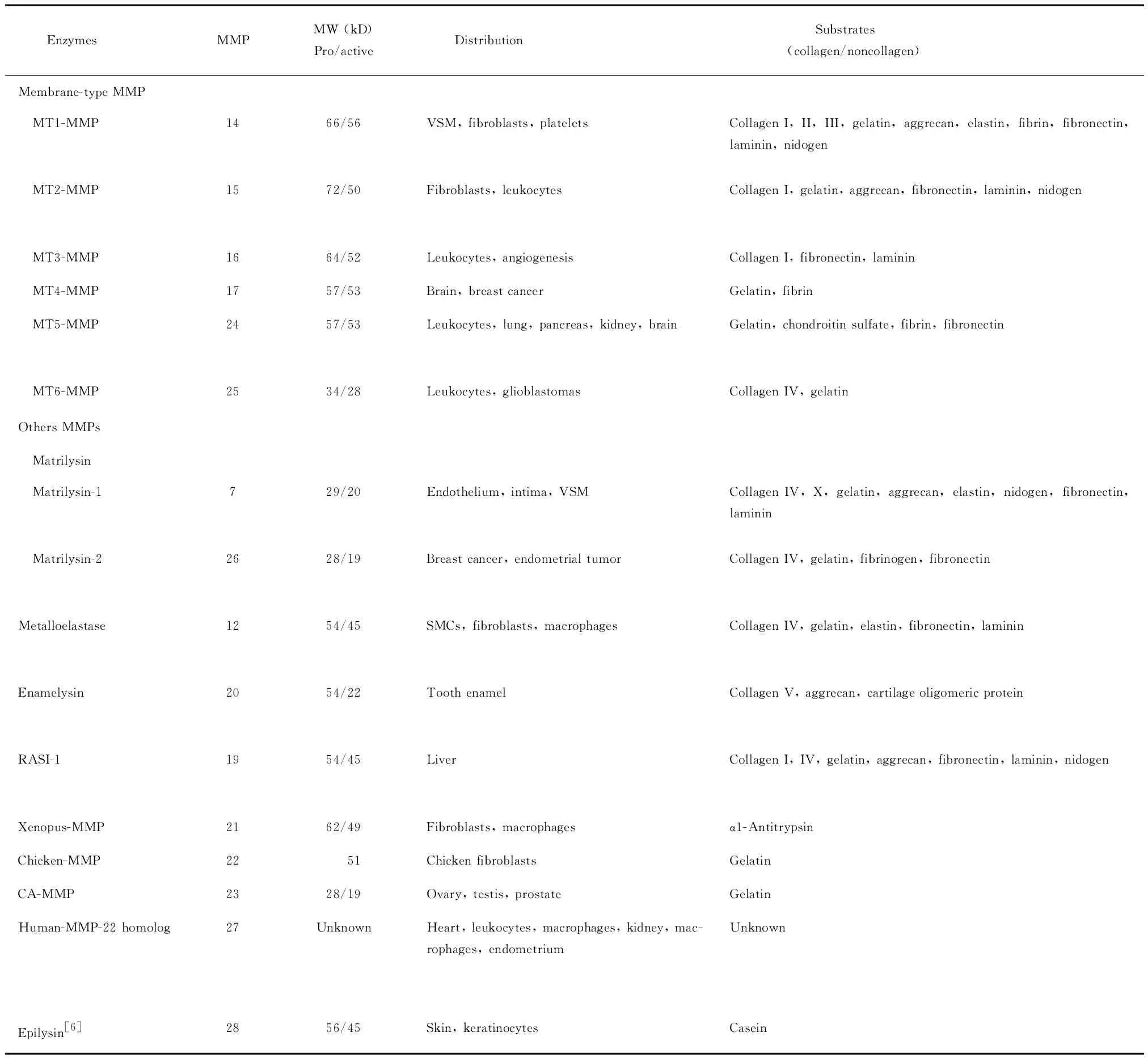
Table 1.(continued)
SMCs: smooth muscle cells; VSM: vascular smooth muscle; CA-MMP: cysteine array MMP.
1.3MMPs的功能 MMPs可在生理和病理条件下降解细胞外基质的所有主要成分,包括胶原、明胶、纤维蛋白和层黏连蛋白等。生理状态下,MMPs可维持ECM正常结构和功能,对ECM降解、组织重建及细胞间多种可溶性因子的调控起重要作用,并参与机体血管生成、伤口愈合等诸多生理过程。此外,MMPs可参与内皮细胞基底膜降解、迁移和增殖、新生血管、新生微血管和基底膜形成等过程;病理状态下,MMPs参与肿瘤细胞的生长和转移、心血管疾病和炎症疾病的病理过程。肿瘤细胞可与基底膜表面受体纤维连接蛋白和层黏连蛋白结合,分泌MMPs或诱导基质细胞分泌MMPs,降解基底膜的同时上调细胞外环境中血管内皮生长因子和表皮生长因子等水平,促进肿瘤血管生长,导致肿瘤侵袭。此外,MMPs家族成员可活化ECM结构蛋白,参与机体炎症反应。
2 MMPs的表达及活性调控
MMPs的表达和激活受到严格调控,包括基因转录水平调节、蛋白酶原活化水平调控和特异性抑制因子TIMPs的调控,上述3个环节动态维持机体MMPs稳态。
2.1基因转录水平和转录后水平的调节 MMPs的表达调控主要发生在基因转录水平,许多细胞因子、生长因子、细胞外基质组分和化学因素(高糖毒性和激素等)均可诱导MMPs表达。糖皮质激素和转化生长因子β等则可在转录水平抑制MMPs基因表达。MMPs 5’-端基因序列存在1个约670个核苷酸组成的顺式作用元件转录调控区,包括TATA盒(TATA box)、激活蛋白1(activator protein 1,AP-1)、核因子κB(nuclear factor-κB,NF-κB)、特化蛋白1、多瘤促活化因子(polymoma virus enhancer-3,PEA3)和激活蛋白2等转录调控元件的结合位点,上述细胞因子、生长因子等通过反式作用因子激活MAPK等信号通路结合至AP-1和PEA3等调控元件位点,实现对MMPs表达水平的调控。此外,转录因子可通过与MMPs启动子区的上述转录调控元件结合参与MMPs的表达调控[7],如由c-Fos和c-Jun组成的转录激活因子异二聚体AP-1[8]和异常活化的NF-κB[9]均参与了MMP-9的基因表达调控。同转录水平调控一样,转录后水平则主要通过调节MMPs的mRNA稳定性,如Hu蛋白家族与3’-非翻译区的富含A、U元件等抗氧化反应元件(antioxidant response element,ARE)结合后可增加白细胞介素1β(interleukin-1 β,IL-1β)介导的MMP-9表达水平[10]。
2.2酶原活化水平调控 酶原活化过程是MMPs发挥其生物学功能的关键环节,包括逐步活化机制、细胞表面活化和细胞内活化途经。绝大多数MMPs mRNA经翻译、修饰后以酶原形式(MMPs前体)分泌至细胞外基质,经丝氨酸蛋白酶、弗林蛋白酶等去除前肽区后活化。前肽区中PRCGV/NPD保守序列中,Cys-SH基与活性中心催化性Zn2+的结合是维持酶原稳定的关键。Zn2+-Cys连接断裂导致的活性中心游离是MMPs前体激活的关键。膜型基质金属蛋白酶(membrane type matrix metalloproteinase,MT-MMP)可通过其C末端的跨膜区定位于细胞表面,活化部分MMPs,如MT1-MMP,MT2-MMP,MT3-MMP和MT5-MMP均可活化pro-MMP-2;MT1-MMP可活化proMMP-13等[11]。一些MMPs(如MMP-3、 -11、 -21、 -28和MT-MMPs)含有弗林蛋白酶结合位点[12],可在细胞内被弗林蛋白酶直接活化。
2.3TIMPs对MMPs的调节作用 TIMPs是MMPs的天然抑制物,是一组可抑制MMPs活性的多基因家族成员,包括TIMP-1~TIMP-4[13],在调控MMPs活性方面发挥重要作用,见表2。TIMPs含有12个高度保守的半胱氨酸,在N端形成3个环状结构,半胱氨酸通过竞争性结合MMPs催化结构域活性中心的Zn2+,抑制MMPs酶活性。在酶原活化阶段,TIMPs可与MMPs形成稳定的复合体,阻碍MMPs的酶原活化;对于活化的MMPs,TIMPs可与其形成复合物抑制其酶活性。TIMP-1主要由巨噬细胞、成纤维细胞、平滑肌细胞和内皮细胞合成,可抑制绝大多数MMPs,广泛存在于组织中,可被多种细胞因子诱导产生。TIMP-2是一种非糖基化蛋白,因与MMP-2有较强的亲和力,故主要抑制MMP-2活性,对其它MMPs也有部分抑制作用。TIMP-3可抑制几乎全部MMPs成员,仅存在于ECM中,是结合于ECM的非可溶性蛋白。TIMP-4属于蛋白类抑制剂,在心脏表达水平较高,主要抑制MMP-2活性,阻止新生血管形成。
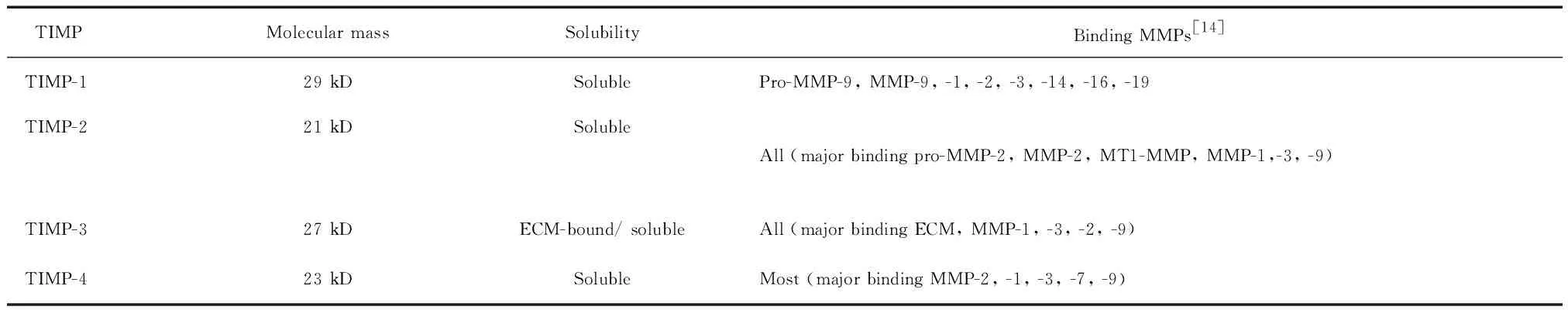
表2 基质金属蛋白酶组织抑制剂的分子量、可溶性和底物
3 MMPs和疾病
正常表达水平的MMPs与生长发育过程中ECM重构、细胞增殖、迁移和黏附等密切相关,参与调控机体多种生理过程。因此,MMPs表达谱发生改变、机体蛋白酶解和抗蛋白酶解平衡异常参与了包括心血管疾病、炎症相关疾病、中枢神经系统疾病和肿瘤等疾病的发病机制和疾病进程。
机体循环系统和微循环系统实时动态地进行血管和微血管结构的重构,这一过程涉及MMPs基因表达和pro-MMPs活化的精确调控。在心血管疾病中,MMPs参与动脉粥样硬化及斑块破裂的病理进程,动脉粥样硬化斑块纤维帽主要由胶原和弹性蛋白构成,MMP-1、MMP-3和MMP-12参与粥样斑块成份的吸收和沉积过程,其表达水平异常可导致粥样斑块稳定性下降[15],甚至发生斑块破裂。此外,动脉粥样硬化的疾病进程发展与MMP-2和MMP-9介导的平滑肌细胞增殖和迁移直接相关[16]。有文献报道,MMPs与心肌梗死[17-18]和心衰[19]的疾病进展相关,可能和心肌病变部位局部炎症因子的诱导MMP-2, -9表达上调有关。因此,有学者主张循环中可溶性MMPs可能成为心血管疾病诊断和预后判断的分子之一。
机体炎症状态下,微循环中募集的免疫炎症细胞(如淋巴细胞)通过分泌炎性因子和血管细胞黏附分子1等黏附至内皮细胞表面,诱导其表达MMPs,促进免疫炎症细胞的跨内皮细胞迁移,同时增加MMPs(MMP-2和 -9)酶活性[20]。T细胞还可通过表面抗原CD40和内皮细胞上的配体结合而激活,促进内皮细胞表达MMPs(MMP-1、MMP-3和MMP-9等)。炎症相关疾病中,类风湿性关节炎关节滑膜胶原的降解可能与关节滑膜中成纤维细胞表达MMP-1和MMP-13有关[21]。MMP-7水平增加可通过IL-17参与慢性炎症发生[22]。此外,炎症介导的组织细胞坏死,组织内细胞外基质异常增多和过度沉积可导致纤维化发生,故MMPs可能参与了如特发性肺纤维化[23]等的疾病进程。
MMPs在肿瘤侵袭和转移过程中的作用与其参与血管生成有关。由于肿瘤生长导致的局部相对缺血缺氧可上调MMPs表达水平(以MMP-9为著)。抑制MMPs可减轻缺血缺氧的损伤程度,同时抑制继发性血管生成。文献报道,MMP-2基因多态性与肿瘤微血管和淋巴管新生有关[24];MMP-14活化可导致小鼠模型和临床肝癌患者肿瘤生长和侵袭[25];MMP-24可作为肺癌和胃癌转移的分子标记[26];而MT1-MMP则与肿瘤细胞侵袭有关[27]。
脑组织ECM结构完整是神经细胞发挥正常生理功能的结构基础。MMPs通过调节脑组织ECM重构,参与了脑膜炎[28]、多发性硬化[29]和阿尔兹海默病[30-31]等疾病的发病机制。MMPs降解脑组织ECM的同时,部分MMPs(MMP-8和MMP-9)可抑制损伤后脑组织修复、破坏血脑屏障,导致脑血管和脑微血管源性水肿。
4 MMPs靶向药物
ECM动态重构对于机体内稳态的维持至关重要,ECM重构过程发生异常时,可能导致疾病的发生,因此,MMPs可作为心血管、炎症和肿瘤等疾病的临床治疗药物靶点之一。MMPs参与维持机体正常生理功能(炎症反应和血管生成等),MMPs广谱抑制剂由于其不可避免的毒副作用在临床实验中表现欠佳[32],筛选针对某一个MMP或某几个MMPs的选择性MMP抑制剂(包括抗体、抗体片段或小分子)成为MMPs靶向药物需要考虑的问题之一。为解决上述毒副作用问题,有学者提出仅在必要时短时间冲击给予MMPs广谱抑制剂的应用方案[33]。MMPs表达水平调控包括基因水平和酶原活化,因此,开发同时具有抑制MMPs基因表达和抑制MMPs酶活性的靶向药物可能成为新的MMPs研究方向,如联合纳米探针-MMPs的生物工程新方案可实现对部分肿瘤组织MMPs的特异性抑制[34]。值得注意的是,并非所有MMPs均促进肿瘤转移,一些MMPs家族成员对肿瘤转移具有显著抑制作用[35]。因此,精确界定特定肿瘤组织中不同MMPs的作用,在MMPs靶向药物筛选中同样至关重要。
目前所述,已有部分MMPs靶向药物在基础和临床实验中展示出较好的疾病治疗效果。MMP-9单克隆抗体GS-5745可使约45%的重度溃疡性结肠炎患者获益[36],结肠炎症得到控制;识别MMP-9第116位色氨酸至214位赖氨酸构成的抗原表位的单克隆抗体REGA-3G12也已进入动物实验阶段[37]。氯毒素Chlorotoxin可选择性抑制MMP-2,胶质细胞瘤高表达MMP-2,因此其可能用于胶质细胞瘤的治疗[38]。选择性MT1-MMP抑制剂DX-2400可抑制MDA-MB-231乳腺癌细胞的生长和代谢,同时增加其对放疗的敏感性[39]。MMP-13选择性抑制剂ALS-1-0635对急慢性关节炎模型动物的关节软骨具有一定的保护作用[40]。上述以MMPs为药物靶点的新药物开发,将有助于为临床实践提供新的诊疗思路。
5 结语
综上所述,MMPs参与机体多种生理和病理进程,其作用模式和调控网络不仅局限于降解ECM的蛋白水解酶范畴。MMPs在心血管疾病、炎症相关疾病、中枢神经系统疾病和肿瘤中的作用已逐渐受到重视。阐明不同疾病中MMPs的表达水平及酶活性、同一疾病在不同疾病进程时MMPs表达水平和酶活性有助于了解MMPs在上述疾病和疾病病理进程中的作用机制。此外, 进一步深入了解不同MMPs与其底物相互作用机制、MMPs和TIMPs间的平衡维持和失衡机制有助于开发新的MMPs靶向药物(如非广谱MMPs特异性抑制剂和选择性MMPs单克隆抗体等),并可能成为疾病治疗新方案之一,具有一定的转化医学价值。

