PKC和ROCK对硝苯地平舒张血管作用的影响*
胡晶晶, 张玉洁, 李荣巧, 梁泰刚, 杨彩红, 李青山△
(山西医科大学 1药学院, 2基础医学院, 山西 太原 030001)
由于心脑血管疾病具有较高的死亡率和致残率,近年来对心脑血管疾病的治疗引发了更多的关注。硝苯地平(nifedipine)作为第一代钙拮抗剂,是治疗心血管疾病高血压、顽固性充血性心力衰竭和心绞痛的一线药。目前认为硝苯地平的主要作用机制是阻止钙内流,抑制血管、支气管和子宫平滑肌的兴奋-收缩偶联,产生松弛血管平滑肌,扩张冠状动脉、周围小动脉及降低外周血管阻力[1]。蛋白激酶C(protein kinase C,PKC)及Rho相关激酶(Rho-associated kinase,ROCK)作为治疗心血管疾病的新靶点,均属丝氨酸/苏氨酸蛋白激酶,是细胞内很重要的信号转导分子。迄今为止,已从哺乳动物中分离出至少12种PKC亚型和20余种Rho家族成员。PKC及ROCK通常以无活性的形式存在于细胞质中,当其激活后从胞质转移至胞膜,并经历一系列复杂的磷酸化过程引发相应的生物学功能改变,参与多种生理和病理过程。活化后的PKC及ROCK参与肌动蛋白骨架的调节和平滑肌细胞收缩等细胞活动,其高表达和异常活化与许多心血管疾病的发生及发展密切相关,如高血压、动脉粥样硬化、心力衰竭和肺动脉高压等[2-3]。PKC及ROCK作为治疗心血管疾病的靶点其活性状态是否会影响硝苯地平的舒张血管作用目前还不清楚,因此,本课题在大鼠离体血管环上研究PKC和ROCK是否与硝苯地平舒血管作用有关。
材 料 和 方 法
1 实验材料
1.1实验仪器与设备 八通道离体组织器官恒温灌流装置(成都泰盟科技有限公司);高灵敏度张力传感器及PowerLab数据采集分析系统(埃德仪器国际贸易有限公司);HH-601超级恒温水浴(常州市顶新实验仪器有限公司);电子天平(上海舜宇恒平科学仪器有限公司);PHS-3C型pH计(上海仪电科学仪器股份有限公司)。
1.2实验动物 SPF级雄性Sprague-Dawley大鼠,体重均为250~300 g,由山西医科大学实验动物中心提供,许可证号为SYXK(晋)2015-0001。动物饲养条件为温度(22±2)℃,湿度45%~60%,自由摄食及饮水。
1.3实验试剂 苯肾上腺素(phenylephrine,PE)、去甲肾上腺素(norepinephrine,NE)、乙酰胆碱(acetylcholine,ACh)、氯化钡(barium chloride,BaCl2)、四乙胺(tetraethylammonium,TEA)、4-氨基吡啶(4- aminopyridine,4-AP)、格列本脲(glibenclamide,Gli)、星孢菌素(staurosporine,STA)、佛波酯(phorbol 12-myristate 13-acetate,PMA)、法舒地尔(fasudil)、血管紧张素 II(angiotensin II,Ang-II)和硝苯地平均购自Sigma。其余试剂均为分析纯。
2 方法
2.1大鼠主动脉血管环的制备[4]大鼠断头处死后,迅速游离主动脉,置于4 ℃、100% O2饱和的生理盐溶液(physiologic salt solution, PSS)中,将分离干净的血管剪成3~4 mm的分段血管环,用2个三角型挂钩贯穿血管环管腔,将其水平置于10 mL浴槽中,浴槽内装有5 mL PSS溶液,37 ℃恒温,并持续通以100%的O2,下端固定,上端连于张力传感器,PowerLab数据采集分析系统记录血管张力变化。将基础张力调至2 g左右,浴槽内每隔15 min换PSS 1次,平衡1 h。制备去内皮血管环时,使用与主动脉内径相当的棉棒穿入血管内摩擦其内壁2次,以求完全去除血管内皮细胞。
2.2血管环内皮功能的检测 用60 mmol/L的KCl预收缩血管环2次,以诱发血管的最大收缩幅度,待血管稳定达到坪值后(即连续2次同样的刺激所引起的收缩幅度差别小于5%),加入PE(10-6mol/L)使血管收缩,稳定后,加入ACh(10-5mol/L),观察血管的舒张情况来检验内皮完整性。以PE刺激收缩后的稳定张力为100%,最大舒张幅度大于70%的血管环即认为血管内皮完整,最大舒张幅度小于5%的血管环即认为血管内皮已去除完全。
2.3硝苯地平对大鼠主动脉环基础张力的影响 基础状态大鼠胸主动脉环用PSS平衡1 h,后加入累积浓度(10-10mol/L、10-9mol/L、10-8mol/L、10-7mol/L、10-6mol/L和10-5mol/L)的硝苯地平或等体积溶剂,观察血管张力变化。
2.4硝苯地平对内皮完整组和去内皮组主动脉环张力的影响 血管环稳定后,内皮完整和去内皮的大鼠胸主动脉环分别经NE(10-6mol/L)和KCl(60 mmol/L)预收缩,张力平衡后,实验组加入累积浓度的硝苯地平,对照组加入等体积溶剂,以分别加入NE和KCl诱发的血管环的最大收缩幅度为100%,计算施加硝苯地平后血管舒张幅度占最大收缩幅度的百分比,建立浓度-效应曲线。
2.5不同K+通道阻断剂、PKC阻滞剂/激动剂和ROCK阻滞剂/激动剂对硝苯地平舒张血管作用的影响 血管环稳定后,分别使用不同的工具药孵育30 min,用NE和KCl预收缩血管,张力平衡后,加入累积浓度的硝苯地平,对照组为不加工具药直接加入累积浓度的硝苯地平,记录相应血管环张力并计算变化值。
2.6硝苯地平对CaCl2量效曲线的影响[5]血管环稳定后,用无钙含EGTA的PSS冲洗20 min,后将浴液更换为无钙不含EGTA的生理盐溶液,10 min后,更换为含KCl(60 mmol/L)无钙的生理盐溶液5 mL,预孵10 min,加入累积浓度(0.1 mmol/L、0.3 mmol/L、1 mmol/L、3 mmol/L和10 mmol/L)的CaC12,观察血管环张力变化。给药组在加CaC12前10 min加入不同浓度(10-9mol/L、5×10-8mol/L、10-6mol/L)的硝苯地平,空白对照组同时加入溶剂。以空白对照组累计加入CaCl2(10 mmol/L)后引起的收缩张力最大值为100%,建立浓度-效应曲线。
2.7硝苯地平对内钙释放引起血管收缩的影响 血管环稳定后,用无钙含EGTA的生理盐溶液冲洗,20 min后,将浴液更换为无钙不含EGTA的生理盐溶液,10 min后,实验组分别加入硝苯地平(10-9mol/L、5×10-8mol/L、10-6mol/L)孵育20 min后,加入NE,空白对照组同时加入等量溶剂,观察血管的收缩情况。
3 统计学处理
采用 SPSS 20.0进行统计分析。结果以均数±标准差(mean±SD)表示。采用GraphPad Prism 6 作浓度-舒张效应曲线,多组间比较釆用one-way ANOVA,以P<0.05为差异有统计学意义。
结 果
1 硝苯地平对基础状态血管环张力的影响
累积浓度硝苯地平对基础状态血管环张力无明显影响,实验组与溶剂组对比,差异无统计学显著性,见图1。

Figure 1.The effect of nifedipine on basic tension of aortic rings. Mean±SD.n=6.
图1硝苯地平对基础状态主动脉张力的影响
2 硝苯地平对NE/KCl预收缩血管环张力的影响
在NE(10-6mol/L)/KCl(60 mmol/L)诱导的血管环收缩反应中,累积浓度硝苯地平对内皮完整组与去内皮组的主动脉血管环均有浓度依赖性舒张作用。内皮完整组最高累积浓度硝苯地平对血管环舒张百分比可达(96.47±6.00)% 和(97.84±2.78)%,去内皮组中的舒张百分比为(94.87±4.28)%和(98.44±1.06)%,两组数据比较差异无统计学显著性,见图2。
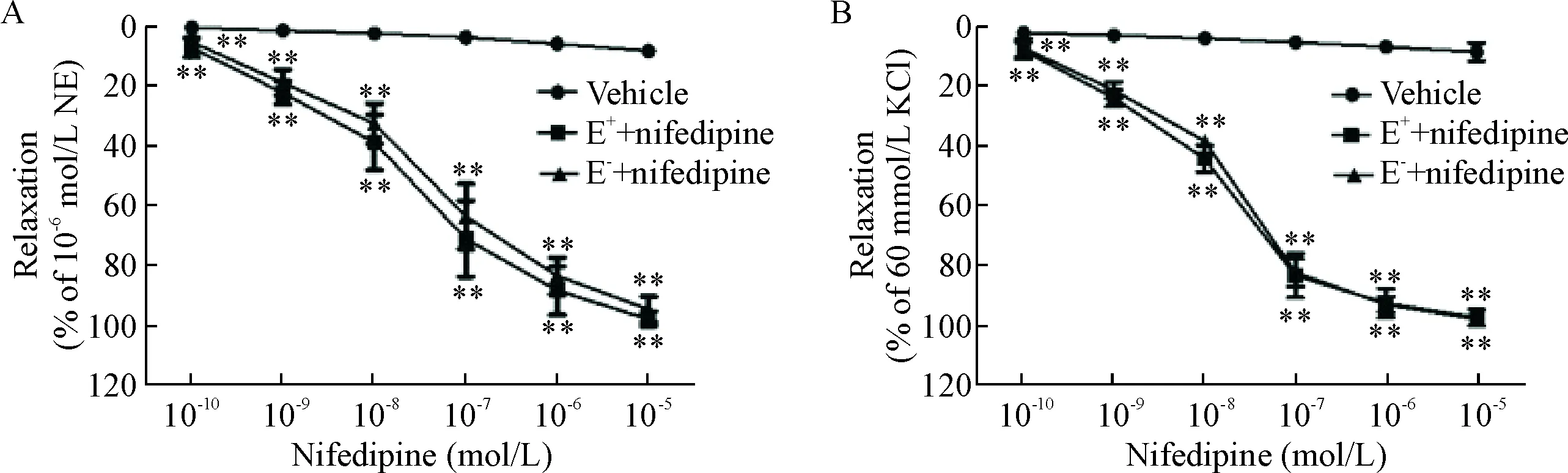
Figure 2.The relaxation effect of nifedipine on endothelium-intact (E+) and endothelium-denuded (E-) aortic rings precontracted with 10-6mol/L NE (A) or 60 mmol/L KCl (B). Mean±SD.n=6.**P<0.01vsvehicle group.
图2硝苯地平对NE和KCl预收缩血管环张力的影响
3 K+通道阻断剂对硝苯地平舒张血管作用的影响
预孵Kir通道阻断剂BaCl2(10-4mol/L)、KCa通道阻滞剂TEA(10-3mol/L)、KATP通道阻断剂Gli(10-5mol/L)和KV通道阻断剂4-AP(10-3mol/L),在NE(10-6mol/L)诱导的血管环收缩反应中,最高累积浓度硝苯地平对血管环舒张百分比分别为(93.19±1.88)%、(97.05±1.86)%、(95.84±2.68)%和(94.77±2.39)%,与未加阻断剂的硝苯地平组比较,差异均无统计学显著性;在KCl(60 mmol/L)诱导的血管环收缩反应中,最高累积浓度硝苯地平的最大舒张率分别为(95.04±3.79)%、(98.29±2.32)%、(98.29±2.32)%和(98.74±0.76)%,与未加阻断剂的硝苯地平组比较,差异亦均无统计学显著性,见图3。
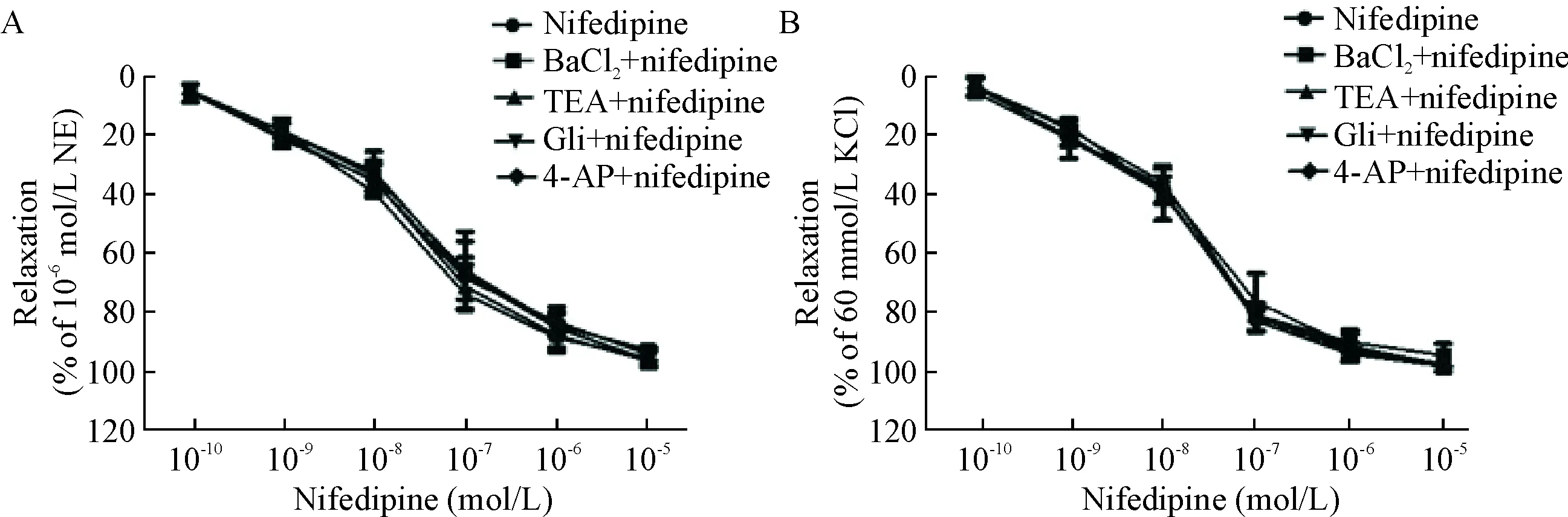
Figure 3.The effects of pretreatment with BaCl2(10-4mol/L), TEA (10-3mol/L), Gli (10-5mol/L) and 4-AP (10-3mol/L) on the vasodilation effect of nifedipine in endothelium-intact aortic rings contracted by 10-6mol/L NE (A) or 60 mmol/L KCl (B). Mean±SD.n=6.
图3钾通道阻断剂对硝苯地平舒张血管作用的影响
4 PKC对硝苯地平舒张血管作用的影响
在NE(10-6mol/L)/KCl(60 mmol/L)诱导的血管环收缩反应中,使用PKC抑制剂STA(10-8mol/L)后,最高累积浓度硝苯地平作用增强对血管环舒张百分比可达(101.99±0.81)%和(112.04±4.05)%,而PKC激动剂PMA(10-7mol/L)则能减弱硝苯地平对血管的舒张作用,最高累积浓度硝苯地平对血管环舒张百分比降低为(61.38±8.15)%和(84.92±2.65)%,与硝苯地平组比较,差异均有统计学意义(P<0.01),见图4。
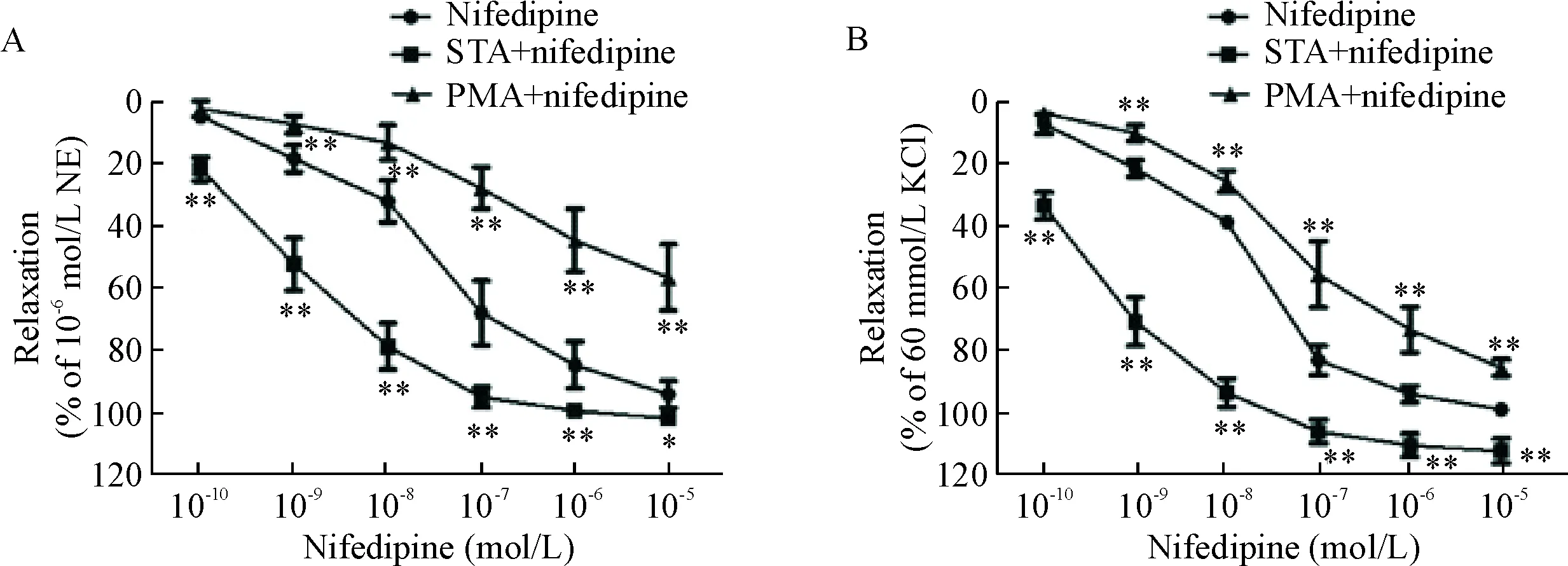
Figure 4.The effects of pretreatment with STA (10-8mol/L) and PMA (10-7mol/L) on the vasodilation effect of nifedipine in endothelium-intact aortic rings contracted by 10-6mol/L NE (A) or 60 mmol/L KCl (B). Mean±SD.n=6.*P<0.05,**P<0.01vsnifedipine group.
图4PKC对硝苯地平舒张血管作用的影响
5 ROCK对硝苯地平舒张血管作用的影响
在NE(10-6mol/L)/ KCl(60 mmol/L)诱导的血管环收缩反应中,ROCK抑制剂fasudil(10-6mol/L)能增强硝苯地平对血管的舒张作用,使用后最高累积浓度硝苯地平对血管环舒张百分比可达(103.67±2.36)%和(100.22±4.12)%,其激动剂Ang-II(10-9mol/L)则能降低硝苯地平对血管的舒张作用,其最大舒张率分别为(63.34±4.35)%和(70.61±3.17)%,与硝苯地平组比较,差异均有统计学意义(P<0.01),见图5。
6 硝苯地平对CaCl2量效曲线的影响
在含KCl(60 mmol/L)的无钙生理盐溶液中累计加入CaCl2,得到CaCl2的量效曲线。实验组预先用硝苯地平(10-9mol/L、5×10-8mol/L和10-6mol/L)分别预孵可浓度依赖性地减弱CaCl2对血管环的收缩效应,与对照组比较,差异均有统计学意义(P<0.01),见图6。
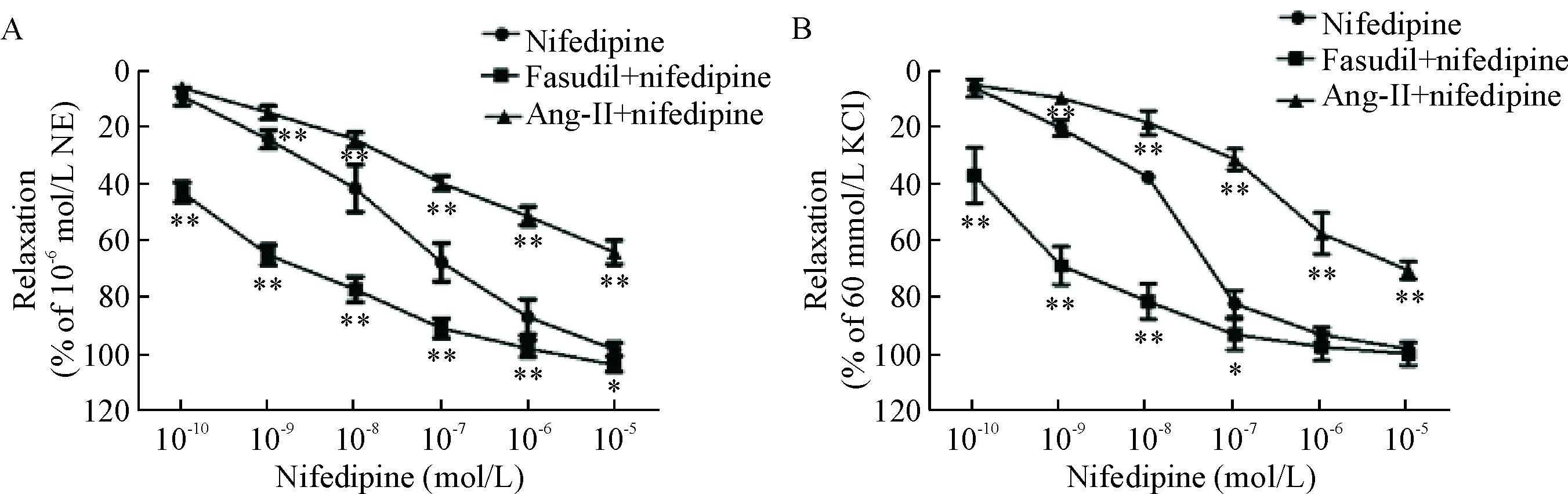
Figure 5.The effects of pretreatment with fasudil (10-6mol/L) and Ang-II (10-9mol/L) on the vasodilation effect of nifedipine in endothelium-intact aortic rings contracted by 10-6mol/L NE (A) or 60 mmol/L KCl (B). Mean±SD.n=6.*P<0.05,**P<0.01vsnifedipine group.
图5ROCK对硝苯地平舒张血管作用的影响
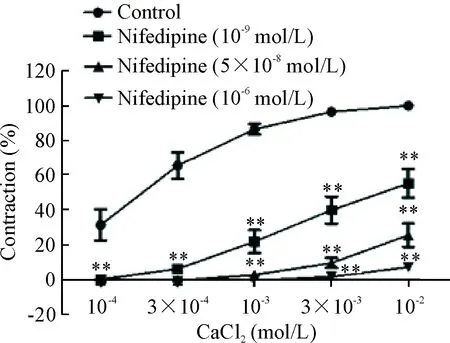
Figure 6.Inhibitory effect of nifedipine (10-9mol/L, 5×10-8mol/L and 10-6mol/L) on the contraction curves dependent on extracellular Ca2+addition (0.1~10 mmol/L) in endothelium-denuded, KCl-stimulated aortic ring preparations incubated in the Ca2+-free medium. Mean±SD.n=6.**P<0.01vscontrol group.
图6硝苯地平对CaCl2量效曲线的影响
7 硝苯地平对内钙释放引起血管收缩的影响
在无钙生理盐溶液中,用硝苯地平(10-9mol/L、5×10-8mol/L和10-6mol/L)预处理不能减弱NE对血管的收缩作用,与对照组比较,差异均无统计学显著性,见图7。
讨 论
PKC和ROCK作为细胞内重要的信号转导分子,与许多心血管疾病的发生及发展密切相关,如高血压、动脉粥样硬化、心力衰竭、肺动脉高压等[6-7]。目前认为这2种激酶在心血管系统的多种作用,是治疗心血管管疾病的新靶点。硝苯地平可用于多种疾病,如高血压、心绞痛、心肌梗塞、充血性心力衰竭等心血管疾病,也可用于呼吸系统、消化系统和泌尿系统疾病[1,8]。本实验旨在研究PKC及ROCK作为心血管疾病的治疗靶点,其活性是否会影响硝苯地平对血管的舒张作用。
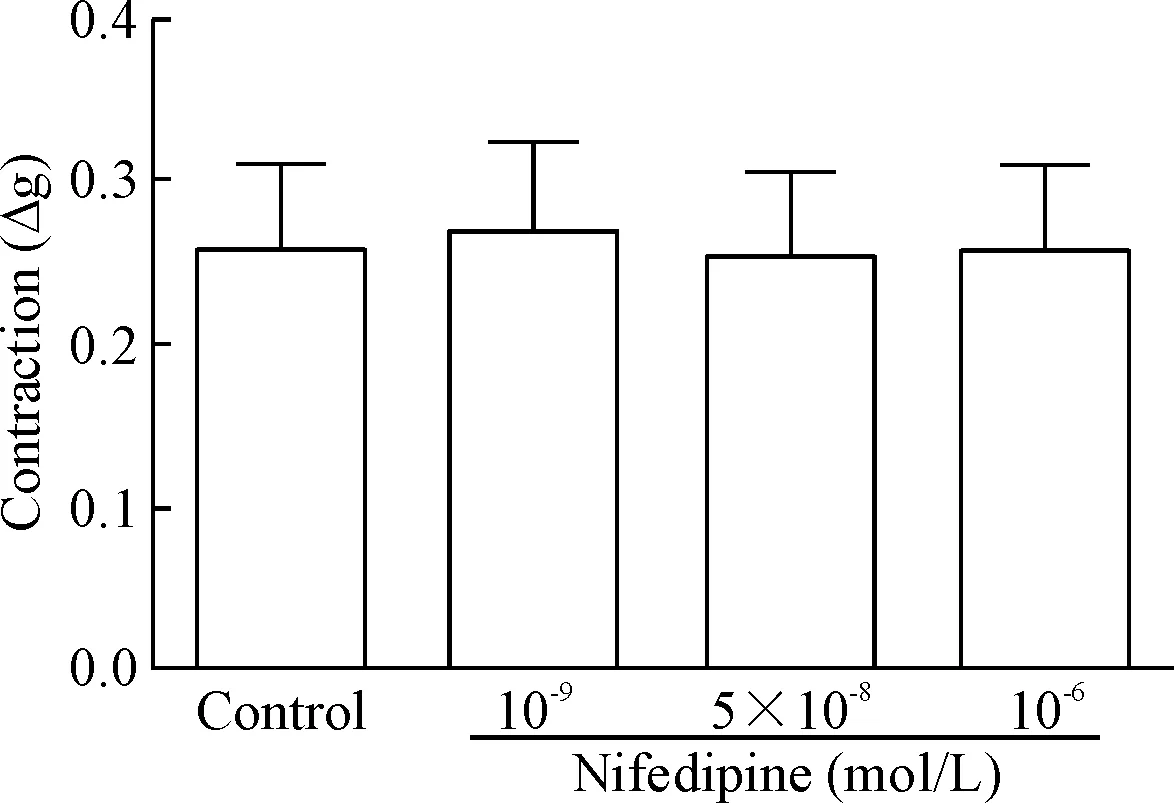
Figure 7.The effects of nifedipine (10-9mol/L, 5×10-8mol/L and 10-6mol/L) on contraction via NE (10-6mol/L) in Ca2+-free solution. Mean±SD.n=6.
图7硝苯地平对内钙释放的影响
研究发现,PKC与ROCK共存于同一细胞内信号通路,且在ROCK上游发挥作用[9]。ROCK的经典底物是肌球蛋白轻链20(myosin light chain 20,MLC20)和肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP),它们是参与细胞舒缩运动的重要蛋白分子。在血管平滑肌细胞(vascular smooth muscle cells,VSMCs)中,ROCK能够直接激活MLC20,也能抑制MLCP的活性,间接增加MLC20磷酸化水平,进而使VSMCs收缩[10]。本研究结果显示,ROCK抑制剂fasudil(10-6mol/L)及PKC抑制剂STA(10-8mol/L)可以明显增大硝苯地平的舒血管作用,表明ROCK和PKC可能协同介导血管收缩作用;而预孵ROCK激动剂Ang-II(10-9mol/L)及PKC激动剂PMA(10-7mol/L)能够使硝苯地平的舒血管作用减弱,表明硝苯地平的舒张血管作用可能与抑制PKC-ROCK信号通路有关。研究发现,平滑肌所特有的分子量17 kD的PKC增强蛋白磷酸酶1抑制物(PKC-potentiated protein phosphatase 1 inhibitor of 17 kD,CPI-17)也是ROCK的重要底物之一,活化状态的ROCK能磷酸化CPI-17,后者与MLCP结合,掩盖MLCP的靶亚基1从而抑制MLCP的活性,促进平滑肌细胞的收缩,这种收缩与Ca2+浓度无关,为钙非依赖性调节,即Ca2+敏化过程[11]。由PKC介导的Ca2+增敏机制也不依赖于Ca2+的内流[12]。PKC主要通过直接激活MLCK及ROCK参与血管的收缩反应,CPI-17作为钙离子敏感性的潜在介质,亦能被PKC磷酸化,进而抑制MLCP的活性,间接增加MLC20的磷酸化水平,进而促进血管收缩。也就是说CPI-17作为ROCK和PKC的共同底物参与激动剂诱导的血管平滑肌细胞收缩,与钙敏感性有关[13]。ROCK激动剂Ang-II(10-9mol/L)及PKC激动剂PMA(10-7mol/L)能够使硝苯地平的舒血管作用减弱,可能干扰了ROCK及PKC介导的收缩蛋白对Ca2+增敏的过程。
血管的舒张不仅与PKC、ROCK等信号密切相关,也与血管内皮细胞、血管平滑肌上的钾通道、钙通道等密切相关,为排除相关因素的影响,我们进一步研究了硝苯地平对内皮、离子通道的作用。结果发现,硝苯地平对基础状态下血管环的静息张力无明显作用,对KCl及NE预收缩内皮完整和去内皮血管环具有明显的舒张作用,且呈浓度依赖性,内皮完整组与去内皮组比较无明显差异。因此,硝苯地平对血管的舒张作用可能与血管内皮细胞无关,而是直接作用于血管平滑肌。
血管平滑肌的舒缩活动跟其上的钾通道活性密切相关,钾通道活性的改变可引起血管平滑肌细胞膜电位的去极化或超极化,从而改变VSMCs的膜电位及兴奋性[14-15]。为排除钾通道在硝苯地平舒血管中的作用,我们使用了Kir阻断剂(BaCl2,10-4mol/L)、 KCa阻断剂(TEA,10-3mol/L)、 KATP阻断剂(Gli,10-5mol/L)和KV阻断剂(4-AP,10-3mol/L),结果发现均不能抑制硝苯地平的舒张血管作用,提示硝苯地平的舒血管作用可能与4种钾通道无关。
血管平滑肌上的电压依赖性钙通道和受体操纵性钙通道,可分别被高钾和NE激活。在无钙环境中,用高浓度的KCl使血管去极化,硝苯地平能够浓度依赖性地抑制该情况下由CaCl2引起的血管收缩。由此表明,硝苯地平可以抑制Ca2+通过电压依赖钙通道内流,从而使细胞内Ca2+浓度降低,进而引起血管舒张。在无钙的生理盐溶液中,用硝苯地平预处理不能减弱NE对血管的收缩作用,而在有钙的环境下硝苯地平能够明显抑制NE刺激主动脉环引起的收缩,表明硝苯地平可拮抗外钙内流,介导其对血管的舒张作用,其舒张血管的作用与内钙释放无关。

