依达拉奉对急性脑缺血/再灌注大鼠AQP4和Aβ表达及MMP-2和MMP-9活性的影响*
刘 菡, 罗永杰
(1西南医科大学, 四川 泸州 646000; 2四川省医学科学院, 四川省人民医院神经内科, 四川 成都 610000)
急性缺血性脑卒中(acute ischemic stroke,AIS)是严重威胁我国国民健康的脑血管疾病之一,具有高死亡率和高致残率,且其发病呈逐年升高的趋势,成为临床上亟待攻克的焦点问题之一[1-3],而恢复AIS脑组织血液灌注极易引起缺血/再灌注(ische-mia/reperfusion,I/R)损伤[4]。依达拉奉(edaravone)是一种自由基清除剂,能控制脑水肿,并能减轻脑组织缺血再灌注损伤,常用于治疗脑梗死[5-6]。目前虽然关于依达拉奉治疗脑梗死的研究较多,但关于依达拉奉对急性缺血性脑卒中神经保护的机制依然不太明确,因此探讨依达拉奉对急性脑缺血/再灌注大鼠的实验效果及其作用机制,为其在AIS临床治疗方面提供理论根据。
材 料 和 方 法
1 实验动物
选取健康雄性SPF级SD大鼠136只,体质量180~200 g,平均(190.0±5.5) g,所有实验动物均喂养在光照12 h,湿度45%~60%,温度23 ℃~25 ℃,动物许可证号为SCXK(滇)2016-0014,饲养在自由进食进水的环境中。
2 药品和试剂
依达拉奉(20 mL∶30 mg,批号141109)购自昆明积大制药有限公司;TRIzol购自Invitrogen;引物合成由北京华大基因公司合成;qPCR试剂为大连宝生物SYBR® Premix Ex TaqTM试剂盒;抗水通道蛋白4(aquaporin 4,AQP4)多克隆抗体和抗β-淀粉样蛋白(amyloid β-protein,Aβ)多克隆抗体购自Proteintech。
3 方法
3.1大鼠局灶性脑缺血再灌注的造模方法 采用Longa改良线栓法构建大鼠局灶性脑缺血再灌注模型,模拟急性缺血性脑卒中治疗[7]。用 10%水合氯醛(300 mg/kg)腹腔注射将大鼠麻醉后固定,取颈正中切口,分离并结扎右侧颈总动脉、颈外动脉,在右侧颈总动脉近交叉约5 mm处剪一个小口,用直径0.28 mm的鱼线插入颈内动脉,遇轻微阻力止,插入深度为20~22 mm,近端打活结,阻断右侧大脑中动脉血流,缝合皮肤。拴塞2 h后,拔出10 mm鱼线行再灌注;假手术(sham)组大鼠制备颈内动脉不插鱼线,其余操作同手术组;低剂量(low dose)组和高剂量(high dose)组大鼠于术前30 min腹腔注射依达拉奉6 mg/kg和依达拉奉10 mg/kg,造模后每24 h 腹腔注射给药1次,假手术组给予等量生理盐水,模型(model)组造模后给予等量生理盐水。采用Longa法对动物模型进行鉴定:纳入模型组、低剂量和高剂量组中大鼠清醒后(术后60 min)行走时向损伤对侧旋转和行走时向损伤对侧倾倒的大鼠,排除无自发活动或死亡大鼠,其中排除模型组1只当场死亡,1只无自发活动;假手术组、低剂量组和高剂量组各2只无自发活动,以上均是手术操作不当所致,共纳入SD大鼠128只进行研究。
3.2神经功能评分 采用Zea Longa 法对造模成功的大鼠6 h、1 d、2 d、3 d和7 d后的神经功能评价。无神经功能障碍,活动正常为0分;提尾部时不能完全伸展对侧前爪为1分;爬行时向损伤侧旋转为2分;爬行时向对侧倾倒为3分;无法活动或意识不清为4分。
3.3TTC法测定脑梗死体积 实验结束后,断头处死大鼠,分离脑组织,-20 ℃冰冻30 min,连续制作2 mm厚度冠状面5片切片。将脑组织切片立即悬置于2% TTC溶液中,37 ℃避光孵育30 min。随后置于4%多聚甲醛溶液浸泡固定2 h。梗死区呈白色,正常区呈玫瑰红色。应用病理图文报告分析系统测出脑梗塞体积百分比。
3.4脑组织含水量 大鼠断头取全脑,采用电子天平精密称量湿重;置全脑于组织真空烘箱,烘至恒重,电子天平精密称量干重。脑组织含水量(%)=(湿重-干重)/ 湿重×100%。
3.5RT-qPCR检测AQP4和Aβ mRNA的相对表达量 取梗塞区脑组织约100 mg,参照TRIzol说明书采取一步法提取总RNA,检测样本中 RNA 纯度合格,然后反转录合成 cDNA。以cDNA为模板,用ABI 7500 Fast型real-time PCR仪进行PCR扩增。AQP4的正向引物序列为5’-GTGCTAGGAAACTGATATG-3’,反向引物序列为5’-TCTGGTGTAGTACATTCAA-3’;Aβ的正向引物序列为5’-CGGGATCCGATGCAGAATTCCGACATGACTCAG-3’,反向引物序列为5’-ACGCGTCGACCTACGCTATGCAACACCGCCCA-3’; GAPDH 的正向引物序列为5’-CGACCACTTTGTCAAGCTCA-3’,反向引物序列为5’-AGGGGTCTACATGGCAACTG-3’。 反应条件:先用95 ℃孵育5 min;进行35个循环(94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s)。GAPDH为内参照,采用2-ΔΔCt法分析基因相对表达量。
3.6Western blot实验 冰上裂解梗死区组织匀浆后,12 000×g离心10 min,吸取上清液,萃取总蛋白,用 BCA 蛋白质定量试剂盒检测蛋白含量。蛋白煮沸变性后,上样60 μg,进行SDS-PAGE分离蛋白,经转膜、封闭。室温孵育 I 抗AQP4(1∶2 000)、Aβ(1∶1 000)和GAPDH(1∶4 000) 2 h后,用TBST洗3次,每次5 min;孵育对应的 II 抗1.5 h,用TBST洗3次,每次10 min。使用避光ECL显色检测蛋白条带。以Quantity One 软件进行图像灰度值分析,以GAPDH为内参照,校正各组Aβ和AQP4的灰度值。
3.7明胶酶谱检测基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9的活性 冰上裂解梗死区组织匀浆后,12 000×g离心10 min,吸取上清液,萃取总蛋白,用 BCA 蛋白质定量试剂盒检测蛋白质含量。按照基质金属蛋白酶(MMP2/9)明胶酶谱法试剂盒说明操作。蛋白直接上样60 μg,进行SDS-PAGE分离,电泳结束后,将凝胶置于洗脱液洗3次,每次10 min,将凝胶置于孵育液中,37 ℃孵育6 h;孵育结束后,经0.05%考马斯亮蓝染色2 h,然后脱色2 h,用凝胶图像分析系统分析灰度值。
3.8HE染色病理学观察 分离梗死区脑组织,生理盐水冲洗,将完整脑组织放入4%多聚甲醛中固定。在真空组织脱水机内进行梯度乙醇浸润脱水,二甲苯透明处理,置于60 ℃液蜡I、II中分别浸润透蜡1.5 h,包埋后放至冷却,制成蜡块置于4 ℃保存片,切片(厚度为4 μm),苏木素染色5 min,蒸馏水洗浸泡1 min,1%盐酸分化45 s,蒸馏水浸泡5 min,伊红复染5 min,脱水后,光镜下观察病变区脑组织病理变化。
4 统计学处理
统计软件采用SPSS 16.0,采用均数±标准差(mean±SD)进行统计描述,多组间比较采用单素方差分析,组间两两比较采用Bonferroni校正的t检验,以P<0.05表示差异有统计学意义。
结 果
1 各组大鼠神经功能评分的比较
术后模型组大鼠的神经功能评分逐渐升高(P<0.05),3 d后再降低(P<0.05),且在2 d时神经功能评分最高(P<0.05);与模型组相比,依达拉奉预处理组的神经功能评分明显降低(P<0.05),且高剂量组降低最明显(P<0.05),见图1。
Figure 1.The neurological function scores of different groups. Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
图1各组大鼠神经功能评分
2 各组大鼠脑组织含水量的比较
术后模型组大鼠的脑组织含水量变化的差异均不具有统计学显著性。与模型组相比,依达拉奉预处理能明显预防脑水肿(P<0.05);相对于低剂量组,高剂量组在术后1~3 d的脑组织含水量明显降低(P<0.05),而术后7 d的差异差异无统计学显著性(P>0.05),见图2。
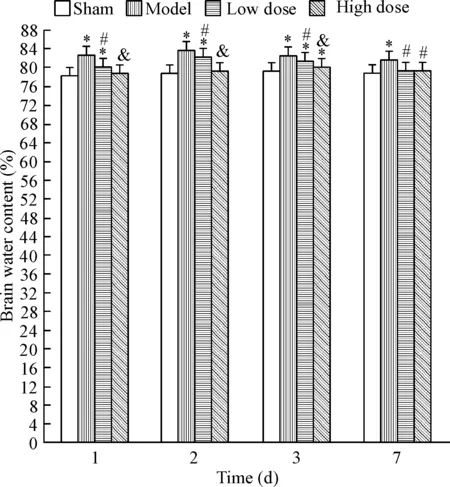
Figure 2.The brain water content in different groups. Mean±SD.n=3.*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
图2各组大鼠脑组织含水量
3 各组大鼠脑梗死体积的比较
术后模型组大鼠的脑梗死体积逐渐升高(P<0.05),后稍微降低(P<0.05),且在术后2 d梗死体积最高(P<0.05);与模型组相比,依达拉奉预处理组的脑梗死体积明显降低(P<0.05),且高剂量组降低最明显(P<0.05),见图3。
4 各组大鼠脑组织病理形态的比较
假手术组未见明显变化;术后模型组大鼠的脑梗死区出现细胞核固缩,脑组织水肿十分明显,且在术后2 d出现大量白细胞浸润,术后7 d症状有所减轻;与模型组相比,依达拉奉预处理组的脑梗死白细胞浸润明显减轻,且高剂量组在术后7 d,白细胞浸润基本消失,见图4。
5 各组大鼠脑梗死区组织AQP4 和Aβ mRNA水平的比较
术后1 d和2 d,与假手术组相比,模型组AQP4和Aβ的mRNA水平明显升高(P<0.05);与模型组相比,依达拉奉预处理组AQP4和Aβ的mRNA水平明显降低(P<0.05),且高剂量组降低最明显(P<0.05),见表1。
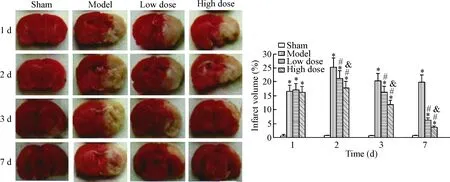
Figure 3.Typical macrographs of TTC staining in different groups. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
图3各组大鼠脑组织的TTC染色观察
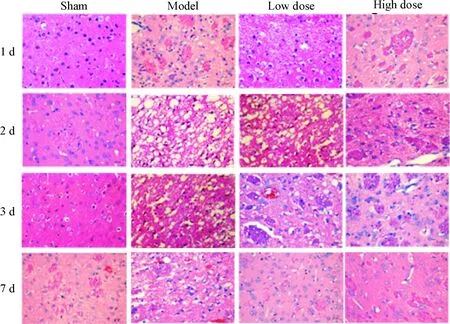
Figure 4.Typical histological images with HE staining of different groups (×200).
图4各组大鼠脑组织HE染色结果
表1各组大鼠脑梗死区AQP4和AβmRNA水平的比较
Table 1.The mRNA levels of AQP4 and Aβ in different groups (Mean±SD.n=5)
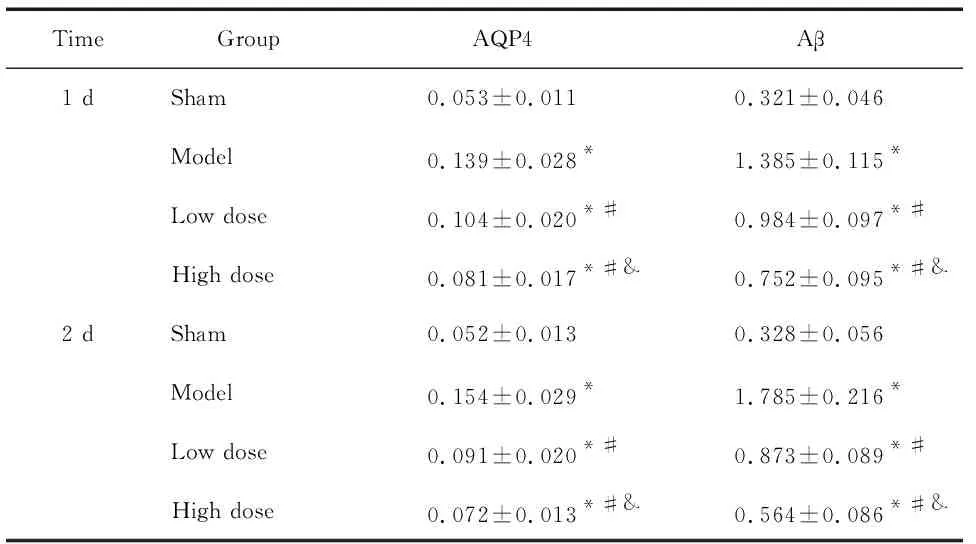
TimeGroupAQP4Aβ 1 dSham0.053±0.0110.321±0.046Model0.139±0.028*1.385±0.115*Low dose0.104±0.020*#0.984±0.097*#High dose0.081±0.017*#&0.752±0.095*#&2 dSham0.052±0.0130.328±0.056Model0.154±0.029*1.785±0.216*Low dose0.091±0.020*#0.873±0.089*#High dose0.072±0.013*#&0.564±0.086*#&
*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
6 各组大鼠脑组织中AQP4和Aβ蛋白水平的比较
术后1 d和2 d,与假手术组相比,模型组的AQP4蛋白和Aβ 蛋白水平明显升高(P<0.05);与模型组相比,依达拉奉预处理组的AQP4蛋白和Aβ 蛋白水平明显降低(P<0.05),且高剂量组降低最明显(P<0.05),见图5。
7 各组大鼠脑组织中MMP2和MMP9活性的比较
术后1 d和2 d,与假手术组相比,模型组的MMP2和MMP9活性明显升高(P<0.05);与模型组相比,依达拉奉预处理组的MMP2和MMP9活性明显降低(P<0.05),且高剂量组降低最明显(P<0.05),见表2。
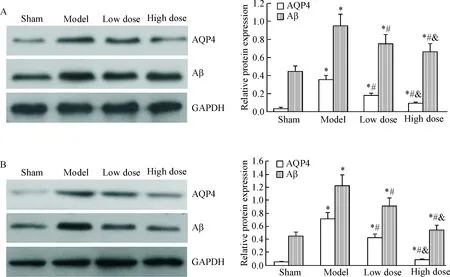
Figure 5.The protein levels of AQP4 and Aβ in different group. A: 1 d after operation; B: 2 d after operation. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
图5各组大鼠的脑梗死区中AQP4蛋白和Aβ蛋白水平的比较
表2各组大鼠脑梗死区MMP2和MMP9活性的比较
Table 2.The activity of MMP2 and MMP9 in different groups (Mean±SD.n=5)
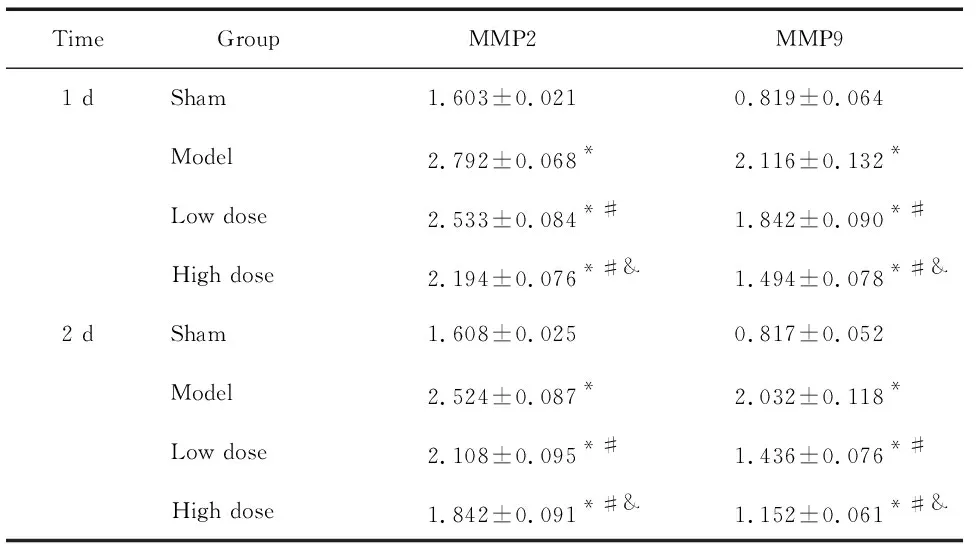
TimeGroupMMP2MMP9 1 dSham1.603±0.0210.819±0.064Model2.792±0.068*2.116±0.132*Low dose2.533±0.084*#1.842±0.090*#High dose2.194±0.076*#&1.494±0.078*#& 2 dSham1.608±0.0250.817±0.052Model2.524±0.087*2.032±0.118*Low dose2.108±0.095*#1.436±0.076*#High dose1.842±0.091*#&1.152±0.061*#&
*P<0.05vssham group;#P<0.05vsmodel group;&P<0.05vslow dose group.
讨 论
急性缺血性脑卒是人类死因排名第2位的脑血管疾病,具有高死亡率和高致残率,且其发病呈逐年升高的态势[1-2]。而对于AIS的治疗是及早恢复脑组织血液灌注,而血液恢复灌注极易出现I/R损伤[4]。脑I/R损伤不仅能产生过度自由基,还能导致脑水肿发生[8-9],而脑水肿不仅是脑I/R损伤的病理生理机制之一,而且与患者病情进程相关,脑水肿机械占位损伤和继发性损伤是引起患者死亡的主要原因[9-10]。AQP4作为一种双向水转运通道蛋白,与脑水肿的发生发展关系密切,是脑水肿形成以及消退的重要分子[11-12],早期AIS出现细胞毒性脑水肿,且伴随轻度血管源性脑水肿,后者可导致脑中风患者病情加重以及恶化,甚至引起患者死亡,因此是否能有效控制脑水肿是治疗的关键[13]。依达拉奉具有减轻脑水肿、减轻脑组织缺血再灌注损伤,保护脑组织及改善预后的作用[14]。研究发现,依达拉奉预处理能有效降低急性脑缺血/再灌注大鼠神经功能评分,神经功能障碍;且进一步研究发现,依达拉奉预处理能有效降低脑组织含水量,减轻脑水肿;对脑梗死区脑组织AQP-1的mRNA和蛋白的表达水平检测发现,依达拉奉预处理能有效降低脑组织AQP-1 的mRNA和蛋白的表达水平。
近来研究发现AIS的发生与Aβ沉积相关[15]。在AIS早期Aβ沉积与炎症因子存在相互促进关系,脑I/R损伤产生过度自由基,介导小胶质细胞炎症反应促使炎症因子快速释放,导致Aβ沉积,后者又促使炎症因子级联放大,加重神经组织损伤[16],且Aβ沉积能导致血脑屏障通透性增加,又进一步导致脑水肿的发生[17]。本研究发现,急性脑缺血/再灌注大鼠术后1 d和2 d脑组织Aβ mRNA和蛋白水平明显升高,依达拉奉预处理能有效降低急性脑缺血/再灌注大鼠脑组织Aβ蛋白沉积;进一步通过HE染色观察脑组织病理结构变化,结果显示依达拉奉预处理能有效降低白细胞侵润,减轻组织学损伤。
有研究证明,MMP2和MMP9在星形胶质细胞和内皮细胞中至关重要,二者水平含量的升高可导致神经细胞损伤,进而导致脑水肿[18]。因此本文对比考察各组二者的水平,结果显示,依达拉奉预处理能有效降低急性脑缺血/再灌注大鼠脑组织MMP2和MMP9活性,提示依达拉奉可抑制MMP2和MMP9的活性,改善急性脑缺血/再灌注预后。
综上所述,本文通过研究依达拉奉能显著降低急性脑缺血/再灌注大鼠AQP4和Aβ的mRNA和蛋白水平,抑制MMP-2和MMP-9活性,进而抑制神经功能障碍、脑组织学损伤和脑水肿,但具体机制仍需作进一步研究。

