大鼠牙胚来源外胚间充质干细胞中p75NTR时钟节律性表达*
杨 琨,李 骏,丰奇昊,沈梦杰,陈谦谦,罗雅馨,刘 琪△,温秀杰(.遵义医科大学附属口腔医院牙周科,贵州遵义 563000;.遵义医科大学附属口腔医院种植科,贵州遵义 563000;3.陆军军医大学大坪医院口腔科,重庆 40004)
颅神经嵴来源的外胚间充质干细胞(EMSCs),是除牙釉质以外所有牙齿组织的生成细胞,被认为是牙源性干细胞的始祖细胞。在胚胎发育过程中由颅神经嵴迁移至上、下颌突,与牙源性上皮相互作用形成牙囊和牙乳头,进而分化为多种牙齿组织生成细胞,形成牙本质、牙髓、牙骨质、牙周膜和牙槽骨[1]。牙源性的EMSCs在牙齿发生、发育过程中起着至关重要的作用,并具有向多种牙齿组织细胞分化潜能的特点。2004年,国内学者分离并成功培养出第一腮弓来源及颌突来源的颅神经嵴源性EMSCs[2⁃3],使研究者对牙胚发育时期的始祖细胞研究有了长足的发展。针对EMSCs的研究发现,在体外培养过程中,EMSCs能够自然向成骨细胞及平滑肌细胞分化,细胞的成分比较复杂,不太适合作为单纯来源的组织细胞进行研究[4]。
但是,以往的研究已经认为p75神经营养因子受体(p75NTR)是神经嵴源性干细胞的特异性表面标志物[5]。因此,前期研究对牙胚来源的EMSCs用p75NTR抗体进行流式分选与纯化,获得了细胞形态较为均一,代表高纯度神经嵴源性的p75NTR阳性EMSCs(p75+EMSCs),为研究牙齿发生、发育机制提供了一个良好的体外细胞模型[6]。进一步研究显示,p75+EMSCs体外未发现明显的自然分化迹象,且其增殖能力强、稳定,显示了其较适合作为种子细胞应用于牙组织工程[7⁃8]优势。并且有前期研究还证明,p75NTR与Mage⁃D1的结合能够影响EMSCs的矿化能力[9],这就进一步引发了作者的思考:牙齿发育过程中形成的周期性矿化间隙纹路—牙体硬组织生长线的形成机制是否受到p75NTR的调控。
1 材料与方法
1.1 一般材料 DMEM⁃F12培养基、胰酶(Gibco,美国),胎牛血清(Gibco,美国),鼠抗人 CD14、CD29、CD44、CD45、CD90、CD105、CD146、CD166,p75NTR 单克隆抗体(Abcam,美国),细胞RNA提取试剂盒、RT⁃PCRmix试剂盒(Takara,日本),体式显微镜、倒置相差显微镜及照相系统(OLYMPUS,日本),流式细胞分析仪(Beckmen Coulter,美国),实时荧光定量聚合酶链式反应(Real Time⁃PCR)仪器(Applied Biosystems,美国)。
1.2 方法
1.2.1 大鼠胚胎发育18.5 d牙胚来源EMSCs培养和分离及表面分子鉴定 SD大鼠孕18.5 d牙胚来源EMSCs(胚胎发育18.5 d EMSCs):在大鼠孕18.5 d午间以40 mg∕kg腹腔注射2%戊巴比妥钠,取出数个胚胎,置入6 cm培养皿,剥离羊膜后头身分离,后分离上下颌,于体式显微镜下固定点位,剥开软骨组织,眼科镊取出牙胚组织,置入装有5 mL磷酸缓冲盐溶液(PBS)的15 mL离心管,摇晃清洗后离心,加入1 mL 1%Ⅰ型胶原酶置入孵箱内消化30 min,中和离心(1 000 r∕min)3 min,去上清液后将组织均匀平铺于6 cm培养皿中,加入含100 mL∕L胎牛血清的DMEM⁃F12培养液4~5 mL,置于含5%CO2的恒温箱中静置贴壁培养,37℃,约24 h后显微镜下可见细胞从组织块中爬出并贴壁生长。
取生长状态良好的第3代胚胎发育18.5 d EMSCs,常规消化离心后,稀释并计数,细胞数量为每1.5毫升EP管5×105个,加入已配制好的含3%胎牛血清(FBS)⁃PBS 重悬细胞,加入 CD14、CD29、CD44、CD45、CD90、CD105、CD146、CD166 及 p75NTR 单克隆抗体 2 μL,4℃冰箱避光孵育 12 h(过夜),12 000 r∕min离心 5 min,加入单抗相对应的荧光二抗避光孵育2 h,无须荧光,加入等量PBS。加入含3%FBS的PBS混合均匀溶液,吹匀,3%FBS⁃PBS 清洗,12 000 r∕min 离心 5 min,清洗 2~3 次后加 300 μL 3%FBS⁃PBS,重悬,流式细胞仪检测各组细胞表面分子。实验重复次数大于3次。
1.2.2 大鼠胚胎发育18.5 d牙胚来源EMSCs流式分选 取P1代EMSCs生长至汇集率90%,按照抗体使用说明书,用自带荧光p75NTR抗体标记消化均匀的EMSCs,4℃孵育半小时后,流式细胞技术分选,收集p75NTR阳性细胞,进行相应实验研究。
1.2.3 p75NTR阳性EMSCs血清休克实验 取分选后培养至第3代的p75NTR阳性EMSCs,按照以往文献[13]方法进行血清休克实验模拟体内节律性,简要说明:50%马血清加入细胞中2 h进行血清高浓度刺激后弃除,用无血清单纯的DMEM∕F12进行培养至指定时间点 0、4、8、12、16、20、24 h 进行细胞收集。实验重复次数大于3次。
1.2.4 RealTime⁃PCR 检测 p75NTR、NGF、clock、per1、per2、Bmal1在24 h内不同时间点的表达量 p75NTR阳性细胞培养不同时间(0、4、8、12、16、20、24 h)点后进行细胞收集,按TRIzol说明书方法提取EMSCs总RNA,并用反转录试剂盒合成cDNA。参照GenBank数据库,以Primer primer 5.0计算机软件设计引物;以甘油醛⁃3⁃磷酸脱氢酶(GAPDH)为内参照,采用 RealTime⁃PCR 检测,反应体系为:premix 10 μL、dye 0.4 μL、ddH2O 6.6 μL、上下游引物各 0.5 μL、样本模板 2.0 μL;反应条件参照产品说明。实验重复3次,所用引物均由上海生工公司合成,各引物基因序列见表1。
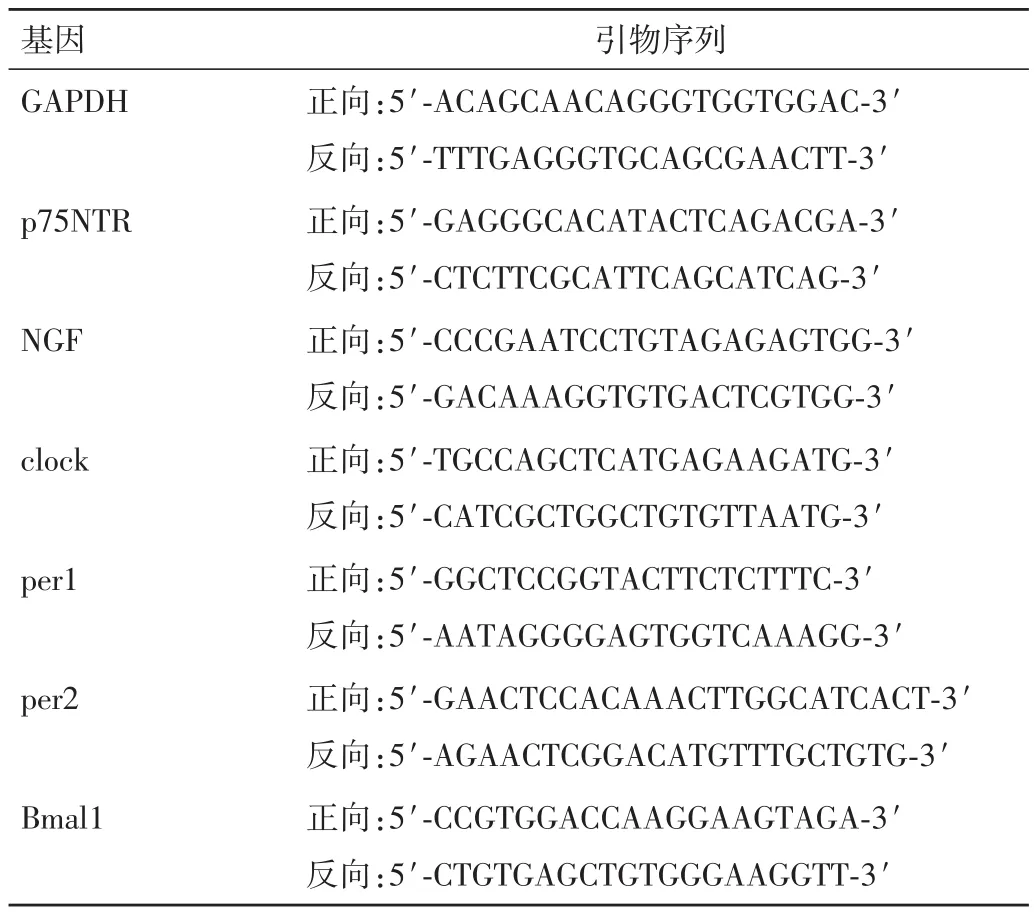
表1 各引物基因序列
1.3 统计学处理 使用SPSS11.0统计软件进行数据分析。计量资料以表示,多组间比较用ONE⁃WAY ANOVA方法,用Bonferroni校正法进行多组间均数比较的校正,检验水平α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 胚胎发育18.5dEMSCs原代培养与分选后培养 通过组织块法及胶原酶消化法成功获得并培养了胚胎发育18.5 d胚胎时期牙胚来源EMSCs,与分选后第3代的p75NTR阳性EMSCs比较,利用p75NTR抗体分选后的细胞形态更为规则均一,为间充质干细胞纺锤样形态,呈梭形或多边形。见图1。

图1 胚胎发育18.5 d EMSCs原代及分选后培养
2.2 胚胎发育18.5 d EMSCs流式表面分子鉴定 通过流式细胞仪检测胚胎发育18.5 d EMSCs表面分子,细胞阳性表达的结果分别为CD14(93.58%)、CD29(95.16%)、CD44(98.66%)、CD90(92.72%)、CD105(28.50%)、CD146(95.21%)、CD166(97.23%)和 p75NTR(90.18%),阴性表达 CD45(0.43%)。
2.3 RealTime⁃PCR 检测 p75NTR、NGF、clock、per1、per2、Bmal1在血清休克实验后24 h内不同时间点的表达量 p75NTR与NGF的表达在血清休克后出现与per1、per2节律性基因表达趋势相一致性的节律性震荡,从0 h开始至16 h时间点呈下降趋势,而表达最低点在16 h左右,之后逐渐呈表达升高趋势;clock基因表达未出现周期性的节律震荡,而Bmal1节律性表达出现提前性,表达最低点在12 h时间点,要比其他基因表达时间提前4 h左右。见图2。
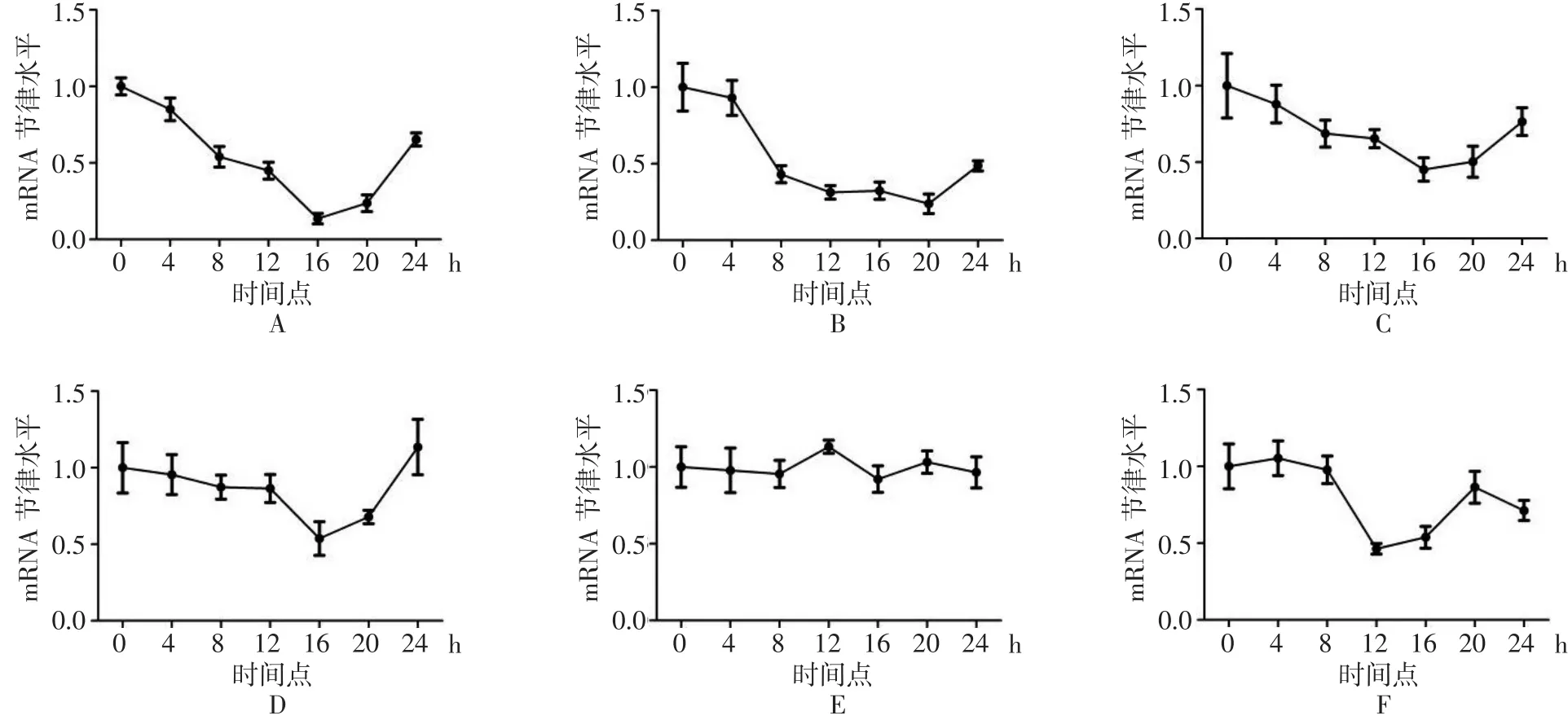
图2 RealTime⁃PCR检测各指标在24 h内不同时间点表达量
3 讨 论
为研究p75NTR与EMSCs在牙发育中存在的重要作用,作者选择SD大鼠胚胎颌突组织作为培养实验主要对象EMSCs的来源。胚胎第12.5天的EMSCs是选择作为牙发育启动期代表的EMSCs。前期研究中,课题组选择牙发育启动期EMSCs作为实验研究主要对象,对此EMSCs群进行纯化,即采用p75NTR[9]被认为是神经嵴源性EMSCs的特异性标志物[3]。对EMSCs进行流式分选,所获得细胞形态均一,能代表高纯度神经嵴源性 p75NTR 阳性的颌突 EMSCs(p75+EMSCs)[6]。进而对p75+EMSCs进行体外增殖及分化潜能的观察,发现其在体外扩增十代后p75+EMSCs增殖活性和细胞表型稳定。并未发现明显的自然分化现象,保持了良好的多项分化潜能。而要讨论整个颌面部及牙发育初期及矿化节律线形成时期EMSCs存在的重要作用,只利用牙发育启动期(胚胎发育12.5 d)的EMSCs来进行讨论存在一定缺陷性。所以本研究以牙齿周期节律性矿化线形成作为主要研究目的,选择牙发育钟状期(胚胎发育18.5 d)EMSCs,即来源于牙胚的颌突 EMSCs(即牙发育矿化前期)作为牙发育后期的代表,讨论研究相关内容。本研究结果发现,经过分选的胚胎发育18.5 d EMSCs的形态呈更为均一、纯度较高的梭边形或多边形,或间充质干细胞纺锤样形态,流式细胞仪神经嵴来源的EMSCs表面分子的鉴定,更确定了本研究主体细胞的身份。
p75NTR作为肿瘤坏死因子超家族(TNFR)的成员,广泛表达在神经系统及外周系统里[14]。p75NTR参与了多种细胞内信号分子的传导并且调控多种生物学功能包括感觉神经元的发生,肝组织及肌肉的再生,细胞外基质的重建,糖代谢及矿化能力的调控。而大多数能够调节代谢功能的基因都能够被时钟节律性所调控,而代谢的异常也与时钟节律调控的紊乱存在相关性[15⁃17]。近年来,有研究表明,在中枢神经系统及外周系统中,p75NTR的节律性震荡表达受到clock∕Bmal1复合体基因的调控,主要是clock∕Bmal1直接结合到p75NTR基因启动子中非经典的E⁃BOX元件上对其节律性表达进行干预,而这二者复合体也大量地表达在除了视神经上核之外的外周组织中[15,18],证明在外周组织中不同细胞中p75NTR受到的节律性调控也是由clock∕Bmal1主导。血清休克实验广泛运用在造成时钟基因节律性震荡表达[19],本研究中也利用血清休克实验体外模拟时钟环境,证实了p75NTR在牙胚来源的EMSCs中也存在节律性表达,并且震荡模式与其配体NGF及时钟节律相关基因per1[20]、per2[21]相一致,表明在外周组织包括牙发育相关组织中,p75NTR及其相关配体也存在时钟节律性表达。NGF作为神经生长因子,不仅仅是对神经细胞分化生长存在促进关系,而对细胞矿化分化也存在一定的影响,当NGF的表达量在牙槽骨愈合时候能不断升高[22],并且NGF能够促进下牙槽神经及牙槽骨的愈合[23]。而本研究结果显示,NGF也参与到时钟节律性表达中,从一方面也支持了作者的猜想:p75NTR及其配体NGF参与到牙组织发育矿化节律线的形成中;本课题组前期研究也表明,p75NTR与NGF通过结合Mage⁃D1能够调控EMSCs的矿化能力[13]。
牙体硬组织的生长线反映了基质及相关蛋白生成,分泌在矿化过程中的节律性变化,并且受到多方面因素的调控。下丘脑视交叉上核是节律性的神经中枢,在人类的各种生理活动的节律中发挥决定性作用。在外周振荡器接受下丘脑的节律性信号,做出反应,调整相关基因表达形成节律。釉质的横纹及内线与釉柱垂直,均代表了釉质形成的昼夜节律性,内线是釉柱横纹间的 2~3 条线,而釉柱横纹在人类中为 5.3 μm[10,24]。而人的牙齿牙本质生长线平均间隔为4~8 μm,周期也为1 d[10⁃11]。而不仅仅是牙体硬组织的钙化,包括牙齿的萌出也存在昼夜节律性的变化[25⁃26],因此本研究及结合课题组前期研究[13]均支撑了p75NTR及其配体可能参与到牙体硬组织形成的节律性表象中,然而研究在继续深入的过程中仍然可以对矿化相关基因、细胞外基质形成,以及外泌体等对矿化线存在影响的因素进行监测,进一步完善牙发育及组织工程应用的基本理论。

