黑曲霉内切葡聚糖酶系的基本酶学特征解析
佟新新,金 鹏,李伟国,刘晓光,路福平,Suren Singh,王正祥
(1. 天津科技大学生物工程学院,天津 300457;2. 天津科技大学化工与材料学院,天津 300457;3. 德班理工大学食品生物工程系,德班 4001,南非)
β-葡聚糖是由右旋葡萄糖通过 β-1,3-(1,4)-糖苷键聚合而成的多糖,是植物细胞壁的主要组成成分之一[1],在谷物、海藻和海带等生物质中含量丰富[2].β-葡聚糖酶是一类能降解β-葡聚糖的水解酶类的总称.除了作为水解纤维素的重要酶系,β-葡聚糖酶在食品加工、动物饲料、发酵和纺织等工业领域有广泛应用[2-3].按照其水解 β-葡聚糖的特异性,可将β-葡聚糖酶分为 4类,即特异性的 β-1,3-1,4-葡聚糖酶(地衣多糖酶,EC 3.2.1.73)、非特异性的 β-1,3(4)-葡聚糖酶(EC 3.2.1.6)、β-1,3-葡聚糖酶(昆布多糖酶,EC 3.2.1.39)和 β-1,4-葡聚糖酶(纤维素酶E1,EC 3.2.1.4)[4-5].
目前,微生物是β-葡聚糖酶的主要来源.工业上使用的 β-葡聚糖酶主要来源于曲霉和木霉等丝状真菌[6-7].尽管研究者们已经对许多不同来源(细菌、酵母和丝状真菌)的内切葡聚糖酶进行了基因克隆表达和酶学性质研究,但基本上都是单个酶的研究报道.石润润[8]采用构建酶库的方式成功将 22个不同来源的内切葡聚糖酶基因在大肠杆菌(Escherichia coli)中进行了克隆表达,但只对其中3个酶进行了酶学性质研究.迄今为止,还没有系统研究某一微生物体内全部β-葡聚糖酶生化特征的报道.
已知黑曲霉是自然环境中 β-葡聚糖酶系极为完整与丰富的生物物种,前人从黑曲霉中克隆表达和分离鉴定了多种内切葡聚糖酶,包括 En4gB[9-15]、En4gG[16-19]、EglC[20]、XengA[21]等.随着黑曲霉基因组的解析完成[22],从基因组水平再认识这一物种的内切葡聚糖酶系成为可能.本课题组前期将黑曲霉来源的 3个 β-1,3(4)-葡聚糖酶(En3gA、En3gB 和En3gC)进行了基因克隆表达和酶学性质的初步解析[23].在此基础上,本研究进一步通过基因克隆与异源表达,对黑曲霉基因组中全部可能的内切葡聚糖酶进行系统研究与比较分析,解析了其基本组成与酶学特征.由于此菌同时具有蔗糖酶和内切菊粉酶等果糖基水解酶系[24],本研究将为全面认知黑曲霉 β-葡聚糖酶系及其可能的工业应用奠定基础.
1 材料与方法
1.1 菌株、质粒及培养条件
菌株黑曲霉(A.niger)CICIM F0510是从自然样本分离保藏的野生菌株,由江南大学中国高校工业微生物资源与信息中心提供[23].大肠杆菌(E.coli)JM109由本实验室保藏.毕赤酵母(P.pastoris)GS115以及质粒pPIC9k购自Invitrogen公司.
黑曲霉通常采用 PDA培养基进行培养,为了获得 eglA基因的 mRNA,培养该菌的培养基(g/L):NaNO33,K2HPO41,MgSO4·7H2O 0.5,KCl 0.5,FeSO40.01,酵母膏 5,蛋白胨 10,乳糖 20,菊粉 10,果糖10.大肠杆菌采用LB培养基培养;毕赤酵母及其重组菌的培养基及其培养方法按照 Invitrogen公司的毕赤酵母操作手册进行.
1.2 主要试剂
PyrobestTMDNA Polymerase、限制性内切酶和T4 DNA连接酶,大连宝生物工程有限公司;小量DNA产物纯化回收试剂盒、质粒小量提取试剂盒,Omega Bio-Tek公司;酵母基本氮源培养基(YNB)、G418,Sigma Aldrich公司;RNA抽提试剂盒、cDNA合成试剂盒,Roche公司;氨苄青霉素、3,5-二硝基水杨酸和羧甲基纤维素钠(CMC-Na,聚合度 800~1200),国药集团化学试剂有限公司;茯苓多糖(含量为 50%),西安森冉生物工程有限公司;胰蛋白胨和酵母提取物,英国 Oxiod公司;其他生化试剂均为国产分析纯.
1.3 黑曲霉内切葡聚糖酶系的基因克隆与表达
1.3.1 毕赤酵母工程菌的构建
黑曲霉总 RNA的提取以及 cDNA的制备按照试剂盒说明书进行.PCR产物、质粒的纯化、酶切、连接、电转化以及转化子的筛选等参考文献[24]方法进行.此外,基因克隆过程中所采用的 17对寡核苷酸引物均由上海生工生物工程有限公司合成,其核苷酸序列见表1,下划线部分为限制性酶切位点.

表1 引物序列Tab. 1 Sequence of primers

续 表
1.3.2 重组酶的诱导表达与制备
采用前期建立的 MMH-CMC平板筛选法[23]筛选阳性转化子,并通过透明圈大小初步判断转化子的酶活力.选取酶活力较大的转化子接种到 25mL BMGY 培养基中培养至 A600=2~6(约 16~18h).5000r/min离心 5min后,将酵母细胞重悬于50mL BMMY 培养基中使得 A600=1.0,30℃、200r/min摇床培养,每隔24h补加100%甲醇至终体积分数为 0.5%以维持诱导,同时进行取样测定酶活力.发酵结束后,12000r/min离心 10min收集发酵上清液(即为粗酶液),-20℃保藏备用.
1.4 内切葡聚糖酶的酶活力测定
以1% CMC-Na(溶于0.2mol/L磷酸缓冲液,pH 6.0)为底物,采用黏度法[23]对内切葡聚糖酶的酶活力进行测定.1个单位的内切葡聚糖酶的酶活力定义:在50℃、pH 6.0的条件下,每分钟从1%的CMC-Na溶液中降解释放1mg CMC所需的酶量.
1.5 重组内切葡聚糖酶的酶学特征分析
1.5.1 最适作用温度的测定
取500µL经过适当稀释的酶液,加入30mL 1%CMC-Na溶液(溶于0.2mol/L磷酸缓冲液,pH 6.0),分别在 30、40、45、50、55、60、70、80℃水浴反应30min后,煮沸 10min灭酶.待样品冷却至室温后,用黏度法进行酶活力测定.以酶活力最高者为100%,并计算所处温度下的相对酶活力.
1.5.2 最适作用pH的测定
分别将重组酶的酶液用pH为3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0的 Na2HPO4-柠檬酸缓冲液进行适当稀释后,取 500µL加入到 30mL用相应 pH的Na2HPO4-柠檬酸缓冲液配制的1%CMC-Na溶液中,于每种酶的最适反应温度下准确反应 30min后,煮沸处理10min进行灭酶.冷却至室温后,用黏度法进行酶活力测定,并计算重组酶的相对酶活力.
1.5.3 热稳定性的测定
分别取 500µL经过适当稀释的酶液置于 30、40、45、50、55、60、70、80℃的水浴条件下孵育2h.每隔30min取出样品,在冰上放置10min后,加入30mL 1% CMC-Na溶液.于各种酶的最适反应温度条件下反应 30min,采用黏度法测定残余酶活力,以未进行热处理酶液的酶活力为 100%,计算相对酶活力.
1.5.4 pH稳定性的测定
分别将重组酶的酶液用pH为3.0、4.0、4.5、5.0、5.5、6.0、7.0和8.0的Na2HPO4-柠檬酸缓冲液适当稀释后,取 500µL加入到 3mL相应 pH的 Na2HPO4-柠檬酸缓冲液中,室温(25℃)孵育 1h.分别加入12mL 0.2mol/LNa2HPO4-柠檬酸缓冲液(pH 6.0),最后加入 15mL 2% CMC-Na溶液(溶于 0.2mol/L的Na2HPO4-柠檬酸缓冲液,pH 6.0),于各种酶的最适反应温度下反应 30min,灭酶并冷却至室温,然后进行酶活力测定.以酶活力最高者为 100%计算残余酶活力,确定内切葡聚糖酶的pH稳定性.
1.5.5 重组内切葡聚糖酶的底物水解特征
按照1.4节的酶活力测定方法,研究内切葡聚糖酶对 CMC-Na的水解特征.以 2mL 1%茯苓多糖溶液(溶于 0.2mol/L的 Na2HPO4-柠檬酸缓冲液,pH 5.0)为底物,加入经过适当稀释的 200µL粗酶液,对照组为200µL毕赤酵母GS115的发酵液.50℃水浴反应 30min后,采用 3,5-二硝基水杨酸法(DNS法)[25]进行酶活力测定,以确定内切葡聚糖酶对茯苓多糖的水解特征.
1.6 黑曲霉内切葡聚糖酶的生物信息学分析
将黑曲霉 CICIM F0510的 17种内切葡聚糖酶进行测序后,获得新的氨基酸序列.利用 Clustal X2软件对序列进行多序列比对,并通过软件 MEGA 4.0以邻近法(Neighbour-joining)构建进化树[26].采用在线软件MUSCLE(http://www.ebi.ac.uk/Tools/msa/muscle/)进行氨基酸序列比对.
2 结果与分析
2.1 基因的克隆、表达与重组酶的制备
依据 A.niger CBS 513.88基因组序列信息(EMBL AM270980—AM270998),采用BLAST等分析方法获得了确定或疑似内切葡聚糖酶编码基因信息(共 17个基因).以 A.niger CICIM F0510的cDNA为模板,对上述 17个目标基因进行 PCR扩增.PCR产物经纯化、XbaⅠ酶切后,将其克隆入pPIC9K 的 SnaBⅠ和 AvrⅡ位点.经 PstⅠ酶切验证和 DNA测序,确认重组质粒构建成功.由测序结果可知,所克隆的 17个基因均具有完整的开放阅读框(表 2).其中,除了 en4gC、en4gD、en4gF、en3gC、eglC和eglD的序列与A.niger CBS 513.88基因组公布序列有较大差异之外,其他基因的序列与公布序列基本一致.此外,除了 en3gB和 englA不含信号肽,其他基因均含有信号肽.

表2 黑曲霉CICIM F0510内切葡聚糖酶的基本特征Tab. 2 Basic properties of endoglucanases from A. niger CICIM F0510
将构建获得的重组质粒用限制性酶线性化后,电转化入毕赤酵母中,获得重组菌.在50mL摇瓶中进行培养时,这17个重组酶的酶活力测定结果见表3.
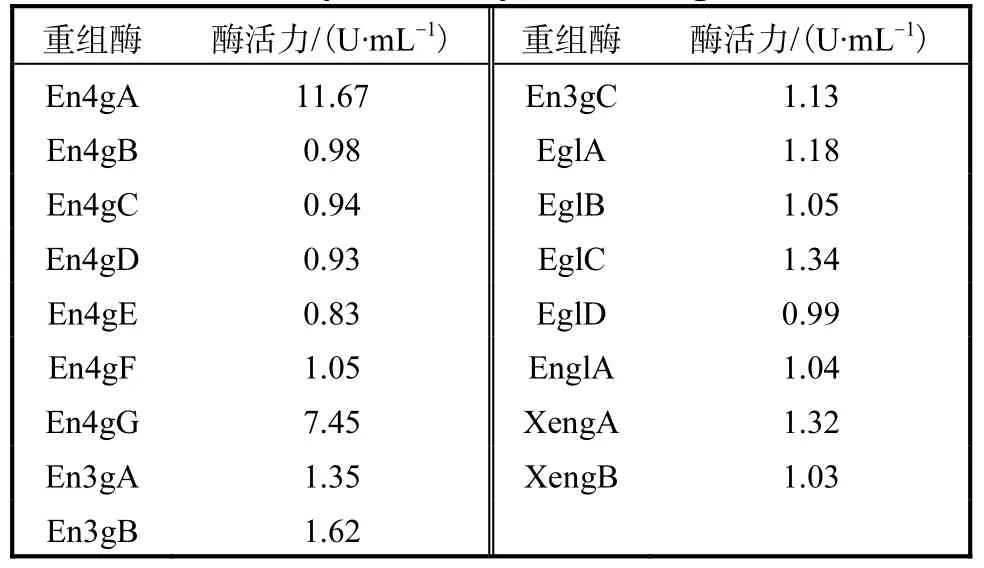
表3 17种内切葡聚糖酶酶活力Tab. 3 Enzyme activity of 17 endoglucanases
其中,En4gA和 En4gG的酶活力远高于其他重组酶的.以分泌表达的重组酶液为样本,进行相关酶学性质的研究与分析.
2.2 黑曲霉内切葡聚糖酶的基本酶学性质
2.2.1 最适反应温度和最适反应pH
对全部17种黑曲霉内切葡聚糖酶进行最适作用pH、最适作用温度的测定,结果如图1所示.
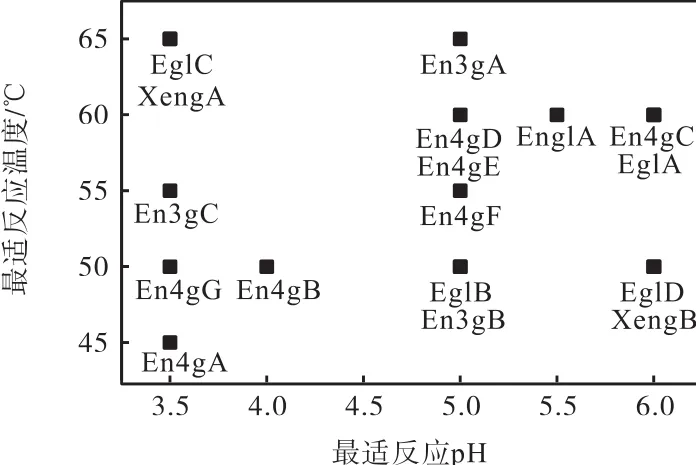
图1 重组内切葡聚糖酶的最适反应pH和最适反应温度Fig. 1 pH and temperature optima of recombinant endoglucanases
来源于黑曲霉的17种内切葡聚糖酶具有一定的差异性.除了少数重组酶的最适反应温度为 45℃(En4gA)和 65℃(EglC、En3gA 和 XengA)外,大部分重组酶的最适反应温度均为50~60℃.这17种重组酶的最适反应pH都在酸性范围内(pH 3.5~6.0),而且大部分重组酶的最适作用pH均为3.5或5.0.
温度和pH对17种重组内切葡聚糖酶酶活力的影响见表4.所有重组酶的酶活力高于80%的温度范围和 pH范围分别为40~75℃、pH 2.0~8.0.其中,在65℃以上和pH 5.0~5.6范围内具有80%以上酶活力的重组酶有 En4gC、En4gD、En4gE、En4gF、En3gA、EglA和EnglA.

表4 温度和pH对重组内切葡聚糖酶酶活力的影响Tab. 4 Effects of temperature and pH on the activities of recombinant endoglucanases
2.2.2 热稳定性和pH稳定性
热稳定性和 pH稳定性的研究表明,这 17种内切葡聚糖酶的残留酶活力60%以上的热稳定性和pH稳定性也存在较大的差异性(表5).

表5 重组内切葡聚糖酶的热稳定性和pH稳定性Tab. 5 Thermo-stability and pH stability of recombinant endoglucanases
所有的重组酶内切葡聚糖酶在 40~80℃范围内均具有较好的热稳定性.其中,En4gG、EglC和XengA的热稳定性最好,在 80℃孵育 1h后仍能保留 60%以上的酶活力.大部分重组酶均在中性偏酸的pH范围内具有较好稳定性(25℃孵育1h,残留酶活力大于 60%),XengB是个例外.而且,除了En3gC和EglC,其他重组酶在65~80℃和pH 5.0~5.5内都具有较好的稳定性.
2.2.3 底物水解特征分析
17种内切葡聚糖酶对不同底物的水解特征见表6.由表6可知:这17种内切葡聚糖酶对CMC-Na都具有水解作用,说明它们均具有水解 β-1,4糖苷键的能力.其中,En4gA和 En4gG的水解能力较强.3gA、En3gB、En3gC、En4gA和En4gB对茯苓多糖也有水解作用,表明它们具有水解 β-1,3糖苷键的活性,与文献报道一致[10,23].

表6 黑曲霉内切葡聚糖酶的底物水解特征Tab. 6 Substrate specificities of endoglucanases from A.niger
2.2.4 内切葡聚糖酶的分类
采用Clustal X2和MEGA 4.0等生物信息学的软件对这 17种重组酶的亲缘关系进行分析,结果如图2所示.

图2 进化树描述黑曲霉 CICIM F0510内切葡聚糖酶的遗传距离Fig. 2 Phylogenetic tree describing the genetic distances among endoglucanases from A.nigerCICIM F0510
有文献报道且功能已经确认的内切葡聚糖酶用粗体表示;线段的长度表示的是MEGA 4.0计算的距离;分支节点上的数字代表的是bootstrap百分比.结合底物水解特征、进化树以及碳水化合物活性酶(CAZy)分类系统(http://www.cazy.org/),可以将这17种内切葡聚糖酶分为 4类:(1)XengA、XengB、En4gG和 En4gE是木葡聚糖特异性(xyloglucan-specific)的内切 β-1,4-葡聚糖酶(EC 3.2.1.151)[18-19,21],它们属于糖苷水解酶第5家族(GH5),而Rawat等[19]和Master等[21]认为XengA和En4gG属于糖苷水解酶12家族(GH12).(2)En3gA、En3gB、En3gC[23]、En4gA 和En4gB[10]是内切 β-1,3(4)-葡聚糖酶(EC 3.2.1.6),可以水解葡聚糖中的 β-1,3和 β-1,4糖苷键,属于糖苷水解酶16家族(GH16).但这5种重组酶分别属于2个不同的亚类(图 2),它们之间的区别还有待进一步研究.(3)EglA、EglB、EglC、EglD 和 En4gF 只具有水解 β-1,4糖苷键的能力,是内切 β-1,4葡聚糖酶(EC 3.2.1.4),属于糖苷水解酶第 5家族(GH5).(4)En4gC和 EnglA属于一类,其中 En4gC是内切 β-1,4葡聚糖酶[27],但它们的具体功能还有待进一步的研究确认.
3 讨 论
本研究成功将黑曲霉CICIM F0510来源的全部17种内切 β-葡聚糖酶基因在毕赤酵母 GS115中进行了克隆表达,获得的17种重组酶均对CMC-Na具有水解作用.测序的结果表明,它们的核苷酸和氨基酸序列与菌株 CBS 513.88来源的相应序列的相似度,从完全一致到有较大差异不等(表 2).其中,基因 en4gC、en3gC、eglC和 eglD 的氨基酸序列与NCBI上公布的序列差异很大,这可能是由于来源菌株不同造成的.由氨基酸序列比对可知,这 17种内切葡聚糖酶之间的氨基酸序列差异性较大,序列相似度为7.49%~62.5%.其中,en4gC和en4gG的氨基酸序列相似度为7.49%,而en4gA和en4gB的氨基酸序列相似度为 62.5%.根据底物水解特征、进化树以及CAZy分类系统,重新将这17种内切葡聚糖酶分为4类(图 2):(1)木葡聚糖特异性的内切 β-1,4-葡聚糖酶(GH5,EC 3.2.1.151);(2)非特异性的内切 β-1,3(4)-葡聚糖酶(GH16,EC 3.2.1.6);(3)内切 β-1,4-葡聚糖酶(GH5,EC 3.2.1.4);(4)En4gC和EnglA,它们的具体功能还有待进一步确认.
内切葡聚糖酶是一种重要的工业酶制剂,在啤酒酿造和饲料等工业应用广泛.在啤酒酿造过程中,麦芽糖化的温度和 pH 分别为 65~70℃、pH 5.0~5.6[4].因此,啤酒酿造行业所用的内切葡聚糖酶需同时具有良好的耐热性和耐酸性.本研究中的 En4gC、En4gD、En4gE、En4gF、En3gA、EglA 和 EnglA 的最适反应温度、热稳定性、最适反应 pH和 pH稳定性分别在此温度和 pH范围内,可用于啤酒酿造工程.在饲料微丸包衣过程中,也需要较高的温度(65~90℃,90s),而且饲料的消化是在畜禽胃肠酸性环境中(pH 2.6~6.5)进行的[28].除了上述 7种重组酶,En3gC、EglC和 XengA 也适用于饲料颗粒化过程.本研究获得的EglA、EglB、EglC、EglD、En4gD和En4gF等内切β-1,4-葡聚糖酶在纤维素乙醇的生产工艺中(50℃、pH 4.8)[29]具有潜在的应用价值.4种木葡聚糖特异性的内切 β-1,4-葡聚糖酶(En4gE、En4gG、XengA 和 XengB)不仅可以对植物纤维进行改性[30],还可以将经过化学修饰的低聚木糖与木葡聚糖进行连接,从而赋予纤维素微纤丝(cellulose microfibrils)新的功能[31].此外,该酶在食品、纺织和医药行业也有广泛应用[32].
综上所述,本研究将黑曲霉来源的 17种内切葡聚糖酶在毕赤酵母中进行了克隆表达,并系统解析了它们生化特征的异同点,为同一来源的同类酶(同工酶)超家族的相关研究以及相关酶在实际应用中协同作用的研究提供了研究基础.同时,良好的生化特征使得这些内切葡聚糖酶在麦芽糖化、饲料颗粒化、纤维素乙醇、食品、纺织以及医药等行业有着潜在的应用价值.

