人原代支气管上皮细胞的简易分离和培养
谢 冬,翟成凯,刘影影,赵 乐,张彬彬,吴卫东
(1.新乡医学院公共卫生学院,河南 新乡 453003;2.新乡医学院附属新乡市第一人民医院呼吸科,河南 新乡 453000)
支气管上皮细胞是呼吸道黏膜的第1道屏障,在抵御病原体、异物入侵和机械损伤的过程中发挥重要的免疫调控作用[1]。支气管上皮细胞与呼吸系统疾病关系密切,通过损伤后的异常修复,分泌多种炎性介质和细胞因子,参与疾病发生、发展的不同环节[2]。目前,用于实验研究的离体支气管上皮细胞主要有原代支气管上皮细胞和上皮细胞株[3-5]。细胞株来源单一,丧失了原有组织细胞的某些功能特性,对于评价正常细胞的行为具有局制性[6]。人支气管上皮细胞原代培养亦有报道,主要是通过外科手术切除[7]和机械刷洗法[8]获取细胞,经蛋白酶消化法[8]、组织贴块法[7]分散为单个细胞,可用于体外研究,但步骤繁琐,差异化较大,细胞存活率有待提高[9]。基于此,本研究通过纤维支气管镜刷检获取支气管上皮细胞,探索一种实验环境更贴合人体、方便快捷、细胞活性和纯度较高的支气管上皮细胞原代培养方法,并进行鉴定,为支气管上皮细胞的基础和应用研究提供基础。
1 材料与方法
1.1原代支气管上皮细胞来源原代支气管上皮细胞取自新乡市第一人民医院支气管镜室行支气管镜检查者63例,男39例,女24例,年龄35~76(55.5±3.4)岁。纳入标准:支气管壁正常者。排除标准:支气管壁损伤、感染及咯血患者。被检查者及其家属知情同意,签署知情同意书,且本研究经过医院伦理委员会批准。
1.2主要试剂与仪器鼠尾胶原蛋白I型、RPMI 1640培养基、支气管上皮细胞培养基(bronchical epithelial cell growth medium,BEGM)、磷酸盐缓冲液(phosphate buffered saline,PBS)、胰蛋白酶-乙二酸四乙酸消化液、牛血清(美国索莱宝公司),兔抗人细胞角蛋白8单克隆抗体(美国Origene公司),山羊抗兔二抗辣根过氧化物酶(horse radish peroxidase,HRP)/标记的兔免疫球蛋白(immunoglobulin,IgG)聚合物(上海碧云天生物技术有限公司),吐温20(广州威佳科技有限公司),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(美国MP公司);一次性支气管刷(江苏省海门市扬子医疗器械有限公司),细胞培养板(美国Costar公司),离心管(美国Corning公司),一次性吸液管(美国Nest公司),AE2000倒置生物式显微镜(麦克奥迪实业集团有限公司),JW-1042R低速冷冻离心机(安徽嘉文仪器装备有限公司)。
1.3细胞培养器皿的表面包被用0.006 mol·L-1的无菌乙酸将胶原蛋白稀释至0.03 g·L-1,在12孔板内每孔加300 μL,确保胶原蛋白溶液铺满器皿的表面,开盖在超净台常温放置1 h后,PBS洗3次,超净台风机吹干并紫外消毒30 min后使用。
1.4支气管上皮细胞获取及培养被检查者取仰卧位,通过纤维支气管镜用生理盐水冲洗支气管前壁,静卧10 min后,经支气管镜用一次性支气管刷取支气管前壁上皮细胞,用无菌剪刀剪下前端毛刷,放入装有RPMI 1640培养基的离心管内(无菌操作),30 min内冰盒运送至实验室,用培养液冲洗毛刷数次后,1 000 r·min-1离心10 min,弃上清液,加入150 μL BEGM,用一次性吸液管反复吹打均匀,吸取30 μL滴入培养皿中央,置于37 ℃、含体积分数5% CO2细胞培养箱中培养4 h,加入500 μL BEGM,置于细胞培养箱中培养,1~2 d换液1次,至细胞铺满整个培养皿。
1.5支气管上皮细胞扩大培养将胰蛋白酶-乙二酸四乙酸消化液加入培养皿消化 5 min,加入1 mL RPMI 1640培养液终止消化,1 500 r·min-1离心 5 min,弃上清液,加入1 mL BEGM,1 500 r·min-1离心5 min,弃上清液,加入4 mL BEGM,转移至底面积为25 cm2细胞培养瓶,置于细胞培养箱培养,1~2 d 换液1次,至细胞铺满整个细胞培养瓶,加入胰蛋白酶-乙二酸四乙酸消化液,置于恒温细胞培养箱中培养5 min,加入BEGM终止消化,一次性吸液管反复吹打混合均匀,转移至15 mL离心管中,1 500 r·min-1离心5 min,小心缓慢地吸去上清液,加入 2 mL BEGM混合均匀,用移液枪吸取 10 μL 细胞悬液滴于细胞计数板上,倒置生物式显微镜下观察并计数细胞计数板上4个象限细胞数,取均值,估算细胞密度,液氮中冷存。
1.6支气管上皮细胞的鉴定
1.6.1形态学观察在刷检获得的支气管上皮细胞原代培养的第1、3、11、16、17、18天,分别于倒置生物式显微镜下观察细胞形态。
1.6.2人支气管上皮细胞存活率扩大培养的人原代支气管上皮细胞在细胞培养瓶中生长达到80%~90%以后,加入胰蛋白酶-乙二酸四乙酸消化液消化,放入恒温细胞培养箱中,将贴壁的支气管上皮细胞于20 ℃消化5 min,加入4 mL BEGM终止消化,反复吹打混合均匀,收集细胞转移至15 mL离心管中,1 500 r·min-1离心5 min。用体积分数75%乙醇消毒离心管外壁,置于紫外线消毒过的超净工作台中,小心缓慢吸去上清液,加入2 mL BEGM混合均匀,然后取18 μL细胞悬液与2 μL体积分数0.4%锥虫蓝染液混合均匀后,取混合液10 μL滴于细胞计数板上,置于倒置生物式显微镜下进行观察,死细胞可以被锥虫蓝染成蓝色,活细胞则为无色透明,在3 min内分别计数4个视野中死细胞与活细胞的数目,计算人支气管上皮细胞原代培养的细胞存活率。随机选取3个样本进行存活率测定,取均值。
1.6.3人支气管上皮细胞的免疫组织化学染色鉴定扩大培养的人原代支气管上皮细胞生长达到细胞培养瓶壁的80%~90%时,加入胰蛋白酶-乙二酸四乙酸消化液,置于恒温细胞培养箱中培养5 min,加入4 mL BEGM终止消化,反复吹打混合均匀,收集细胞并转移至15 mL离心管中,1 500 r·min-1离心5 min,小心缓慢地吸去上清液,加入2 mL BEGM混合均匀,取10 μL细胞悬液滴于细胞计数板上,倒置生物式显微镜下观察并计数细胞计数板上4个象限细胞数,取均值。根据爬片所需的细胞浓度和体积计算制作细胞爬片所需培养基的量,将剩余的细胞混合液 1 500 r·min-1离心5 min,弃上清液,在剩下的沉淀中加入计算好的培养基混合均匀,取 5×104个细胞接种于清洗好的玻片上进行培养,每1~2 d换液1次,倒置生物式显微镜下观察细胞生长状况,当细胞生长达到80%~90%时,爬片制作完成;然后,用一次性灭菌枪头吸出放置爬片的细胞培养皿中的培养基,加入PBS 500 μL,静置4 min,吸出原来的PBS,再加入新的PBS 500 μL,静置 4 min,重复上述步骤3次;多聚甲醛固定细胞爬片15~20 min后,吸出多聚甲醛,加入PBS 1 mL,静置5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次;吸取通透液950 μL和牛血清50 μL,配制成体积分数5%的牛血清溶液,加至放置爬片的细胞培养皿中固定30~60 min;吸出培养皿中的牛血清溶液,然后每孔加PBS 1 mL,静置5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次;然后进行一抗孵育:细胞培养皿中加入兔抗人细胞角蛋白8单克隆抗体30 μL进行标记,抗体稀释浓度为11 000,将爬片细胞面朝下贴合一抗,4 ℃冰箱孵育过夜;第2天早上进行二抗孵育,放置爬片的细胞皿中加PBS 1 mL,静置5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次,然后在爬片上细胞面滴加山羊抗兔二抗HRP/IgG聚合物,孵育箱中室温孵育1 h;然后在放置爬片的细胞孔板加入PBS 1 mL,静置5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次;将吐温20用PBS配制成体积分数0.3%的吐温20溶液,向放置爬片的细胞孔板加入3 mL PBS及9 μL体积分数0.3%的吐温20,混合均匀,静置5 min;然后向放置爬片的细胞培养皿中加入PBS 1 mL,静置 5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次;加细胞核荧光染料DAPI染色15 min,吸出,然后加入PBS 1 mL,静置5 min,吸出原来的PBS,再加入新的PBS 1 mL,静置5 min,重复上述步骤3次;然后用体积分数90%甘油封片,置于倒置生物式显微镜下进行观察,细胞质着色为绿色、细胞核复染为蓝色即为支气管上皮细胞。
2 结果
2.1细胞形态学观察人支气管上皮细胞原代培养第1天,镜下可见纤毛摆动,细胞杆状透明,单个、散在分布(图1A);培养第3天,细胞逐渐贴壁、变大,呈多边形,细胞聚集成团,呈铺路石样(图1B);培养第11天,细胞生长旺盛,大小均匀一致,可见大片的扁平状、多边形细胞,密集呈铺路石样分布生长,约占整个孔的80%~90%(图1C);培养第16天,细胞增多,铺路石样生长,细胞团变大(图1D);培养第17天,细胞体积逐渐变大,细胞数目逐渐增多,相邻较小的细胞团块逐渐融合呈片状(图1E);培养第18天,细胞增殖明显,可见大片的扁平状、多边形细胞,细胞大小均匀一致,增殖成片状,密集呈铺路石样分布生长,约占瓶壁的70%~80%(图1F)。
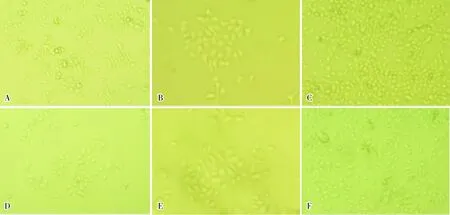
A:人支气管上皮细胞原代培养第1天;B:支气管上皮细胞原代培养第3天;C:支气管上皮细胞原代培养第11天;D:支气管上皮细胞原代培养第16天;E:支气管上皮细胞原代培养第17天;F:支气管上皮细胞原代培养第18天。
图1支气管上皮细胞形态学表现(×100)
Fig.1Morphologicalfeaturesofbronchialepithelialcells(×100)
2.2支气管上皮细胞的存活率支气管上皮细胞平均存活率为(96.8±0.5)%。
2.3支气管上皮细胞鉴定免疫组织化学染色结果显示,支气管上皮细胞细胞质着色为绿色(图2A、图2B),细胞核复染为蓝色(图2C、图2D),鉴定为人支气管上皮细胞。

A:细胞质着色为绿色(×100);B:细胞质着色为绿色(×400);C:细胞核复染为蓝色(×100);D:细胞核复染为蓝色(×400)。
图2支气管上皮细胞免疫组织化学染色结果
Fig.2Immunohistochemicalstainingresultsofbronchialepithelialcells
3 讨论
支气管上皮细胞的体外培养目前已经由单层培养发展到三维立体培养,即气液界面(air-liquid interface,ALI)培养,更真实地模拟体内呼吸道,为进行呼吸系统相关的基础和应用研究做准备。虽然 ALI 培养的研究在国外已有 30 多年的历史[10],但全球只有少数实验室成功建立了该培养平台,且不同实验室采用的方法各异,比如原代细胞的分离培养、ALI培养基的添加成分、预铺胶原的类型、细胞接种密度等各不相同[11]。本实验在原代细胞分离培养方面进行改良,旨在探索ALI培养的更优方法。
目前,实验研究中支气管上皮细胞的来源主要有2种途径:外科手术切除的支气管组织和经纤维支气管镜刷检[12-15]得到的支气管上皮细胞。外科手术切除获取支气管组织,需除去结缔组织以后用蛋白酶消化法分离以获取单个的细胞进行原代培养,该方法流程繁琐,获取支气管组织需震荡消化12~24 h[12],费时费力,而且在获取支气管上皮细胞之前需经酶消化,破坏了细胞外基质的蛋白分子等成分及紧密连接结构,与细胞生长相关的细胞外基质成分发生改变,不能很好地模拟体内环境,可能不利于细胞的贴壁和增殖。而经纤维支气管镜刷检法,有文献指出,单纯机械刷洗获取的主要是气道上皮分泌物和衰老并容易脱落的纤毛细胞,其中混杂有大量红细胞,收获量不高[15]。本研究中,在行刷检之前通过用生理盐水冲洗支气管前壁,并使被检查者仰位静卧10 min,尽量降低支气管分泌物和衰老脱落细胞对刷检结果的影响,以获得较多的细胞活性较高的正常支气管上皮细胞。
在细胞活性保持方面,经外科手术切除获取支气管组织进行原代培养的过程中,手术标本开始分离、培养时往往离体时间已较长,细胞活性大大降低[15]。本研究中,刷检获取支气管上皮细胞以后,存放于RPMI 1640培养基,30 min内冰盒运送至实验室,并直接接种到细胞培养皿进行原代培养,最大程度保持了细胞的活性和结构的完整性。刷检获取的支气管上皮细胞,可能由于刷检力度过大致黏膜出血,使获取的上皮细胞中混杂有血细胞和上皮下的成纤维细胞。本研究则利用血细胞和成纤维细胞不能在无血清的BEGM中生长的特点,通过使用无血清BEGM达到分离、纯化上皮细胞的目的,实验操作更加方便、简单,培养的细胞经免疫组织化学染色鉴定为人支气管上皮细胞,且平均细胞存活率为(96.8±0.5)%。
综上所述,通过支气管镜刷检获取支气管上皮细胞,可以在保证细胞活性的基础上分离获得较多单个支气管上皮细胞,通过无血清BEGM去除混杂的血细胞、成纤维细胞,纯化支气管上皮细胞,是一种高效、方便、获取细胞存活率较高的支气管上皮细胞原代培养方法,有利于支气管上皮细胞相关的基础和临床应用研究。

