射频消融术对大鼠肝组织中M2型巨噬细胞极化的调控作用
郭东慧,毛中鹏,王东洋,于晓双,郑文博
(1.新乡医学院,河南 新乡 453003;2.郑州市第三人民医院甲状腺乳腺外科,河南 郑州 450000;3.武警后勤学院附属医院肿瘤外科,天津 300162;4.禹州市中心医院内一科,河南 禹州 461670;5.解放军31609部队卫生室,江苏 南通 226000;6.信阳市中心医院急诊科,河南 信阳 464000)
射频消融(radiofrequency ablation,RFA)是局灶性肝癌最常用的治疗方法,但其治疗后的炎症反应可促进中、晚期肝癌残余肿瘤的复发[1]和转移[2-3]。巨噬细胞在调节肝癌RFA术后的炎症及纤维化中发挥重要作用,且与疾病进展有关。血液中的单核细胞经过不同途径极化为M1型或M2型巨噬细胞,M1型巨噬细胞具有促进炎症反应的作用,引起肝脏纤维化;M2型巨噬细胞发挥抗炎作用,促进肝脏修复[3-4]。sCD163是M2型巨噬细胞活化后的标志物,可作为肝癌患者总生存期不良预后的检测指标[5]。在肿瘤细胞或巨噬细胞分泌的多种细胞因子或炎性因子的影响下,肿瘤组织中的M1(iNOS+)型巨噬细胞易极化为M2(CD206+)型[6-8],肿瘤发生过程与上述机制密切相关。巨噬细胞极化是单核细胞活化后一系列功能状态的2个极端,但肝癌RFA术后对巨噬细胞M2型极化的调节作用仍不明确,M2型极化对肝癌RFA术后的预后也不清楚。本课题通过建立RFA肝损伤炎症模型,研究RFA术后炎症微环境对M2型巨噬细胞表达的影响,为深入探讨M2型巨噬细胞如何调节炎症微环境来减少肝癌RFA术后复发和转移提供思路。
1 材料与方法
1.1实验动物清洁级雄性Wistar大鼠[SGWK-(军)2014~2020]36只,5.5~6.0月龄,体质量350~400 g,饲养于救援医学研究所动物饲养室,室温控制在20~25 ℃,空气流通,相对湿度35%~65%,正常光照。大鼠自由进食、水,室内照明分工作照明和动物照明。动物饲料及饮用水均按实验动物管理委员会规定由实验动物部统一提供。实验中对实验动物的所有操作均按《关于善待实验动物的指导性意见》进行。
1.2试剂与仪器戊巴比妥钠购于美国Sigma公司,酶联免疫吸附试验测定(enzyme-linked immu nosorbent assay,ELISA)试剂盒购于南京建成生物工程公司,CD163抗体购于美国Santa cruz公司,抗兔IgG AlexaFluor-596购于美国Proteintech公司;Cool-tip RFA仪购于美国Covidien公司,半干TP1020组织脱水机、Arcadia组织石蜡包埋机、RM2265石蜡切片机、HVI1210摊片机、TP1020组织脱水机和HVI1210烤片机均购于美国Leica公司。
1.3实验方法
1.3.1实验分组及大鼠肝损伤炎症模型建立将42只大鼠随机分为对照组(n=6)和RFA组(n=36),RFA组大鼠根据处死时间再分为12、24、72、120、168、336 h组,每组6只。连接RFA各部分设备,接通电源,开机运行无异常后,待机。RFA组大鼠给予RFA术建立肝损伤炎症模型,具体方法为:大鼠腹腔注射戊巴比妥钠(3 mL·kg-1)进行麻醉后,固定于大鼠板,剃去上腹部及双下肢内侧部毛发,粘贴电极板于双下肢内侧部;上腹部备皮,常规消毒、铺巾,沿右上腹部肋缘下做一长约2 cm弧形切口,暴露肝脏右叶,垂直于肝脏组织插入1 cm射频针(右后叶最厚处、大约深0.5 cm),启动射频机,射频消融6 min(依据前期实验)[9],无菌纱布按压针道,拔出射频针,针道无出血后,间断分层缝合切口(操作全程遵循外科手术无菌操作原则);待大鼠麻醉苏醒后,放回动物房继续饲养,并观察进食、进水、活动情况及生存时间。对照组大鼠重复上述操作,但不启动射频机。
1.3.2大鼠血清相关指标检测和肝组织病理观察12、24、72、120、168 h组分别于RFA术后12、24、72、120、168 h采用脱臼法处死大鼠,对照组大鼠于168 h时全部处死。大鼠处死后十字切开腹部,解剖分离下腔静脉,并采血5 mL,室温静止30 min,3 000 r·min-1离心5 min,小心收集上层血清,分装于1 mL离心管中,放入-80 ℃冰箱待检。采用ELISA法检测各组大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-10(interleukin-10,IL-10)水平;采用7170A 全自动生物化学分析仪检测丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平。取肝脏,观察肝脏大体形态;切取射频部位、射频周围3 cm组织于体积分数4%甲醛溶液中固定,脱水,包埋,切片,苏木精-伊红(hematoxylin and eosin,HE)染色,封片,显微镜下观察肝脏组织病理变化。
1.3.3各组大鼠肝组织中M2型巨噬细胞检测336 h组其余6只大鼠于336 h处死,制备肝组织石蜡切片。取对照组及12、24、72、120、168、336 h组大鼠肝组织石蜡切片进行组织免疫荧光染色,CD163抗体(1100)标记M2型巨噬细胞(红色),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)标记细胞核(蓝色),分别于波长559 nm和340 nm激发光荧光倒置显微镜下观察拍照,Adobe Photoshop软件合成图片,应用Image J软件计算镜下5个视野(×200倍)内CD163+标记M2型巨噬细胞的阳性表达率。
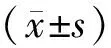
2 结果
2.1大鼠RFA后一般情况及生存率RFA组大鼠术后麻醉恢复时间(29.0±2.0)min,平均每日进食量(19.2±0.4)g,进水量(33.2±1.1)mL,精神差,活动度明显减少,12、24、72 h组处死前生存率均为100%,120、168、336 h组处死前各死亡1只,生存率为83.3%。对照组大鼠麻醉恢复时间(10.0±3.0)min,平均每日进食量(24.9±0.7)g,进水量(47.8±1.1)mL,精神可,活动无明显影响,处死前生存率为100%。RFA组大鼠进食及进水量少于对照组,差异有统计学意义(P<0.05)。
2.2各组大鼠RFA术后肝脏形态和病理学表现对照组大鼠肝脏与周围组织无粘连,偶见网膜覆盖,表面光滑,质韧,红褐色,针道周围质软、轻度充血、水肿;HE染色可见肝小叶完整,偶见肝内胆管、肝动静脉,肝细胞完整,核大且圆,居中,偶见双核、多倍核(图1A)。RFA组大鼠肝脏多见网膜覆盖,表面欠光滑,针道周围表面粗糙,质硬,以针道为中心呈3个同心圆样分布,分别为坏死区、交界区和炎症充血区,依次为灰白色、灰绿色和鲜红色;炎性充血区HE染色显示明显充血、水肿,肝细胞气球样变,可见灶状变性坏死,肝小叶不完整,偶见肝内胆管、肝内动静脉扭曲、不完整,可见大量红细胞,偶见多形核白细胞(图1B、图1C);72 h组大鼠肝组织中成纤维细胞分布于坏死交界区,可见多个核巨噬细胞,偶见不连续的小血管浸润(图1D、图1E);168 h组大鼠肝组织中可见新形成的小血管及管内红细胞,大量纤维条索形成,肝细胞形成不规则形肝小叶(图1F)。
A:对照组;B:12 h组;C:24 h组;D:72 h组;E:120 h组;F:168 h组。
图1各组大鼠肝组织病理学变化(HE染色,×100)
Fig.1Pathologicalchangesoflivertissueineachgroup(HEstaining,×100)
2.3各组大鼠血清ALT、AST、TNF-α及IL-10水平比较结果见表1。12、24、72、120、168 h组大鼠血清ALT、AST、TNF-α及IL-10水平均高于对照组,差异有统计学意义(P<0.05)。24、72、120 h组大鼠ALT、AST、TNF-α及IL-10水平均高于12 h组,差异有统计学意义(P<0.05)。168 h组大鼠血清AST水平高于12 h组,TNF-α水平低于12 h组,差异有统计学意义(P<0.05);168 h组与12 h组大鼠血清ALT和IL-10水平比较差异无统计学意义(P>0.05)。168 h组大鼠血清ALT、AST、TNF-α及IL-10水平均低于120 h组,差异有统计学意义(P<0.05);24、72、120 h组大鼠血清ALT、AST、TNF-α及IL-10水平组间两两比较差异均无统计学意义(P>0.05)。
2.4各组大鼠肝组织中M2型巨噬细胞阳性表达率比较结果见图2。对照组、12、24、72、120、168、336 h组大鼠肝组织中M2型巨噬细胞阳性表达率分别为(9.5±0.4)%、(10.1±0.8)%、(10.9±0.5)%、(11.1±1.5)%、(18.7±0.8)%、(24.5±1.8)%和(6.8±0.4)%。168 h组大鼠肝组织中M2型巨噬细胞阳性表达率高于对照组和12、24、72、120、336 h组,差异有统计学意义(χ2=14.91、14.31、13.60、13.36、12.71、17.63,P<0.05)。
表1各组大鼠血清ALT、AST、TNF-α和IL-10水平比较
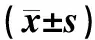

组别nALT/(IU·L-1)AST/(IU·L-1)TNF-α/(ng·L-1)IL-10/(ng·L-1)对照组688.3±2.1 150.3±3.5 51.0±3.5 93.5±6.8 RFA组 12 h组6109.9±2.8a124.6±6.7a81.1±3.6a112.4±7.5a 24 h组6137.6±7.4ab164.4±6.6ab98.8±2.3ab138.6±5.4ab 72 h组6157.8±9.2ab306.6±3.3ab150.1±2.7ab154.9±6.9ab 120 h组5133.6±5.8ab322.8±2.5ab97.2±2.1ab133.3±4.6ab 168 h组5114.1±4.1ac315.4±4.7abc63.8±1.7abc111.9±2.5ac
注:与对照组比较aP<0.05;与12 h组比较bP<0.05;与120 h组比较cP<0.05。
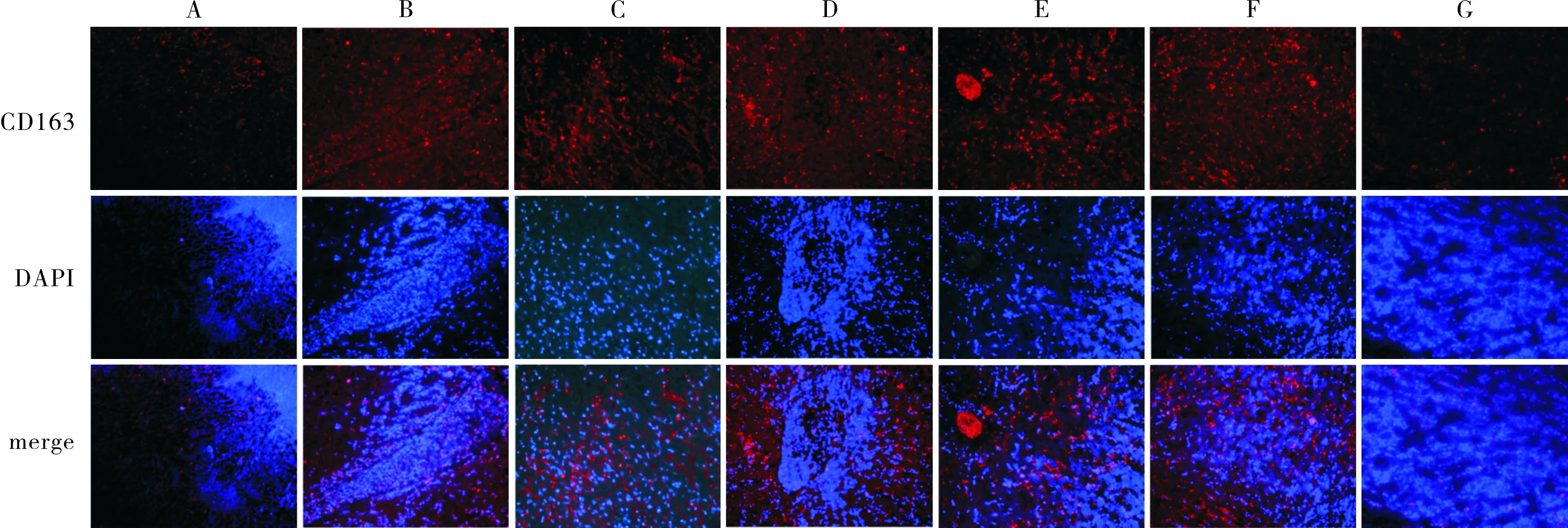
A:对照组;B:12 h组;C:24 h组;D:72 h组;E:120 h组;F:168 h组;G:336 h组。
图2各组大鼠肝组织中M2型巨噬细胞的阳性表达(免疫荧光染色,×200)
Fig.2PositiveexpressionofM2macrophagesinlivertissuesofratsineachgroup(immunofluorescencestaining,×200)
3 讨论
肝癌是发病率和致死率高的恶性肿瘤,RFA是一种新型微创技术,在肝癌治疗中广泛应用,并取得显著效果[10],但RFA术后的炎症微环境可促进残余肿瘤复发和转移,是导致其不良预后的首要因素。RFA主要是在影像设备辅助下或术中直视下,将射频电极直接插入脏器中,射频发生器产生400~460 kHz 波,致电极周围组织分子震荡、摩擦、产热,温度达70~90 ℃,在局部热损伤下致组织凝固性坏死,形成直径3~5 cm球性坏死灶。本研究采用RFA建立热损伤炎症模型,结果发现,肝脏热损伤后肝细胞破裂,并释放ALT、AST及大量炎性细胞因子TNF-α和IL-10,在RFA术后12 h ALT、AST、TNF-α及IL-10水平明显升高,间接说明RFA急性热效应在术后 12 h 时已经引起肝损伤和急性炎症反应;120 h时ALT、AST、TNF-α及IL-10水平开始降低,168 h时ALT、AST、TNF-α及IL-10水平较 120 h 时明显降低,证实急性炎症期已过;同时通过肝组织HE染色发现,RFA术后12 h时肝组织中有大量红细胞和中性粒细胞浸润,更直观证实了急性炎症反应的存在,72 h时可见肉芽组织开始增生,120 h时可见纤维条索,168 h时可见不规则形肝小叶形成,有大量巨噬细胞聚集。但成丽等[11]通过刀片机械外力构建斑马鱼的切尾炎症模型,荧光显微镜下计数显示,巨噬细胞聚集量在切割后6 h达巅峰值,8 h后开始下降。本研究对照组大鼠应用射频针刺入肝脏(未接通电源),造成肝机械损伤,168 h 处死后免疫荧光标记M2型巨噬细胞阳性表达率为9.5%。KUMAR等[2]研究发现,在假治疗后,可标记出M1型巨噬细胞(CD68+),而本研究通过组织荧光标记发现,对照组大鼠肝组织中存在M2型巨噬细胞,说明机械刺激可诱导巨噬细胞极化。KUMAR等[2]还发现,在大鼠肝RFA术后72 h和168 h时,炎症反应带中可见大量巨噬细胞聚集,且RFA术后168 h的纤维厚度明显厚于术后72 h,本研究HE染色结果与此一致;术后168 h时因巨噬细胞已充分扩散拉长,无法量化阳性细胞的百分比,而本研究免疫荧光染色后发现,M2型巨噬细胞阳性表达率达25%左右。ROZENBLUM等[12]研究发现,RFA术后炎症反应中M0型巨噬细胞(F4/80+)聚集达巅峰的时间是336 h。本研究主要标记的是M2型巨噬细胞,在336 h时阳性表达率仅6.8%。巨噬细胞的极化取决于其所处周围环境,有研究发现,活化的脂多糖诱导后的巨噬细胞更倾向于向M1型极化,然而活化后的IL-4/13则倾向于将巨噬细胞诱导为M2型[13]。肝损伤炎症模型的建立过程中产生大量循环免疫复合物,有研究发现,循环免疫复合物诱导后的巨噬细胞主要表达为具有抗炎促修复作用的M2型[13]。ZHENG等[14]研究发现,四氯化碳诱导肝纤维化后提取的肝巨噬细胞中,M2型巨噬细胞比例较高。本研究发现,RFA术后72 h时M2型巨噬细胞阳性表达率开始明显升高,WAIDMANN等[5]研究发现,肝损伤后12~24 h肝脏中单核源性巨噬细胞开始明显聚集,而Kupffer细胞明显减少。巨噬细胞是免疫治疗的重要成分,作为抗原递呈细胞,可激活下游免疫[15]。本研究结果显示,RFA术可诱导大鼠肝脏巨噬细胞极化为M2型,且在RFA术后168 h M2型巨噬细胞阳性表达率最高,在这个时间点可提取到较多的M2型巨噬细胞,为后续肝癌RFA术后炎症反应中巨噬细胞的免疫治疗研究和肝M2型巨噬细胞作用机制的体外研究提供一定的基础支持。

