光遗传技术调控新生神经元电活动对颅脑损伤小鼠认知功能的影响
夏天光,孔宪斌,王明丽,毕 莹,吕方方,梁 军,姜 伟,孙 倩,董化江,李晓红
(1.武警后勤学院附属医院脑创伤与神经疾病研究所,天津 300162;2.武警后勤学院附属医院心脏科,天津 300162;3.天津大学精密仪器与光电子工程学院,天津 300072)
颅脑损伤(traumatic brain injury,TBI)的致死率和致残率高,是一类严重危害人们健康的疾病[1-2]。海马齿状回(dentate gyrus,DG)颗粒下区(subgranular zone,SGZ)的成体神经发生对TBI后认知功能的恢复具有潜在的重要作用。有研究显示,TBI可诱导海马DG SGZ的神经发生[3-4],但新生的成体神经干细胞(neural stem cell,NSC)只有小部分能够存活并分化成熟。TBI后缺氧和毒素累积的微环境进一步导致新生细胞的低存活率和低成熟率[5]。由此可见,如何提高TBI后新生神经元的存活和诱导其分化成熟是成体NSC修复TBI神经功能需要着重解决的问题。以膜去极化为代表的电兴奋性对新生神经元的成熟至关重要,并在胚胎和成体早期神经元发育过程中促进功能性突触的形成[6]。光遗传学方法中蓝光可激活视紫红质通道蛋白-2(channelrhodopsin-2,ChR2),使膜去极化并触发动作电位。特定启动子下的ChR2工程细胞为膜去极化和神经元兴奋的研究提供了一种新的且强有力的工具。有研究在新生细胞中使用Nestin或天冬氨酸转运体(gamma-ray large area space telescope,GLAST)作为启动子,但被Nestin或GLAST标记的细胞仍是多能且具备有丝分裂能力,这不适合研究新生神经元存活和成熟。研究证实,海马DG区NSC的存活和成熟呈现出2个关键时期,一是 2b型中间祖细胞至3型中间祖细胞的过渡期间;二是非成熟神经元至成熟神经元的过渡期间[7]。这2个关键时期的神经元均表达DCX蛋白。因此,DCX阳性且表达ChR2的新生细胞是光遗传学调控去极化的理想靶细胞。因此,本研究使用光遗传工具激活TBI后DG区表达DCX的新生神经元,在成体神经发生阶段,光调控表达DCX神经元的去极化,以探讨光调控去极化对TBI小鼠海马DG新生神经元的存活、成熟及对TBI小鼠认知功能的影响。
1 材料与方法
1.1实验动物健康无特定病原(specific pathogen-free,SPF)级8周龄雄性C57BL/6小鼠66只,体质量 22~24 g,购自中国军事医学科学院,动物许可证号:SCXK(京)2016-0011。
1.2试剂与仪器NeuN、BrdU抗体均购自英国Abcam公司,BrdU购自美国Sigma公司,荧光二抗Alexa Fluor 405、488和610均购自澳大利亚Invitrogen公司,慢病毒ChR2-DCX-EGFP由上海和元生物技术股份有限公司构建,病毒滴度为3×1011L-1;液压冲击损伤仪购自美国Custom Design and Fabrication公司。人工脑脊液(0.119 0 mol·L-1氯化钠,0.002 3 mol·L-1氯化钾,0.001 3 mol·L-1硫酸镁,0.002 5 mol·L-1氯化钙,0.026 2 mol·L-1碳酸氢钠,0.001 0 mol·L-1磷酸二氢钠和0.011 0 mol·L-1葡萄糖)为人工配制。
1.3实验方法
1.3.1实验分组及TBI模型制备小鼠随机分为假手术组(n=10)、TBI组(n=12)、TBI+增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)组(n=12)和TBI+ChR2组(n=32)。假手术组小鼠行单纯开颅手术,未行液压冲击;TBI组小鼠给予液压冲击制备TBI模型;TBI+EGFP组小鼠给予液压冲击制备TBI模型后感染慢病毒DCX-EGFP;TBI+ChR2组小鼠给予液压冲击制备TBI模型后感染慢病毒DCX-ChR2-EGFP。各组小鼠均于造模后连续7 d行腹腔内注射BrdU(100 mg·kg-1)。具体造模方法为:小鼠按50 mg·kg-1腹腔内注射戊巴比妥进行麻醉,选择前囟后4.0 mm、中线旁开2.2 mm,在右顶颅骨开3.5 mm骨窗,保证硬膜完好无破损,然后将损伤连接管置于暴露的硬脑膜上,用玻璃离子体水门汀黏合,通过改造的连接适配器连接到液压冲击损伤装置上,使用压力脉冲(2.4 atm)快速冲击闭合的颅腔。手术过程中使直肠温度保持在37 ℃。
1.3.2免疫荧光染色检测TBI组小鼠海马DG区新生神经元存活和成熟情况在造模后7、28 d分别处死3只小鼠,取脑组织置于40 g·L-1多聚甲醛中固定24 h,采用振荡切片机连续切片制备脑组织切片,厚20 μm。将TBI组脑切片置于含体积分数0.5%Triton X-100的磷酸盐缓冲液(phosphate buffered saline,PBS)中透化处理20 min,0.01 mol·L-1PBS缓冲液洗片3次,每次5 min。然后将切片浸入体积分数0.5%H2O2甲醇溶液中孵育10 min以阻断内源性过氧化物酶,然后用50 g·L-1牛血清白蛋白在室温下封闭非特异性结合位点30 min。加入一抗BrdU于4 ℃下过夜,次日加入一抗NeuN于4 ℃下过夜。然后用波长为 610、405、488 nm的荧光二抗孵育60 min。4,6-联脒-2-苯基吲哚(diamidine phenylindole,DAPI)染色10 min,抗荧光淬灭封片剂封片,最后使用共聚焦显微镜观察新生神经元存活和成熟情况。每个时间点随机选取大鼠海马DG区各3张切片,每张切片计数5个视野并拍照。
1.3.3倒置荧光显微镜观察假手术组和TBI+ChR2组海马DG区DCX-EGFP阳性新生神经元变化造模前2 d,将DCX-ChR2-EGFP慢病毒注射到TBI+ChR2组小鼠的DG区。造模后立即将光纤植入海马DG区,造模后3~28 d进行在体光刺激。假手术组和TBI+ChR2组小鼠在造模后不同时间点(3、5、7、9、12、18、28 d)行40 g·L-1多聚甲醛心脏灌注,每个时间点处死3只小鼠,取脑组织采用震荡切片机连续切片制备脑组织切片,厚20 μm。对切片进行细胞核DAPI避光染色10 min,PBS冲洗3次,每次5 min,抗荧光淬灭封片剂封片,倒置荧光显微镜观察DCX-EGFP阳性新生神经元的变化,DCX-EGFP阳性新生神经元定量计数方法同“1.3.2项”。
1.3.4Morris水迷宫实验检测各组小鼠认知功能麻醉各组小鼠,将光纤植入损伤侧的DG区,造模后3~12 d进行在体光刺激。造模后21~26 d行Morris 水迷宫实验,训练4组小鼠寻找水下隐匿平台,在水池中加入牛奶使水变得不透明,水温保持在约26 ℃。每次训练重复3次(间隔15 s),记录大鼠寻找隐匿平台的潜伏期。造模后26 d进行平台测试,28 d撤去平台,记录小鼠穿越平台次数和在目标象限停留的时间。
1.3.5免疫荧光染色检测小鼠海马DG区表达DCX神经元的存活和成熟情况造模后28 d,采用免疫荧光染色检测TBI组、TBI+EGFP组和TBI+ChR2组小鼠同侧海马颗粒细胞层NeuN和BruU双标记的新生成熟神经元,免疫荧光染色步骤同“1.3.2项”。
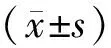
2 结果
2.1TBI组小鼠海马DG区新生神经元存活及成熟情况结果见图1。造模后7、28 d,TBI组小鼠海马DG区新生成熟神经元数量分别为(2 100.0±236.9)、(584.3±69.2)个·mm-3;造模后28 d新生成熟神经元数量显著少于造模后7 d,差异有统计学意义(P<0.01)。造模后7~28 d,约78%的新生神经元消失。
A、C:×200;B、D:A、C中1、2的放大图(×400)。
图1造模后7d和28dTBI组小鼠海马DG区新生神经元存活和成熟情况(免疫荧光染色)
Fig.1SurvivalandmaturationofnewbornneuronsinDGareaofhippocampusat7daysand28daysaftermodeling(immunofluorescencestaining)
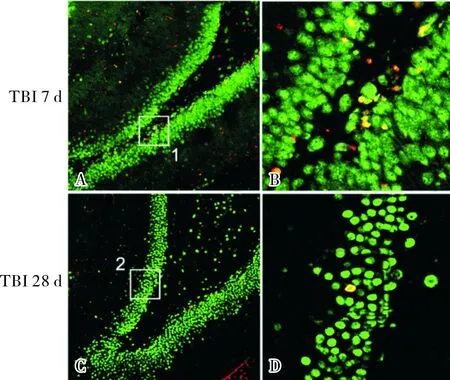
2.2假手术组和不同时间点TBI+ChR2组小鼠海马DG区DCX-EGFP阳性新生神经元变化情况结果见图2和表1。从造模后3 d起,TBI+ChR2组小鼠海马DG区DCX-EGFP阳性新生神经元数量开始上升,9 d达到高峰,12 d开始明显下降。造模后3、18、28 d,TBI+ChR2组与假手术组小鼠海马DG区DCX-EGFP阳性新生神经元数量比较差异无统计学意义(P>0.05);造模后5、7、9、12 d TBI+ChR2组小鼠海马DG区DCX-EGFP阳性新生神经元数量均显著高于假手术组,差异有统计学意义(P<0.05,P<0.01)。造模后9 d,TBI+ChR2组小鼠海马DG区DCX-EGFP阳性新生神经元数量均显著高于其他各时间点,差异有统计学意义(P<0.05,P<0.01)。
A:假手术组;B:TBI+ChR2组造模后3 d;C:TBI+ChR2组造模后9 d;D:TBI+ChR2组造模后28 d。
图2假手术组和TBI+ChR2组不同时间点海马DG区DCX-EGFP阳性新生神经元表达情况(DAPI染色,×200)
Fig.2ExpressionofDCX-EGFPpositivenewbornneuronsinhippocampalDGregionofmiceinshamoperationgroupandTBI+ChR2groupatdifferenttimepoints(DAPIstaining,×200)
表1假手术组和TBI+ChR2组不同时间点小鼠海马DG区DCX-EGFP阳性新生神经元数量比较
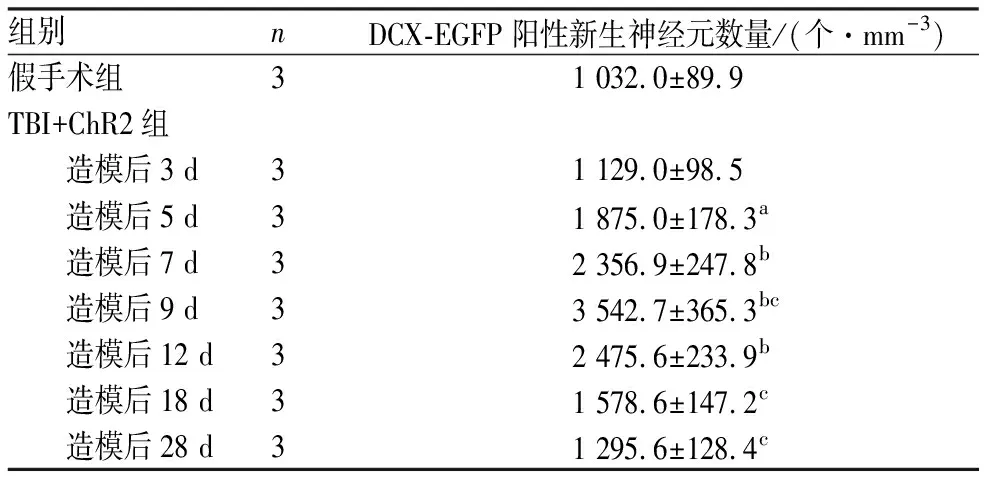
组别nDCX-EGFP阳性新生神经元数量/(个·mm-3)假手术组31 032.0±89.9TBI+ChR2组 造模后3 d31 129.0±98.5 造模后5 d31 875.0±178.3a 造模后7 d32 356.9±247.8b 造模后9 d33 542.7±365.3bc 造模后12 d32 475.6±233.9b 造模后18 d31 578.6±147.2c 造模后28 d31 295.6±128.4c
注:与假手术组比较aP<0.05,bP<0.01;与造模后3、5、7、12、18、28 d 比较cP<0.05。
2.3光调控表达DCX的细胞去极化对TBI小鼠认知功能的影响结果见表2和表3。造模后 21 d,4组小鼠寻找隐匿平台的潜伏期比较差异均无统计学意义(P>0.05)。造模后22~26 d,TBI组和TBI+EGFP组小鼠寻找隐匿平台的潜伏期均显著长于假手术组,差异有统计学意义(P<0.01);TBI+ChR2组与假手术组小鼠寻找隐匿平台的潜伏期比较差异无统计学意义(P>0.05);TBI+EGFP组与TBI组小鼠寻找隐匿平台的潜伏期比较差异无统计学意义(P>0.05);TBI+ChR2组小鼠寻找隐匿平台的潜伏期均显著短于TBI组和TBI+EGFP组,差异均有统计学意义(P<0.01)。TBI组和 TBI+EGFP组小鼠在目标象限停留时间和穿越平台次数均显著少于假手术组,差异有统计学意义(P<0.01);TBI+ChR2组与假手术组小鼠在目标象限停留时间和穿越平台次数比较差异无统计学意义(P>0.05)。TBI+ChR2组小鼠在目标象限停留时间和穿越平台次数均高于TBI组和TBI+EGFP组,差异均有统计学意义(P<0.05);TBI+EGFP组与TBI组小鼠在目标象限停留时间和穿越平台次数比较差异无统计学意义(P>0.05)。
表2各组小鼠寻找隐匿平台的潜伏期
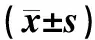
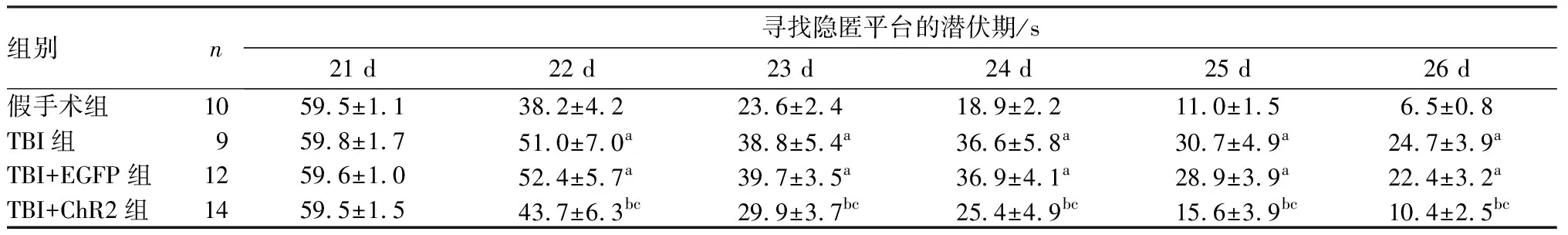
组别n寻找隐匿平台的潜伏期/s21 d22 d23 d24 d25 d26 d假手术组1059.5±1.138.2±4.223.6±2.418.9±2.211.0±1.56.5±0.8TBI组959.8±1.751.0±7.0a38.8±5.4a36.6±5.8a30.7±4.9a24.7±3.9aTBI+EGFP组1259.6±1.052.4±5.7a39.7±3.5a36.9±4.1a28.9±3.9a22.4±3.2aTBI+ChR2组1459.5±1.543.7±6.3bc29.9±3.7bc25.4±4.9bc15.6±3.9bc10.4±2.5bc
注:与假手术比较aP<0.01;与TBI组比较bP<0.01;与TBI+EGFP组比较cP<0.01。
表3各组小鼠在目标象限停留时间和穿越平台次数
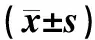

组别n目标象限停留时间/s穿越平台次数假手术组1042.4±6.05.9±0.7TBI组919.4±3.7a1.9±0.3aTBI+EGFP组1220.9±3.9a2.1±0.4aTBI+ChR2组1434.7±4.2bc4.4±0.6bc
注:与假手术比较aP<0.01;与TBI组比较bP<0.01;与TBI+EGFP组比较cP<0.05。
2.4小鼠海马DG区新生神经元存活及成熟情况结果见图3。造模后28 d,TBI组、TBI+EGFP组和TBI+ChR2组小鼠海马DG区新生成熟神经元数量分别为(723.4±82.3)、(783.0±89.6)、(3 201.5±365.1)个·mm-3;TBI+ChR2组小鼠海马DG区新生成熟神经元数量明显高于TBI组和TBI+EGFP组,差异均有统计学意义(P<0.01);TBI组与TBI+EGFP组小鼠海马DG区新生成熟神经元数量比较差异无统计学意义(P>0.05)。

A:TBI组;B:TBI+EGFP组;C:TBI+ChR2组。
图3小鼠海马DG区新生神经元存活及成熟情况(免疫荧光双标染色,×400)
Fig.3SurvivalandmaturityofneonatalneuronsinhippocampalDGregionofmiceineachgroup(immunofluorescentdoublelabelledstaining,×400)
3 讨论
TBI可导致成体NSC大量增殖。然而,新生的成体NSC只有小部分能够存活和分化成熟,最终整合入神经环路。引起新生成体NSC死亡的因素有很多,其分化成熟的能力低下是最主要的原因之一。为解决TBI后新生细胞低存活和低成熟率的问题,本研究选择光遗传学方法通过膜去极化电激活这些细胞。为了获得ChR2-EGFP特异性靶向表达DCX蛋白的新生细胞,将慢病毒ChR2-DCX-EGFP立体定向注射感染小鼠海马DG区神经干细胞,观察到蓝光激活可有效引起表达DCX蛋白的细胞发生膜去极化,并且显著促进新生细胞的存活和成熟。
TBI可诱导海马DG区NSC增殖并分化为神经元[8]。促进这种新生神经元的生成可修复TBI后神经功能[9]。本研究结果显示,TBI后7、28 d DG区有大量新生细胞在初始阶段分化为神经元,但最终只有少数细胞存活并成熟,表明海马DG区成体神经发生过程中新生神经元若不能迁移和成熟将最终走向死亡。
电活动在成体神经发生的各个阶段均起着关键作用,尤其是在神经分化阶段[10]。有研究显示,有丝分裂的神经元细胞膜去极化可影响神经元的存活、成熟及功能整合[11],然而,传统的电生理调控技术难以精确调控某一类靶细胞。光遗传学已被用于研究复杂神经元网络的功能[12-13],其可精确的从空间和时间调控成体新生神经元的活动[14-15]。大多数研究利用光遗传学来调控一组细胞或是研究某个神经回路,对于光门控阳离子ChR2介导的去极化作用却很少涉及。光遗传学调控神经元功能具有时空精度高的特点,相对于其他传统的电生理技术具有很大的优势,因此,本研究选择光遗传学作为调控细胞去极化工具。ChR2是研究神经元活动变化的一种强有效工具[16]。在特定的启动子下,EGFP-ChR2基因可被插入到要调控的细胞中。DCX基因编码一种相对分子质量40 000的微管相关蛋白。新生神经元中DCX的缺失会导致严重的形态缺陷和迁移延迟。在成人中枢神经系统中,DCX主要存在于成体海马DG区和侧脑室室管膜下区[17-18]。在成体神经发生过程中,DCX在增殖的神经祖细胞和有丝分裂后的神经元前体细胞中瞬时表达。DCX这种特异性表达模式提示可将其作为启动子标记新生神经元。本研究观察到,不仅是未成熟的神经元和神经母细胞表达DCX蛋白,2b型中间祖细胞也有DCX蛋白表达,提示表达DCX的新生细胞存在一个供调控电活动的长时程窗口。本研究定量结果显示,在TBI后3 d,表达DCX的细胞数量开始上升,9 d达到高峰,12 d开始下降,表明损伤后3~12 d 是光调控神经细胞去极化的最佳时间窗。本研究选择DCX作为启动子驱动新生细胞中ChR2-EGFP的表达,是因为在各种刺激条件下DCX可以保持相对稳定,并且其能长期表达,覆盖细胞存活和成熟的关键期[19]。通过Morris水迷宫实验检测,结果发现光调控表达DCX细胞的去极化,可以改善TBI所致的认知缺陷。本研究还发现,通过免疫荧光共定位染色BrdU(标记新生细胞)和NeuN(标记成熟神经元)证实,TBI后长时间内光调控表达DCX细胞的去极化可促进其存活和成熟。
综上所述,本研究采用ChR2介导的去极化这种新方法来激活TBI后的新生细胞使其趋于成熟。重点关注新生细胞成熟过程中2b型中间神细胞至3型中间祖细胞的过渡期和非成熟神经元至成熟神经元的过渡期这2个关键时期,并选择DCX驱动新生细胞中ChR2-EGFP的表达,结果发现,表达DCX的新生细胞覆盖了这2个关键时期,这就为研究ChR2介导的光调控新生神经元去极化提供了一个长期而稳定的时间窗。DCX作为一可靠的启动子,可在时间和空间上精确触发新生神经元去极化,最终促进TBI后新生神经元的存活和成熟,且TBI+ChR2组小鼠寻找隐匿平台的潜伏期显著缩短,在目标象限停留时间和穿越平台次数显著提高,提示光调控新生细胞去极化可显著改善TBI小鼠认知功能缺陷。

