胸水细胞蜡块在肺癌诊断和EGFR基因检测中的应用研究*
陈一峰,陈婷,陈玮姗,姚锡虎,张坤河,李辉,苏春阳
(福建医科大学附属泉州第一医院 病理科,福建 泉州 362000)
一项权威大规模统计表明,肺癌在中国的发病率和死亡率最高,老年人(>60岁)是高发人群[1]。>50%肺癌患者出现胸腔积液,约15%肺癌患者被确诊时已有胸腔积液[2],转移性肺腺癌是引起晚期肺癌伴胸腔积液最常见的病因,伴有恶性胸水的肺癌患者已失去手术治疗机会,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinaseinhibitors,EGFR-TKIs)靶向用药为其首选治疗方案。本科室常规开展细胞学涂片、细胞蜡块联合免疫组织化学染色检查明确肺腺癌的诊断,而后检测肺腺癌细胞蜡块标本的表皮生长因子受体(epidermalgrowth factor receptor,EGFR)基因的突变情况,并与同期活检或手术的肺腺癌组织块的EGFR基因突变情况进行对比,现报道如下。
1 材料与方法
1.1 材料
选取2016年1月-2017年6月福建医科大学附属泉州第一医院病理科归档保存的胸水常规涂片和细胞蜡块切片292例,胸水均为临床经胸腔穿刺现抽即送(非胸腔引流装置留存)的标本,细胞蜡块切片均有对应的相关免疫组织化学染色。其中,男性190例,女性102例;年龄39~84岁,中位数年龄65岁。
1.2 方法
1.2.1 细胞蜡块制备 取胸水100~150 ml置于2、3管50 ml锥形试管内,2 000 r/min离心10 min,弃上清液。常规细胞学涂片后,加入10%中性甲醛,2 000 r/min离心5 min,固定>3 h。待试管底部沉渣质地变硬,用一次性竹签小心刮取沉淀物于包埋纸,与组织块一起固定、脱水、石蜡包埋、切片、苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色。
1.2.2 免疫组织化学法 用自动免疫组织化学染色仪染色(瑞士,Roche Benchmark XT),DAB显色,中性树胶封片,光镜下观察切片。所有抗体购自福建迈新生物技术有限公司,常规设置阳性和阴性对照。根据细胞学涂片和细胞蜡块切片,针对性地选择一抗,参考临床病史缩小抗体范围。常规选择TTF-1、NapsinA抗体;怀疑消化系统源性转移性腺癌,加选CDX2、CK20、CK7、Villin;怀疑乳腺源性,加选ER、PR、GATA3、GCDFP15;怀疑卵巢、输卵管、子宫源性,加选pax8、Vim、WT1、CA125;选择CR、MC、D2-40、BerEP4、Desmin标记区分腺癌或增生间皮细胞;怀疑小细胞癌,加选CgA、Syn、CD56。TTF-1、CDX-2、ER、PR、GATA3、pax8、WT1均为细胞核着色;NapsinA、Villin、GCDFP15、Vim、CA125、MC、D2-40、Desmin、ALK、CgA、Syn 均为细胞质着色;BerEP4、CD56为细胞膜着色;CR为细胞核或细胞质着色;CK7、CK20为细胞膜或细胞质着色。
1.2.3EGFR基因突变检测 DNA石蜡组织切片提取试剂盒(离心柱型)及EGFR基因突变检测试剂盒(PCR-荧光探针法)购自北京鑫诺美迪基因检测技术有限公司。细胞蜡块切片组织DNA的提取和样品经验证符合要求后,采用扩增阻遏突变系统(amplification refractory mutation system, ARMS)-实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR), 应 用 Stratagene Mx3000P qRTPCR 仪检测EGFR外显子 18、19、20、21(Exon18-21)29种常见形式的突变,19Del、L858R通过ARMS法扩增。见图1、2。

图1 EGFR基因19Del点突变扩增图
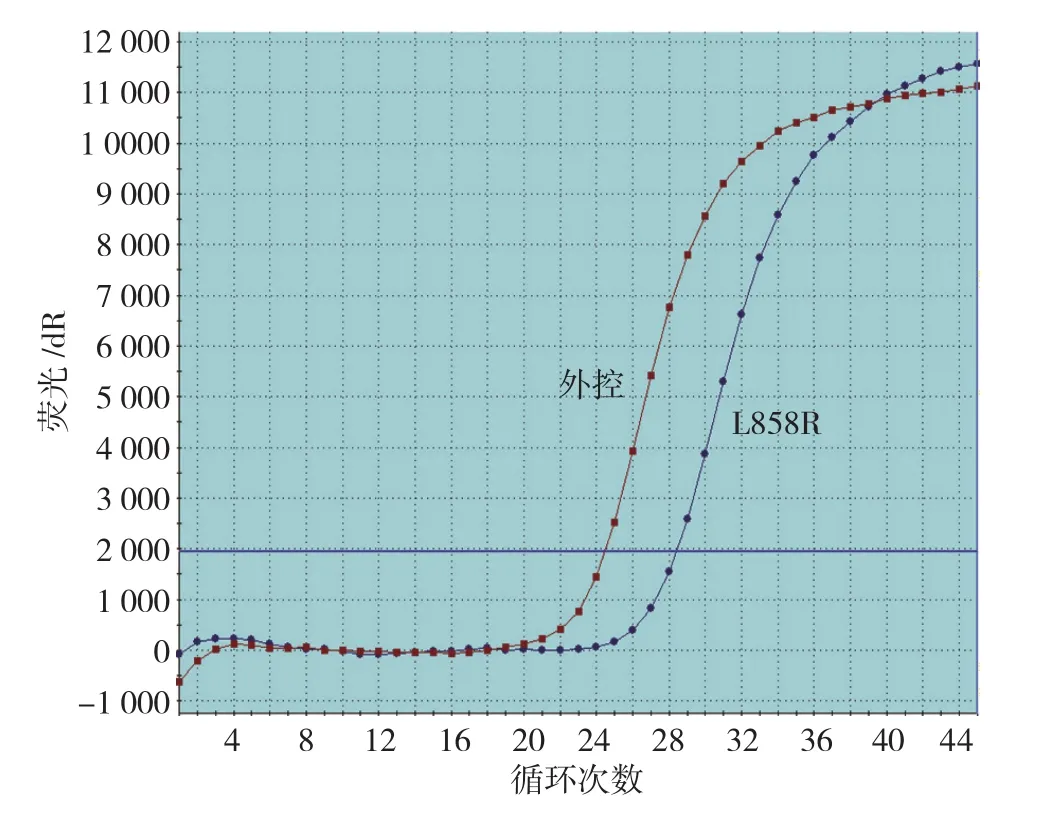
图2 EGFR基因Exon21 L858R点突变扩增图
1.3 统计学方法
数据分析采用SPSS 15.0统计软件,计数资料以构成比或率(%)表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞学涂片与细胞蜡块切片结合免疫组织化学染色的病理诊断比较
292例患者胸水行常规涂片检查,查见癌细胞,即阳性139例;未查见癌细胞,即阴性86例;查见异型或疑癌细胞,即不确定67例。292例患者胸水细胞蜡块结合免疫组织化学染色结果显示,阳性175例,阴性114例,不确定3例。两种方法检出率比较,差异有统计学意义(χ2=75.861,P=0.000),后者阳性检出率高于前者,且不确定构成比低于前者。
175例细胞蜡块查见癌细胞,呈单个、簇状、腺管状排列(见图3),可见炎症及纤维素性背景(见图4),其中TTF-1、NapsinA阳性,支持肺腺癌者166例;呈实性巢状排列,相关神经内分泌酶标阳性(见图5),支持小细胞癌者3例;其中ER、PR、GATA3(见图6)、GCDFP15阳性,支持乳腺癌者5例;其中pax8、Vim、WT1、CA125阳性,支持卵巢癌者1例。3例因可供诊断的细胞过少,而归入不确定者。

图3 癌细胞呈单个、簇状、腺管状排列 (×200)
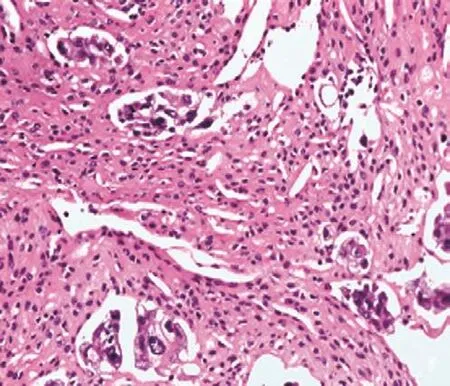
图4 炎症及纤维素性背景中的癌细胞 (×200)
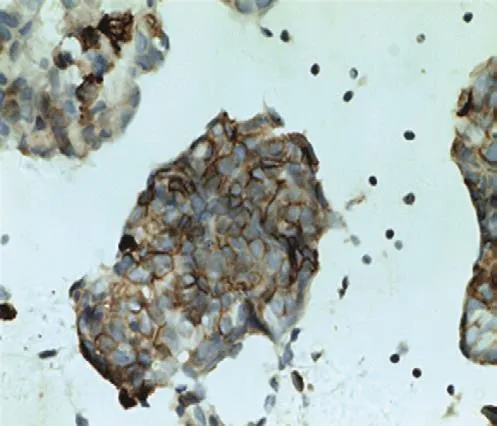
图5 癌细胞CD56阳性 (×200)
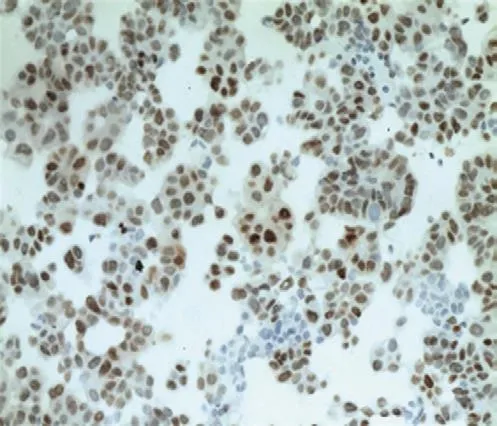
图6 癌细胞GATA3阳性 (×200)
2.2 细胞蜡块与组织块的EGFR基因突变检测结果比较
EGFR无任何突变定义为野生型,即EGFR阴性;有任意突变类型的定义为突变型,即EGFR阳性。175例细胞蜡块中,EGFR阳性84例,阳性率为48%,其中女性54例,男性30例。同期检测305例活检或手术切除标本组织块的EGFR基因突变情况,EGFR阳性131例,阳性率为42.95%,其中女性80例,男性51例。用细胞蜡块与组织块检测EGFR基因突变的阳性率及男女构成比比较,差异无统计学意义(χ2=1.146和 0.226,P=0.284和 0.635)。
3 讨论
胸水标本在病理科甚是常见,肺癌是引发胸水的主要病因之一,为明确诊断和后续精准治疗的需要,收集和保存好胸水中有限的细胞尤为重要。本科将临床送检“新鲜”的胸水沉渣石蜡包埋,制成细胞蜡块,结果显示细胞蜡块结合免疫组织化学染色的阳性检出率高于细胞涂片,且不确定构成比低于细胞涂片,说明单凭传统的细胞学涂片检查诊断肿瘤存在缺陷。本实验对67例细胞学涂片诊断不确定者进一步分析发现,普遍的现象是可供诊断的瘤细胞数量比较少,加上分化好的癌细胞与增生间皮难以分辨,造成诊断者的忧虑,而出现异型、疑癌细胞的报告内容。细胞蜡块HE切片中细胞的分布保留与实体组织类似的排列结构,可提高诊断的准确性。而且细胞蜡块的连续切片可应用于免疫组织化学染色,为肿瘤分型提供客观依据,有利于提示临床确定相关部位的原发灶,正如本实验结合细胞形态与免疫组织化学结果,再根据临床病史、阳性体征,先后诊断了小细胞癌、转移性乳腺癌、卵巢癌。国外学者UGURLUOGLU[3]和MIYOSHI[4]等也强调细胞蜡块的诊断价值。并且有研究指出,细胞蜡块是晚期非小细胞肺癌ALK检测的良好替代物[5]。
EGFR是一种调节细胞生长、增殖和分化,抑制细胞凋亡的跨膜蛋白,在非小细胞肺癌患者中检测EGFR基因的突变状态具有重要的临床意义,是决定患者是否能够应用EGFR-TKIs治疗的先决条件[6]。ARMS法利用特异性引物选择性的扩增突变基因,而荧光探针在Taq酶的作用下水解释放荧光,在qRT-PCR仪平台上进行DNA样本的基因突变检测,ARMS法比直接测序法更加敏感,可检测样本中低至1%的突变,更适用于肿瘤含量较少的标本检测[7]。本实验采用ARMS法分别检测胸水细胞蜡块和同期活检或手术标本组织块的EGFR基因突变情况,发现用细胞蜡块与组织块检测EGFR基因突变的阳性率及男女构成比无差异,2种样本的检测效果相当,本研究中19和21号外显子的突变检出率达95%左右,与文献报道基本一致[8-9]。
按照细胞学涂片诊断癌→结合细胞蜡块形态学和免疫组织化学结果诊断为肺腺癌→ARMS-qPCR法检测EGFR基因突变的流程处理肺癌胸水标本,确实行之有效、值得推广。细胞蜡块一方面有助于明确诊断肿瘤的类型、来源,另一方面可成为DNA提取的样品来源,国内已有用HRM方法检测胸水腺癌细胞蜡块EGFR基因突变的可行性研究[10]。伴有癌性胸水的晚期肺癌患者,肿瘤实体活检组织往往难以获取,此时细胞蜡块可用于相关驱动基因的检测,有利于临床筛选靶向用药适用患者及判断耐药机制,从而更好地为患者制定个体化治疗方案。

