豚鼠脑基底动脉平滑肌细胞的原代培养及鉴定*
肖靖杰,张治平,王洋,司超,张亮,张伟,李丽,李新芝,马克涛
[1.石河子大学医学院 生理学教研室,新疆 石河子832003;2.石河子大学医学院第一附属医院 耳鼻喉科,新疆 石河子 832008;3.石河子大学医学院第一附属医院 老干二科,新疆 石河子 832008;4.石河子大学医学院 病理生理学教研室(新疆地方与民族高发病教育部重点实验室),新疆 石河子832003]
有研究表明,血管平滑肌细胞(smooth muscle cells, SMCs)增殖、迁移及黏附等功能的变化在脑卒中、缺血缺氧性耳聋和Meniere综合症等疾病的发生、发展过程中扮演重要角色[1-6]。因此,建立一种简单而高效的脑血管SMCs的培养方法对研究上述疾病的发病机制有重要意义。脑基底动脉细小,分离困难,直接贴壁法操作难度大,成功率低,而酶消化法的时间和浓度不易掌握[7-8]。本实验在参照国内外文献报道的基础上,最终联合应用这2种常用的方法,培养出大量脑基底动脉SMCs,经鉴定,其纯度高,生长状况良好。
1 材料与方法
1.1 材料
1.1.1 实验动物 豚鼠约2周龄,体重145~185 g,雌雄不限,购自新疆医科大学动物实验中心。动物使用许可证批号:SCXK新(2003-0001),动物质量符合一级标准。饲养和实验过程均严格遵守《石河子大学医学伦理委员会条例》。
1.1.2 主要试剂 DMEM/F12培养基、胎牛血清、胰蛋白酶、青霉素、链霉素购自美国Hyclone公司,平滑肌肌动蛋白(α-SM-actin)抗体(英国abcam公司)、β-actin一抗和二抗、即用型链霉亲和素-生物素复合物试剂盒、二氨基联苯胺(Diaminobenzidine, DAB)显色试剂盒购自北京中杉金桥生物技术有限公司,牛血清蛋白(bovine serum albumin, BSA)(美国Blotopped公司),碘化丙啶(propidium iodide, PI)(北京索莱宝科技有限公司),磷酸盐缓冲溶液(phosphate buffer saline, PBS)、Triton-x-100购自上海生工生物工程股份有限公司,其余试剂为国产分析纯。
1.1.3 主要仪器 二氧化碳恒温培养箱(美国Thermo公司),荧光倒置显微镜(日本Olympus公司),倒置相差显微镜(美国Motic公司),激光共聚焦显微镜(德国ZEISS公司),电泳仪、电转膜仪、GEL-DOC2000凝胶成像仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 原代培养 豚鼠3只,麻醉后断头处死,无菌条件下迅速取出全脑,分离出脑基底动脉并小心去除血管周围的结缔组织。将分离出的动脉放入预冷不含Ca2+和Mg2+的Hank’s液中,漂洗2、3次,移入无菌台操作。
将基底动脉移入装含Hank’s液的培养皿中,剪成3~5 mm的片段,将血管片段放入浓度为0.125%的胰蛋白酶中,置于二氧化碳培养箱中消化20 min,每隔5 min轻轻晃动培养皿,并轻轻吹打3、4次,消化完成后,立即终止消化,1 000 r/min离心5 min,弃上清液。剩余血管片段加入几滴含20%胎牛血清的培养基,轻轻混匀,均匀铺在培养皿中。血管片段间隙2~3 mm,培养皿倒扣置于培养箱中2 h。翻转培养皿,加入含20%胎牛血清的培养基,放回培养箱中,静置3 d。第3天进行首次换液,第6~8天可见细胞由组织边缘长出,约2周时长满培养皿,并进行首次传代。
1.2.2 细胞传代 当细胞生长密度达80%~90%时,可进行传代[9]。弃培养基,PBS洗2、3遍,取浓度为0.25%的胰蛋白酶(含0.02%乙二胺四乙酸)进行消化,镜下可见细胞边缘折光增强,成片皱缩变圆且细胞间隙逐渐变大。当见细胞大部分脱落时立即终止消化,并夹弃较大的血管片段,收集细胞悬液,1 000 r/min离心5 min,弃上清液,加入培养基轻轻吹打混匀,分别移入2个新的35 mm培养皿中,置于培养箱中继续培养。
1.2.3 细胞纯化 由于脑基底动脉直径小,不容易去除内膜和外层的纤维层,所以在细胞传代的过程中,根据成纤维细胞和SMCs不同的贴壁时间,采用自然纯化法和差异贴壁法对细胞进行纯化。成纤维细胞的贴壁能力大于SMCs,而SMCs的贴壁能力大于内皮细胞[10]。同时,由于内皮细胞培养条件较严格,在上述条件下无法存活[11]。因此在传代时,根据上述规律,首先将细胞悬液移入35 mm培养皿中,静置30 min,使部分细胞贴壁,然后吸取上层细胞悬液移入另一个新的培养皿中,再次静置30 min,最后吸取第2个皿中的细胞悬液移入第3个培养皿中,收集第3个培养皿中的细胞即可获得较纯的平滑肌细胞。
1.2.4 细胞鉴定 ①形态学观察:应用倒置相差显微镜观察并拍照记录细胞的大小、形态、生长方式及肌丝排列特点等。②免疫荧光染色:取第4代处于对数生长期的细胞,均匀种植到放置玻片的6孔板中,使细胞爬片。3 d后,弃培养基,37℃预温的PBS洗3次,5 min/次,4%多聚甲醛固定15 min,PBS洗3次,0.2% Triton-x-100透化细胞3 min,PBS洗3次,在含5% BSA的37℃恒温箱封闭30 min,PBS洗3次。加入一抗α-SM-actin(1∶300),湿盒置入4℃冰箱中过夜。次日,37℃恒温箱复温30 min,PBS洗3次。暗室中,加入二抗(1∶50),37℃恒温孵育1 h,PBS洗3次,PI染核,抗荧光淬灭剂封片,用激光共聚焦显微镜采集图像,分析结果。③免疫组织化学法染色:细胞爬片,透化,3% H2O2-甲醇封闭5 min,PBS洗3次。加入α-SM-actin,4℃过夜。PBS洗3次,滴加二抗类似物(山羊抗兔IgG/HRP聚合物),37℃孵育30 min,PBS洗3次,DAB溶液显色,蒸馏水冲洗,苏木精复染,自来水反蓝,中性树胶封片,收集图像。④Western blot检测:收集细胞,裂解并提取总蛋白质,BCA法测蛋白浓度。加入适量上样缓冲液煮沸,冻存备用。采用聚丙烯酰胺凝胶电泳后转至硝酸纤维素膜,5% BSA封闭2 h,加入α-SM-actin(1∶1 000),4℃过夜,三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20, TBST)洗膜,二抗(1∶20 000)室温孵育2 h,TBST洗膜,于暗室中滴加发光试剂,压片、显影、定影,采集图像后用Quantity One软件进行分析。
2 结果
2.1 细胞培养结果
脑基底动脉血管片段贴于培养皿6 d后,约85%组织块存活,镜下可观察到大量细胞从组织块边缘游离出来(见图1A);至10 d左右,随着细胞的增殖,培养皿内可见大量平行生长的细胞;18 d左右可见细胞铺满皿底(见图1B)。细胞大小形态不一,呈梭形、三角形或带状,有长短不一的胞突,胞质丰富,胞核呈卵圆形,居中,部分可见双核甚至多核。细胞密度较低时,常交织成网状,而培养至22 d左右,细胞密度较高,呈螺旋状或栅栏状,表现为典型的“峰-谷”样生长(见图1C)。利用细胞的生长特点进行反复纯化,平滑肌细胞的纯度越来越高,第4代后细胞纯度>95%。
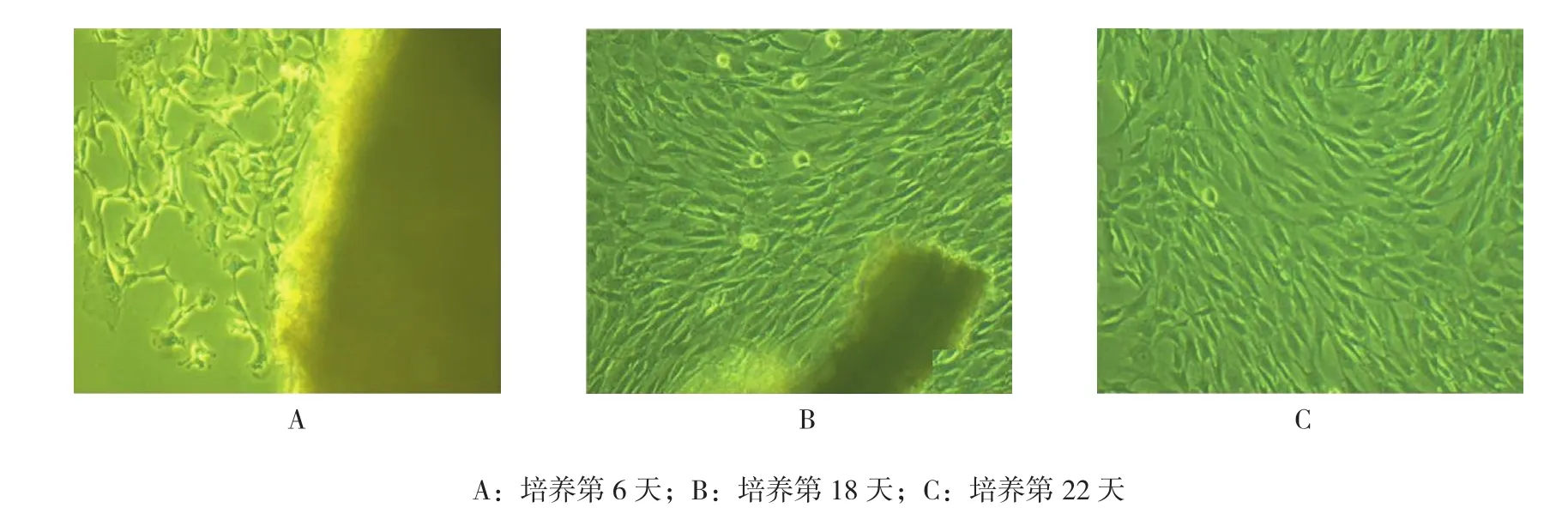
图1 脑基底动脉平滑肌细胞生长过程 (×100)
2.2 平滑肌细胞的鉴定结果
2.2.1 免疫荧光染色鉴定结果 取第4代细胞,爬片后经平滑肌细胞特异的肌动蛋白(α-SM-actin)抗体进行细胞免疫荧光染色,结果显示肌动蛋白阳性表达率达95%(见图2A)。经PI染核,胞核呈红色(见图2B)。图2C为图2A和图2B合并。
2.2.2 免疫组织化学法染色鉴定结果 取第4代细胞,爬片后经肌动蛋白抗体进行免疫组织化学法染色,镜下可见胞质内含大量棕黄色颗粒,呈线性排列且与细胞长轴平行,细胞核呈卵圆形,居中。(见图3)。
2.2.3 平滑肌肌动蛋白的表达 收集第4代细胞,裂解并提取总蛋白,Western blot检测平滑肌特异性的肌动蛋白的表达,结果显示肌动蛋白呈阳性表达。见图4。

图2 平滑肌细胞 (免疫荧光染色×200)

图3 平滑肌细胞中α肌动蛋白丝 (免疫组织化学法)

图4 平滑肌细胞肌动蛋白的表达
3 讨论
动脉粥样硬化是缺血性脑卒中、缺血缺氧性耳聋及Meniere综合征等疾病的重要病因。近年来研究显示,颅内、外动脉粥样硬化可能具有不同的危险因素和发病机制[12]。SMCs是血管中膜的主要组成成分,当血管发生损伤时,SMCs可发生表型转化,从静息态的收缩表型转变为增生态的合成表型,重新获得向内膜迁移、增殖的能力。同时,血管SMCs表型转化引发的增殖、迁移及黏附等功能变化为脑动脉粥样硬化、术后再狭窄等病理演变过程中的共同特征。
众所周知,耳蜗螺旋动脉是供应耳蜗血流的唯一动脉,其上游依次是小脑前下动脉和脑基底动脉,且耳蜗螺旋动脉侧枝循环较少,一旦发生堵塞,不易代偿,可造成耳蜗微循环的障碍及病理性的损害。因此,一方面,脑基底动脉发生动脉粥样硬化是造成缺血性脑卒中的重要因素;另一方面,脑基底动脉和耳蜗螺旋动脉的血流供应对维持正常听力十分重要。
就培养颅内动脉SMCs而言,多取材于牛、猪、犬、兔等较粗大的脑血管,而对于豚鼠,其脑基底动脉细小,分离困难。由于目前缺乏简单、经济的SMCs培养方法,大大制约对其相关病理生理变化的研究。本实验详细描述脑基底动脉的分离,原代细胞的培养、纯化及鉴定方法,从而建立一种简单经济、高效的脑基底SMCs培养方法。本实验发现,6 d左右组织块边缘有SMCs游离出来,18 d左右可铺满皿底,第3代即可得到较纯的SMCs。经鉴定,在形态上,细胞呈典型的“峰-谷”样生长。经免疫荧光和免疫组织化学法染色结果显示,第4代细胞的肌动蛋白阳性表达率达95%,而Western blot检测结果亦同样显示肌动蛋白呈阳性表达。
SMCs培养过程中最大的问题就是细胞的纯化,即如何去除混杂在其中的内皮细胞和成纤维细胞。文献报道,酶消化法和组织贴块法是培养平滑肌细胞最常用的2种方法[7-8]。虽然酶消化法培养细胞周期较短,但是消化酶作用的时间和浓度不易掌握,且酶本身对细胞就有一定的毒性作用;相比较而言,组织贴块法操作简便,不易发生污染,但培养周期较长。微小动脉的血管由3层细胞组成:外层的成纤维细胞,中间层的平滑肌细胞和内层的内皮细胞。培养大血管SMCs时,可以通过机械刮除的方式去除成纤维细胞和内皮细胞,但脑基底动脉较细小,不宜采用上述方式。经过尝试,本实验最终选择将2种方法联合使用。
实验中有以下几个关键步骤需要注意:①选择动物时,由于豚鼠具有与人类类似的耳蜗解剖结构,在相同条件下,年幼豚鼠的组织块较年长豚鼠有更好的增殖潜能,在保证组织足够的情况下,本实验选用约2周龄的新生豚鼠;②分离脑基底动脉时动作一定要轻柔,避免对血管过度牵拉造成损伤;③细胞生长具有密度依赖性,组织块以1 mm×1 mm为宜,间距2~3 mm,以保证细胞有足够的生长空间,且能保持合适的生长密度;④组织贴块时,培养皿倒扣的时间为2 h,时间过短贴壁不牢,过长则会导致组织块干涸;⑤原代细胞培养时选用含20%胎牛血清的培养基,血清浓度过低会降低培养的成功率,而传代培养时,开始几代血清浓度可降为15%,以后传代则为10%。
通过本研究方法可以得到大量高纯度的豚鼠脑基底动脉SMCs,有望为缺血性脑卒中和缺血缺氧性耳聋等疾病的病理生理变化的体外研究及脑血管平滑肌药物评价提供一个理想的实验材料。

