燕麦β-葡聚糖对脓毒血症大鼠肠黏膜损伤的保护作用及其机制探讨*
吴昆鹏,陈莹,游晓星,黄治家,言彩红
(1.南华大学附属第二医院 重症医学科,湖南 衡阳421001;2.南华大学附属第二医院麻醉科,湖南 衡阳421001;3.南华大学 微生物研究所,湖南 衡阳 421001)
肠功能损伤是脓毒血症的一个关键特征。目前研究表明,小肠在脓毒血症的病理生理过程中起中心作用,并且称为全身性炎症反应的始动因素[1]。重症患者常见肠道屏障功能紊乱及其引起的细菌易位,其在脓毒血症的发病机制中起重要作用[2-3]。此外,研究表明,危重疾病进展为多器官功能障碍综合征与肠道通透性增加有关[4]。如何预防或改善炎症性肠道屏障功能障碍是脓毒血症基础和临床研究的重要方向。燕麦β-葡聚糖(oat β-glucan, Oglu)对肠道功能的保护作用已得到广泛认可,本研究将其引入脓毒血症动物模型,观察Oglu是否可以减轻脓毒血症大鼠的小肠损伤,并探索其潜在的作用机制
1 材料与方法
1.1 实验动物及分组
50只SD雄性大鼠,8周龄,体重250~300 g,实验前禁食24 h,饮水不限。由南华大学实验动物部提供[许可证号:SYXK(湘)2015~0001]。按随机数字表法分为对照组(10只),脓毒血症组(20只),Oglu组(20只)。实验前均适应性喂养3 d。脓毒血症组和Oglu组以改良盲肠结扎穿孔法(cecal ligation and puncture, CLP)复制脓毒血症模型[5]。
1.2 主要试剂
Oglu(南通振华生物工程有限公司),细胞总蛋白提取试剂盒(美国Thermo Scientific公司),β-连环蛋白(β-catenin)多克隆抗体(ab6302)、基质金属蛋白酶-13(matrix metalloproteinase-13, MMP-13)多克隆抗体(ab39012)、T细胞因子(T cell factor-4, TCF-4)多克隆抗体(ab130014)、低氧诱导因子 -1(hypoxia-inducible factor-1, HIF-1α)单克隆抗体(ab463)购自美国Abcam公司,RevertAidTMFirst strand cDNA Synthesis Kit(立陶宛Fermentas公司),Trizol(美国 Invitrogen公司),SYBGreen PCR Mix(瑞士Roche Applied Science公司),酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)试剂盒(上海Dakewe Biotech公司)。
1.3 CLP模型的复制
对照组未做任何处理,脓毒血症组和Oglu组复制脓毒血症模型。将大鼠用40 mg/kg水合氯醛麻醉,在腹壁切开2 cm腹中线切口以暴露盲肠,用18号针刺穿2次。通过穿刺伤口挤出少量的盲肠内容物后,封闭手术切口。给予0.9%无菌盐水溶液,按24 ml/kg体重进行液体复苏。参照文献[6],Oglu组采用中剂量高分子量Oglu(3%,1 000 mg/kg)。Oglu组大鼠经口灌胃Oglu溶液,脓毒血症组和对照组大鼠喂养等量糖盐水。
1.4 ELISA
在Oglu或糖盐水灌胃后12和24 h收集全血。按照ELISA试剂盒说明书进行操作,测量血清白细胞介素 -6(Interleukin-6, IL-6)、肿瘤坏死因子 -α(tumor necrosis factor-α, TNF-α)和降钙素原(Procalcitonin,PCT)的浓度。
1.5 苏木精-伊红染色法
分别于实验12和24 h各处死大鼠5只,手术切除空肠组织标本,固定、石蜡包埋,用苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色。在光学显微镜下观察切片,空洞黏膜损伤的病理评分参照文献[7]。盲法测定:0级,正常黏膜和绒毛;1级,上皮间隙增大,血管堵塞;2级,上皮间隙明显扩大,上皮和固有层分离;3级,黏膜上皮和部分绒毛尖端剥落;4级,绒毛脱落,固有层和扩张血管暴露;5级,固有层显示分解,出血和溃疡。
1.6 PCR和Western blot检测
采用Trizol提取小肠黏膜组织RNA,紫外分光光度计检测RNA完整性及纯度,以1μg总RNA为模板进行逆转录,生成cDNA,具体步骤参照Fermentas RNA逆转录试剂盒说明书。获得的RNA置于-70℃冰箱备用。同时采用RIPA裂解液提取小肠组织总蛋白。用PCR、Western blot检测各组小肠组织中HIF-1α、β-catenin、TCF-4、MMP-13表达的变化。HIF-1α引物序列:5′-CTGGATGCTGGTGATTTAG AGTTCAAACTGAGTCAATCCCA-3′;β-catenin引物序列:5′-ATGGGTAGGGCAAATCAGTAAGAGGTA AGCATCGTATCACAGCAGGTTAC-3′;TCF-4引物序列:5′ -CGAGTGCACGTTGAAAGAAAATGTGAAGCT GTCGCTCCTT-3′;MMP-13引物序列:5′-GCCTTC CTCTTCTTGAGCTGTTGGACCACTTGAGAGTTCG-3′;β-actin引物序列:5′-GATATCGCCGCGCTCGTCG TCGGCTGGGGTGTTGAAGGTCTC-3′。取蛋白样品与上样缓冲液混合煮沸变性,电泳分离,转至聚偏氟乙烯膜,室温下加入脱脂奶粉封闭,分别加入HIF-1α单克隆抗体、β-catenin多克隆抗体、TCF4多克隆抗体、MMP-13多克隆抗体,室温下孵育过夜,在ECL化学发光检测系统上显影。所有实验程序经南华大学动物伦理委员会批准。
1.7 统计学方法
数据分析采用SSPS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠小肠黏膜病理学变化
不同时间的病理学检查结果显示,对照组均无肠黏膜损伤(见图1A、B)。然而,脓毒血症组上皮细胞间隙增大,绒毛上皮细胞和隐窝细胞数量减少,绒毛上皮排列紊乱,部分绒毛尖端溢出(见图1C、D)。相比之下,Oglu组上皮细胞间隙仅在少数区域扩大,隐窝上皮细胞丰富(见图1E、F)。
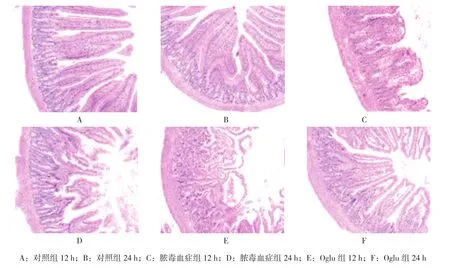
图1 各组大鼠不同时间的空肠组织病理学变化 (HE×100)
2.2 各组血清PCT、IL-6及TNF-α水平
对照组12h与24 h的血清PCT、IL-6及TNF-α水平比较,经t检验,差异无统计学意义(P>0.05)。对照组、脓毒血症组、Oglu组12和24 h血清PCT水平比较,经单因素方差分析,差异有统计学意义(F=143.967和 101.891, 均P=0.000)。3组 12和24 h血清IL-6水平比较,经单因素方差分析,差异有统计学意义(F=176.123和164.105,均P=0.000)。3组12和24 h血清TNF-α水平比较,经单因素方差分析,差异有统计学意义(F=499.941和217.978,均P=0.000)。进一步两两比较经LSD-t检验,脓毒血症组12和24 h血清PCT、IL-6及TNF-α水平高于其他组(P<0.05)。见表1和图2。
2.3 各组大鼠肠损伤评分比较
对照组、脓毒血症组、Oglu组大鼠12和24 h肠损伤评分比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,12 h时,脓毒血症组和Oglu组肠损伤评分高于对照组(P<0.05);24 h时,脓毒血症组肠损伤评分高于Oglu组和对照组(P<0.05)。见表2和图3。
2.4 Oglu对脓毒血症大鼠HIF-1α表达的影响
对照组、脓毒血症组、Oglu组大鼠肠黏膜组织中HIF-1α mRNA和蛋白表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,Oglu组HIF-1α mRNA和蛋白表达水平高于对照组和脓毒血症组(P<0.05)。见表3和图4。
表1 各组大鼠不同时间血清PCT、IL-6及TNF-α水平比较(n =5,±s)
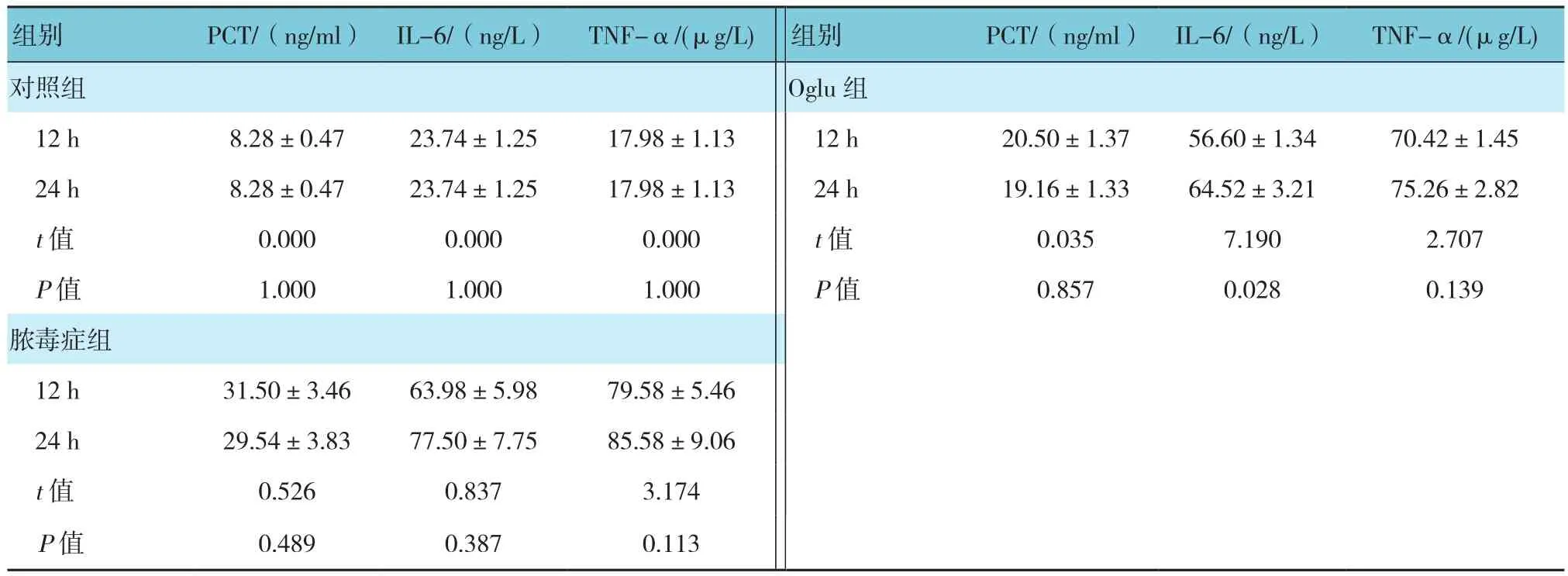
表1 各组大鼠不同时间血清PCT、IL-6及TNF-α水平比较(n =5,±s)
组别 PCT/(ng/ml) IL-6/(ng/L) TNF-α/(μg/L)对照组12 h 8.28±0.47 23.74±1.25 17.98±1.13 24 h 8.28±0.47 23.74±1.25 17.98±1.13 t值 0.000 0.000 0.000 P值 1.000 1.000 1.000脓毒症组12 h 31.50±3.46 63.98±5.98 79.58±5.46 24 h 29.54±3.83 77.50±7.75 85.58±9.06 t值 0.526 0.837 3.174 P值 0.489 0.387 0.113组别 PCT/(ng/ml) IL-6/(ng/L) TNF-α/(μg/L)Oglu组12 h 20.50±1.37 56.60±1.34 70.42±1.45 24 h 19.16±1.33 64.52±3.21 75.26±2.82 t值 0.035 7.190 2.707 P值 0.857 0.028 0.139
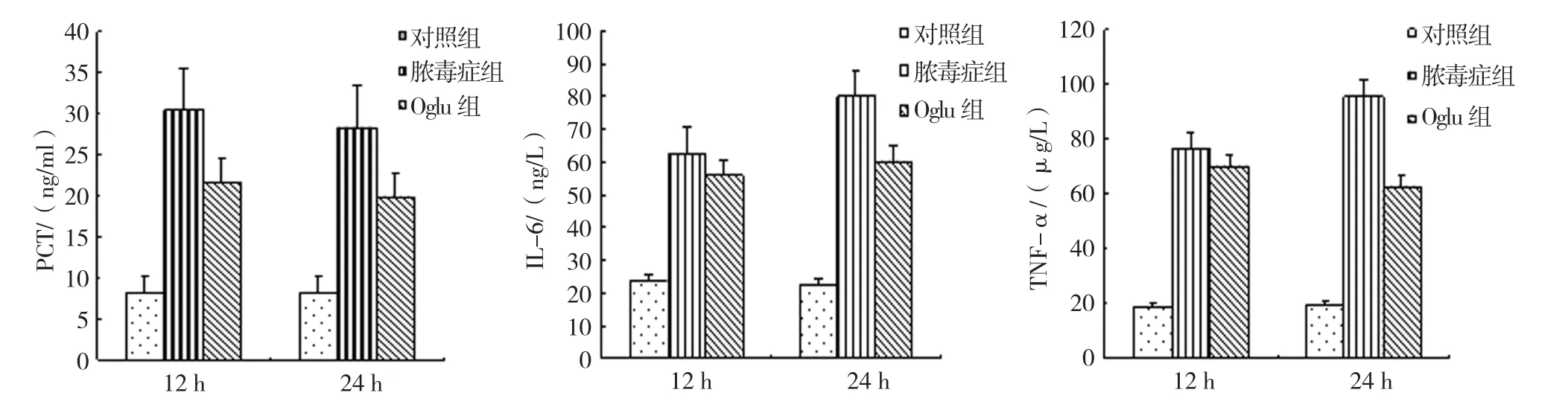
图2 各组大鼠不同时间的血清炎症指标比较 (n =5,±s)
表2 各组大鼠不同时间肠损伤评分比较(n =5,分,±s)
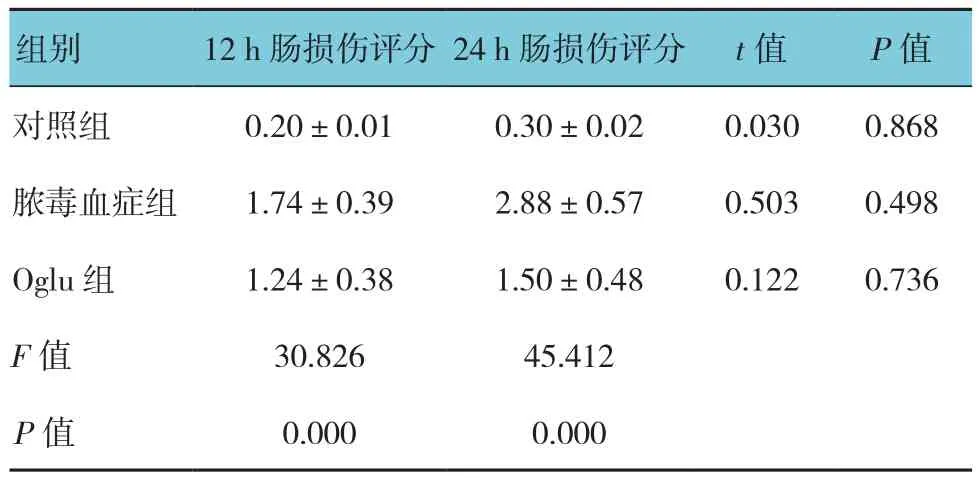
表2 各组大鼠不同时间肠损伤评分比较(n =5,分,±s)
组别 12 h肠损伤评分 24 h肠损伤评分 t值 P值对照组 0.20±0.01 0.30±0.02 0.030 0.868脓毒血症组 1.74±0.39 2.88±0.57 0.503 0.498 Oglu组 1.24±0.38 1.50±0.48 0.122 0.736 F值 30.826 45.412 P值 0.000 0.000
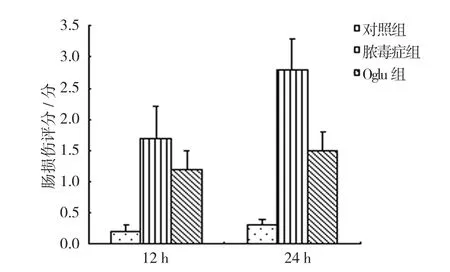
图3 各组大鼠不同时间的肠损伤评分比较 (n =5,±s)
表3 各组大鼠肠黏膜组织中HIF-1α mRNA和蛋白表达水平比较 (±s)
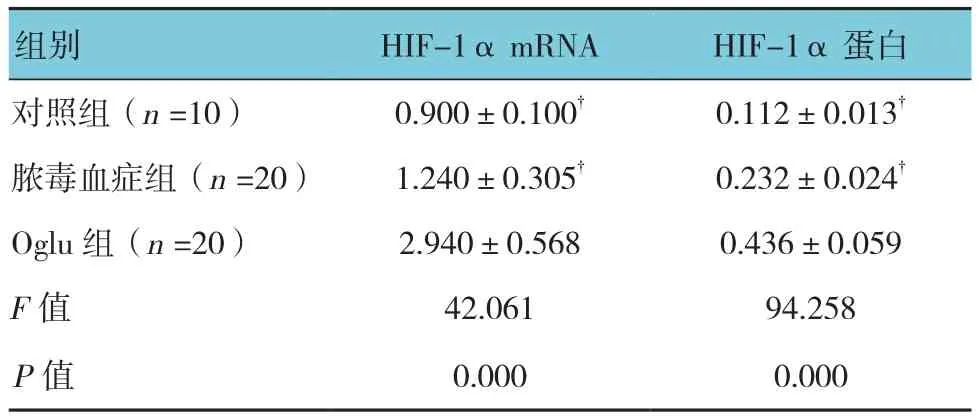
表3 各组大鼠肠黏膜组织中HIF-1α mRNA和蛋白表达水平比较 (±s)
注:†与Oglu组比较,P <0.05
组别 HIF-1α mRNA HIF-1α蛋白对照组(n =10) 0.900±0.100† 0.112±0.013†脓毒血症组(n =20) 1.240±0.305† 0.232±0.024†Oglu组(n =20) 2.940±0.568 0.436±0.059 F值 42.061 94.258 P值 0.000 0.000

图4 各组大鼠肠黏膜组织中HIF-1α蛋白的表达
2.5 实验前后各组Wnt/β-catenin信号通路相关分子的表达
2.5.1 β-catenin 对照组、脓毒血症组、Oglu组大鼠肠黏膜组织中β-catenin mRNA和蛋白表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,脓毒血症组β-catenin mRNA和蛋白表达水平高于对照组和Oglu组(P<0.05)。见表 4和图 5。
表4 各组大鼠肠黏膜组织中β-catenin mRNA和蛋白表达水平比较 (±s)
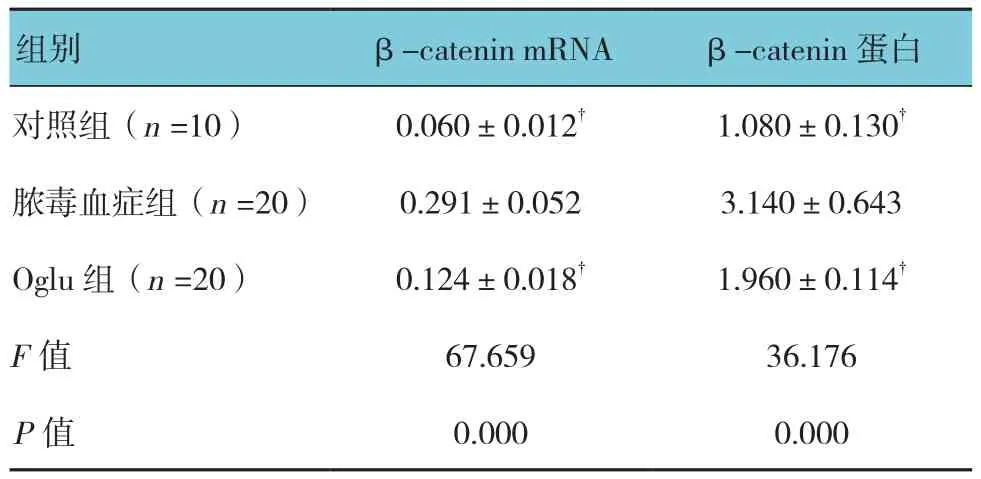
表4 各组大鼠肠黏膜组织中β-catenin mRNA和蛋白表达水平比较 (±s)
注:†与Oglu组比较,P <0.05
组别 β-catenin mRNA β-catenin蛋白对照组(n =10) 0.060±0.012† 1.080±0.130†脓毒血症组(n =20) 0.291±0.052 3.140±0.643 Oglu组(n =20) 0.124±0.018† 1.960±0.114†F值 67.659 36.176 P值 0.000 0.000
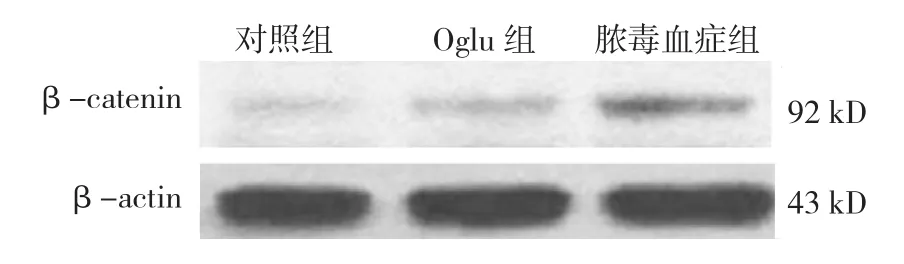
图5 各组大鼠肠黏膜组织中β-catenin蛋白的表达
2.5.2 TCF-4 Wnt/β-catenin信号通路激活后,可进一步活化核转录因子TCF-4。对照组、脓毒血症组、Oglu组大鼠肠黏膜组织中TCF-4 mRNA和蛋白表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,脓毒血症组TCF-4 mRNA和蛋白表达水平高于对照组和Oglu组(P<0.05)。见表 5和图 6。
表5 各组大鼠肠黏膜组织中TCF-4 mRNA和蛋白表达水平比较 (±s)
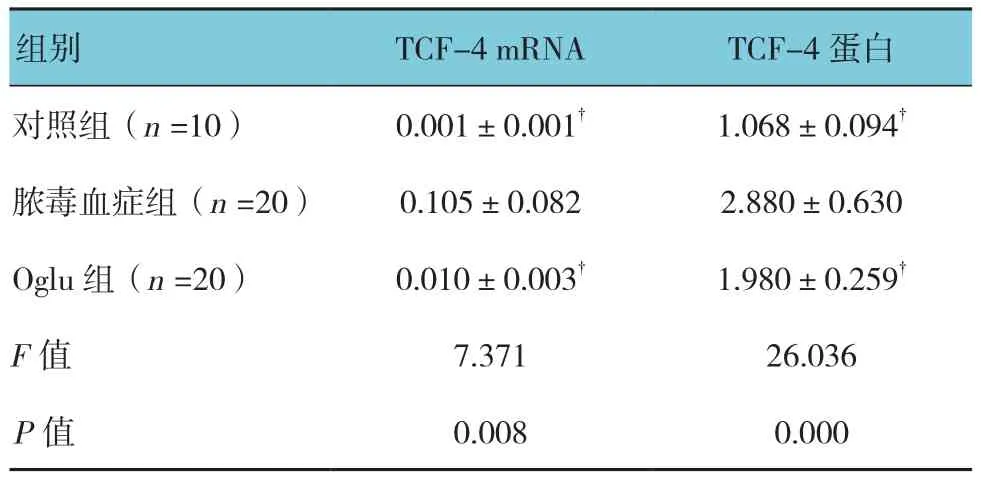
表5 各组大鼠肠黏膜组织中TCF-4 mRNA和蛋白表达水平比较 (±s)
注:†与脓毒血症组比较,P <0.05
组别 TCF-4 mRNA TCF-4蛋白对照组(n =10) 0.001±0.001† 1.068±0.094†脓毒血症组(n =20) 0.105±0.082 2.880±0.630 Oglu组(n =20) 0.010±0.003† 1.980±0.259†F值 7.371 26.036 P值 0.008 0.000
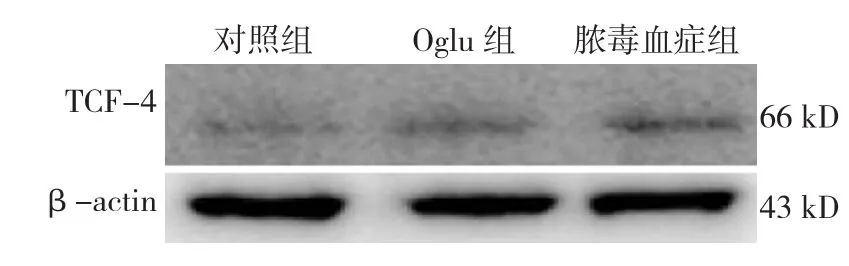
图6 各组大鼠肠黏膜组织中TCF-4蛋白的表达
2.5.3 MMP-13 对照组、脓毒血症组、Oglu组大鼠肠黏膜组织中MMP-13 mRNA和蛋白表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,脓毒血症组MMP-13 mRNA和蛋白表达水平高于对照组和Oglu组(P<0.05)。见表 6和图 7。
表6 各组大鼠肠黏膜组织中MMP-13 mRNA和蛋白表达水平比较 (±s)
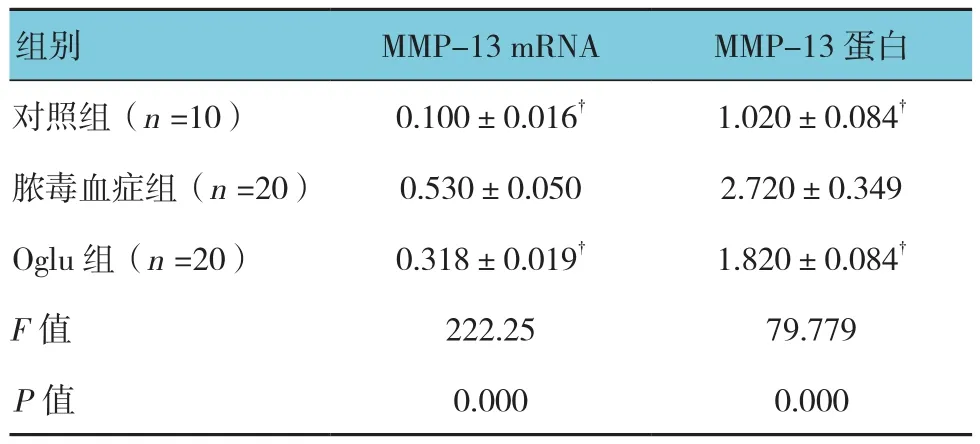
表6 各组大鼠肠黏膜组织中MMP-13 mRNA和蛋白表达水平比较 (±s)
注:†与脓毒血症组比较,P <0.05
组别 MMP-13 mRNA MMP-13蛋白对照组(n =10) 0.100±0.016† 1.020±0.084†脓毒血症组(n =20) 0.530±0.050 2.720±0.349 Oglu组(n =20) 0.318±0.019† 1.820±0.084†F值 222.25 79.779 P值 0.000 0.000
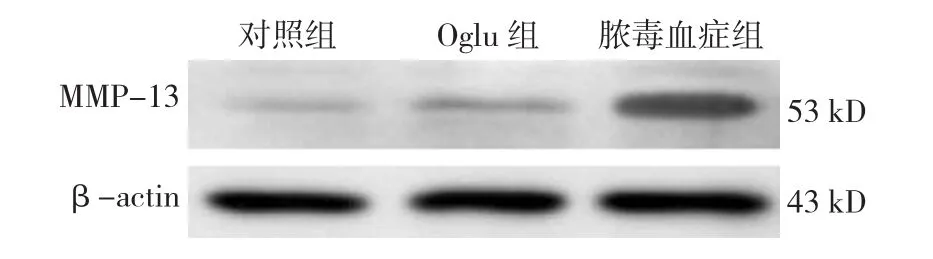
图7 各组大鼠肠黏膜组织中MMP-13蛋白的表达
3 讨论
日常生活中,燕麦对人体有很好的保健作用,对胃肠道有调节保护作用,但具体作用机制并不清楚。本研究采用燕麦中的主要有效成分β-葡聚糖进行实验,探索其保护肠道的作用机制。首先,本研究观察到Oglu能减轻脓毒血症诱导的空肠病理改变,抑制炎症反应,如脓毒血症模型大鼠中血清PCT、IL-6及TNF-α水平降低。进一步探索Oglu保护空肠的分子机制,结果表明Oglu对炎症细胞因子的抑制作用可能与上调HIF-1α表达,并调控Wnt/β-catenin信号通路有关。
HIF-1α是人体组织中广泛表达的转录因子,常氧环境下在胞浆内表达,但极不稳定,很快降解(约5 min)。而在低氧环境下可抑制HIF-1α降解,从而引起其在胞内积聚并转位至胞核,在胞核内与HIF-1β形成二聚体,发挥转录活性,最终激活下游各种与细胞增殖分化相关的基因的转录[8]。基础研究证实,HIF-1α是低氧环境中起细胞调控作用的关键基因,HIF-1α在细胞中表达增加可能对低氧诱导的病理生理过程产生积极影响,对缺血性疾病是有利的[9-11]。低氧能调节多信号途径,增加自我更新,同时减少基质MIAMI细胞的分化,减少细胞衰老和凋亡,这是人体在缺氧条件下自我修复的能力,HIF-1α表达上调就是这其中极为重要的一环[12]。脓毒血症早期血流动力学改变,导致血流重新分布,同时动静脉分流,胃肠黏膜血流减少,肠道缺血再灌注,肠黏膜屏障受损,是启动MODS的重要因素[13-15]。低氧刺激,脓毒血症肠黏膜中HIF-1α表达上调,继而引起有效的抗炎作用,在降低氧利用度的条件下限制组织损伤[16]。本研究结果表明,脓毒血症组小肠组织中HIF-1α水平较对照组表达升高,使用Oglu后,脓毒血症大鼠小肠组织中HIF-1α水平进一步升高,与对照组和脓毒血症组有差异。结果表明,Oglu能促进低氧时肠黏膜细胞合成HIF-1α,其对HIF-1α的调控作用,可能是其发挥肠道抗缺血缺氧作用的关键机制之一。
Wnt通路是决定胚胎发育过程和成体组织细胞命运的基本信号机制之一。在肠上皮中,该途径调节肠干细胞的增殖。近年来研究发现,Wnt通路在成体肠细胞的自我更新和分化中起关键作用[17-18]。Wnt/β-catenin信号通路主要包括Wnt蛋白家族、β-连环蛋白及相关抑制因子,所谓经典Wnt信号传导的关键分子是β-连环蛋白[19]。许多研究显示,Wnt/β-连环蛋白信号传导参与肠发育和组织代谢,包括β-连环蛋白或Tcf4基因的遗传消融或扩散性细胞外Wnt信号传导抑制剂的产生[20]。Wnt拮抗剂Dickkopf-1(Dkk1)在肠上皮中的转基因表达影响小肠中的增殖和隐窝-绒毛组织,由腺病毒递送介导的Dkk1系统表达诱导小肠和结肠的快速变性[21-22]。Wnt/β-catenin是机体内一条非常保守的信号通路,启动因子是Wnt蛋白,在无Wnt蛋白启动因子刺激时,β-catenin与APC、GSK-3β、Axin等组成复合体,β-catenin被磷酸化降解,因此无法启动所调控的靶基因转录。当胞外信号激活Wnt时,Wnt蛋白和与跨膜受体卷曲蛋白的胞外区结合,导致Axin-GSK3β-APC-β-catenin复合体瓦解,β-catenin在细胞质中增多,依靠浓度梯度改变,进入核内与T细胞因子/淋巴增强因子结合,导致Wnt靶基因的表达,启动下游靶基因的转录,影响细胞的增值、分化、代谢及凋亡[23]。因此,β-catenin和TCF-4是Wnt/β-catenin信号通路中的关键分子。Wnt/β-catenin通路过度激活可使小肠上皮细胞过度分化、成熟加速,同时也导致蛋白酶表达异常,而加速细胞外基质降解,最终引起肠道功能紊乱甚至癌变[24]。本研究也发现,对照组和Oglu组大鼠小肠组织中β-catenin、TCF-4 mRNA和蛋白表达水平较低,而脓毒血症组β-catenin、TCF-4 mRNA和蛋白表达水平较高,表明Oglu可能通过下调Wnt/β-catenin/TCF-4通路,发挥对脓毒血症小肠损伤的保护作用。MMP-13是Wnt/β-catenin信号通路下游参与细胞外基质代谢的重要分子[25]。本研究结果发现,脓毒血症组MMP-13 mRNA和蛋白表达水平较高,对照组和Oglu组大鼠小肠组织中MMP-13表达水平较低,这与β-catenin和TCF-4的表达趋势一致,提示Oglu通过调控Wnt/β-catenin信号通路,发挥肠道保护作用。
综上所述,本研究结果初步表明,脓毒血症大鼠小肠损伤有HIF-1α和Wnt/β-catenin/TCF信号通路参与,低氧状态下Oglu对HIF-1α的合成有促进作用,对Wnt/β-catenin信号通路有一定的抑制作用,从而发挥对小肠保护作用。但依然存在许多问题需要进一步阐明,如Oglu对HIF-1α的调节是否仅限于促进合成,是否对HIF-1α的氧依赖蛋白降解过程也有影响,Oglu对Wnt/β-catenin信号通路的其他靶基因的调节情况如何?这些还有待进一步研究。

