功能化多孔聚氨酯薄膜的制备及其生物医学应用
徐婷婷,迟 波,毛 春,徐 虹
(1.南京工业大学食品与轻工学院材料化学工程国家重点实验室,江苏南京211800;2.南京师范大学化学与材料科学学院江苏省生物功能材料重点实验室,江苏南京210023)
组织工程学是一门以材料科学和细胞生物学相结合、进行体外或体内构建组织或器官的新兴学科。通常情况下,从病人的身上直接提取细胞,在支架上进行传代和扩增。通过适当的外界刺激,应用化学、生物、机械和电子等手段,在较短时间内形成新的组织。将这种新的组织重新植入病人体内,帮助其功能重建[1]。因此,应用于组织工程的支架必须满足特定要求,包括:相互贯穿的高度多孔结构,以满足细胞黏附和增殖的需求[2];三维支架结构,最大化的模拟组织相关环境以便促进细胞的粘附迁移,快速形成新的细胞外基质,从而促进组织生长和营养及代谢产物的运输[3]。
聚氨酯是一类在高分子结构主链上含有氨基甲酸酯基团(—NHCOO—)的聚合物[4],因其具有良好的生物相容性、优异的力学性能、耐磨损及易加工成型等优点,因此被应用于人工心脏瓣膜、血管涂层和药物控释等众多生物医学领域。考虑到聚氨酯满足组织工程学材料的一般要求,将其加以修饰改性制备多孔结构聚氨酯,有望成为组织工程支架领域的热门材料。目前,多孔结构聚氨酯的制备方法包括静电纺丝法、冷冻干燥法和相分离法等[5]。
肝素作为一种重要的抗凝药物,常在临床上用于减少医用材料表面的血栓形成[6]。它与抗凝血酶Ⅲ有很强的作用力,从而可以防止纤维蛋白凝块的形成。通过将肝素共价接枝在聚合物的表面,可以发挥长效抗血栓功效[7]。与此同时,肝素可以与生长因子等多种具有肝素结合域的蛋白相互作用,从而使生长因子与受体结合,确保其功能完好,免受水解作用的破坏[8]。
血管内皮生长因子(VEGF)在内皮细胞的迁移、增殖、分化、小管形成和生存中发挥积极作用,是触发和调节血管生成的主要因素之一[9]。在众多肝素特异性结合生长因子中,VEGF可在体内诱导血管新生,得到组织工程领域研究者的广泛关注。
本研究中,笔者采用肝素进行多孔聚氨酯薄膜的功能化改性,并且进一步采用VEGF对薄膜进行修饰,以制备生物活性涂层,同时对该涂层的血液相容性和细胞相容性进行分析评价,希望促进多孔聚氨酯组织工程材料在新生血管方向的应用。
1 材料与方法
1.1 试剂与仪器
聚氨酯R180A(PU,医用级),苏州科颂聚合物有限公司;二甲亚砜(DMSO)、丙烯酸,国药集团化学试剂有限公司;肝素(heparin),Sigma中国有限公司;碳酰二亚胺盐酸盐(EDC·HCl),曲拉通(X-100),上海阿拉丁试剂有限公司。
RT-2204C型半自动血凝仪,美国雷杜公司;BD FACSCalibur型流式细胞仪,美国BD公司;KH3200型超声清洗仪,昆山禾创超声仪器有限公司;ESCALAB 250型X线光电子能谱(XPS)、Nicolet NEXUS670型红外光谱仪,赛默飞世尔科技有限公司;SYNERGY2型酶标仪,美国伯腾仪器有限公司;DZF-6050型真空干燥箱,上海博讯实业有限公司医疗设备厂;BX41型光学显微镜,日本奥林巴斯有限公司;SL200D型水接触角仪,美国科诺工业有限公司; JMS-7600F型扫描电子显微镜,日本电子株式会社。
1.2 聚氨酯多孔膜的制备
称取PU溶解于DMSO中,90 ℃机械搅拌24 h,配制成终质量分数10%的均相溶液。将溶液转移到直径为9 cm的培养皿中,-20 ℃静置24 h。将培养皿浸入冰水浴中,每3 h替换水溶液直到无肉眼可见溶剂浸出,用以除去有机溶剂DMSO。将制备好的多孔PU薄膜放入37 ℃烘箱干燥24 h,备用[10]。
1.3 肝素的固定
将制备好的多孔PU薄膜裁剪成2 cm×2 cm正方形,在异丙醇溶液中超声洗涤10 min,放入37 ℃烘箱干燥24 h。取出多孔PU薄膜,采用低温氧等离子体(120 W,10 s)处理。将处理后的多孔PU薄膜浸入丙烯酸溶液中浸泡12 h。然后将丙烯酸接枝的多孔PU薄膜浸入含有EDC(10 g/L)的柠檬酸盐缓冲溶液 (pH 5,20 mL) 中于4 ℃下静置2 h。最终将样品浸入含肝素(1.25 g/L)的柠檬酸盐缓冲溶液中4 ℃下反应24 h。取出PU薄膜,蒸馏水多次洗涤,室温干燥[11]。
1.4 肝素修饰的多孔PU薄膜的形态与结构表征
1.4.1 表面结构表征
傅里叶变换衰减全反射红外光谱可通过材料表面的反射信号获取材料表层有机成分的结构信息。检测样品包括:多孔PU薄膜、肝素修饰的多孔PU薄膜。
采用电子光谱仪对薄膜的化学成分进行分析。
1.4.2 水接触角测试
通过悬滴法测量薄膜的表面水接触角,每个样品所用水滴量为20 μL,平行实验设置3组。
1.4.3 扫描电子显微镜(SEM)测试
将待测样品表面喷金后,通过日本电子株式会社JMS-7600F型高分辨热场发射扫描电子显微镜观察样品表面形貌。
1.4.4 力学性能测试
采用系列Ⅸ自动化材料测试系统测量薄膜的杨氏模量和断裂应变,测试温度22 ℃,湿度30%,速度50 mm/min。
1.5 肝素修饰的多孔PU薄膜的血液相容性表征
1.5.1 全血与血小板黏附测试
实验用血为新鲜新西兰白兔全血,采用真空采血管耳静脉取血。为模拟体内环境,实验前将多孔PU薄膜浸泡于磷酸盐缓冲(PBS)溶液中(pH=7.4)平衡24 h。吸出PBS溶液,加入新鲜的全血(富血小板血浆),37 ℃下孵化1 h。吸出溶液,采用PBS溶液多次洗涤,加入2.5%(质量分数)的戊二醛固定液室温固定30 min。再次采用PBS溶液洗涤,依次用不同体积分数乙醇-水溶液(50%、60%、70%、80%、90%、95%和100%)脱水处理,每次间隔30 min,室温晾干。将样品表面喷金,通过扫描电子显微镜观察样品表面血细胞和血小板黏附情况[12]。
1.5.2 体外凝血时间测试
体外凝血时间测定包括:活化部分凝血酶时间(APTT)和凝血酶原时间(PT)和凝血酶时间(TT)[13]。具体操作步骤如下。
1)制备贫血小板血浆:真空采血管耳静脉抽取的新鲜兔全血以3 000 r/min转速离心处理15 min,取上层血浆即为贫血小板血浆。
2)将裁剪好的薄膜样品置于离心管中,加入1 mL贫血小板血浆。
3)37 ℃下孵育1 h,加入对应的APTT、PT和TT试剂。利用半自动血凝分析仪通过比浊法,根据待测样品在凝血过程中的吸光度变化来确定凝血时间。每个样品平行测试3次,同时以空白血浆作为空白对照[14]。
1.5.3 溶血率测试
将新鲜抽取的抗凝全血于1 500 r/min离心10 min除去上清液,再加入PBS后1 500 r/min 离心10 min, 重复洗涤2~3次,直至上清液澄清。用PBS溶液将所得红细胞配制成2%的红细胞悬浮液。将裁剪好的薄膜样品置于离心管中,加入1 mL PBS溶液,同时加入1 mL 2%的红细胞悬浮液。37 ℃静置孵化1.5 h。取出薄膜,将混合溶液于1 500 r/min离心10 min,取200 μL上层液体转移到96孔板中,在全自动酶标仪上读取570 nm下的吸光值。每个样品平行测试3次,同时设置PBS为阴性对照,蒸馏水为阳性对照,溶血率计算见式(1)。
溶血率=(ODt-ODnc)/(ODpc-ODnc)×100%
(1)
式中:ODt为样品吸光度;ODnc为阴性对照吸光度; ODpc为阳性对照吸光度[15]。
1.5.4 红细胞形态观察
将1.5.3节中样品孵化后离心得到的红细胞滴在玻璃载玻片上,采用奥林巴斯光学显微镜观察并记录红细胞形态[16]。
1.5.5 补体激活及血小板激活测试
将裁剪好的薄膜样品与贫血小板血浆在37 ℃下孵育1 h。然后采用商用试剂盒C3a Elisa kit (BD OptEIATM),通过测定活性片段C3a和C3a的脱-精氨酸的形成,来分析补体激活情况。
将裁剪好的薄膜样品与贫血小板血浆在37 ℃下孵育1 h。使用流式细胞仪来评估血小板的活化状态。通过测定荧光标记的血小板活化标记物——抗CD62P和血小板标记物——抗-CD42a的表达来衡量血小板激活的比例。
1.6 装载VEGF并测试其细胞活力和增殖
将肝素修饰后的多孔PU薄膜浸泡于VEGF溶液中(50 ng/mL),一定时间(2 h/24 h)后取出样品,用PBS溶液洗涤后用于细胞培养。为了评估PU-heparin-VEGF对血管内皮细胞(HUVEC)细胞活力的影响,将样品置于24孔板上,在每孔中加入5×105个细胞于完全培养基中培养HUVEC。为了评估PU-heparin-VEGF对HUVEC细胞增殖的影响,预先对HUVEC进行饥饿处理(只添加20 g/L牛血清)12 h,然后将细胞接种于多孔PU薄膜上,接种密度为5×104个/孔,培养96 h。培养过后,通过测定酸性磷酸酶的活性来反映细胞活力和增殖情况。具体方法如下:细胞培养过后的样品采用PBS溶液(1 mL)洗涤,之后置于培养箱中(37 ℃,5% CO2),在缓冲溶液中(含0.1 mol/L,pH5.5乙酸钠和0.1%曲拉通X-100)与对硝基苯磷酸(1 mg/mL)共孵化3 h。添加NaOH(1 mol/L)溶液终止反应,通过测量405 nm下的光密度(OD405)来计算活细胞的数量[17]。
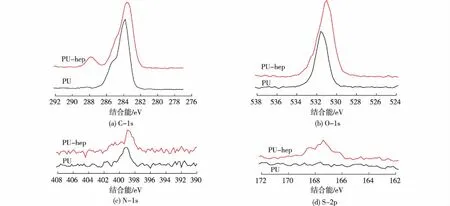
图2 多孔PU薄膜和多孔PU-肝素薄膜的光电子能谱图 Fig.2 ESCA of porous PU and PU-heparin film
2 结果与讨论
2.1 多孔PU薄膜的表面光谱分析


图1 多孔PU薄膜的红外光谱图Fig.1 FT-IR spectrum of porous polyurethane film
图2为多孔PU薄膜和多孔PU-肝素薄膜的光电子能谱图。由图2可知:多孔PU薄膜上主要的峰分别位于540~525 、408~396 、294~278 和174~162 eV,依次对应于O-1s、N-1s、C-1s和S-2p的峰。比较肝素修饰前后的多孔PU薄膜的峰值,O-1s、N-1s和C-1s的峰值没有出现明显变化,而修饰过后S-2p的峰值明显增强,对应于肝素中磺酸根的峰(表1)。由此可以证明肝素修饰多孔PU薄膜成功。

表1 多孔PU薄膜和多孔PU-肝素薄膜的光电子能谱图
2.2 多孔PU薄膜的水接触角测试
通过水接触角测试考察多孔PU薄膜的亲水性,结果如图3所示。由图3可知:与未经修饰的多孔PU薄膜相比(142.82°),修饰过后薄膜的水触角明显减小(38.72°),这是由于肝素中含有大量的羧基、羟基以及醚键等亲水性基团,使材料表面的亲水性增强,以此可以说明肝素被成功修饰至PU薄膜上。
2.3 多孔PU薄膜的表面形貌表征
图4为扫描电子显微镜观察到的多孔PU薄膜的表面形貌。由图4可知:由于在冷却过程中聚合物溶液经历了液相分离过程,因此,薄膜由许多大小不均一的致密孔结构组成,孔径范围为0.1~200 μm。此外,由于在接枝肝素的过程中使用了氧气等离子处理,所以多孔PU-heparin膜样品表面多孔结构受到一定程度的破坏,但贯通的孔结构依然存在,只是孔数量有一定减少,尤其是小孔的数量。多孔结构的保留为材料提供了较大的内表面积,为后期细胞的黏附和生长提供了保障。
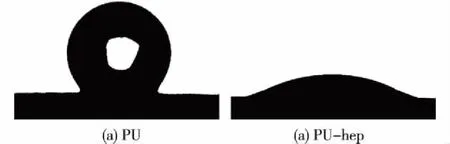
图3 多孔PU薄膜和多孔PU-肝素薄膜的水接触角图片Fig.3 Water contact angle pictures of porous PU and PU-heparin film
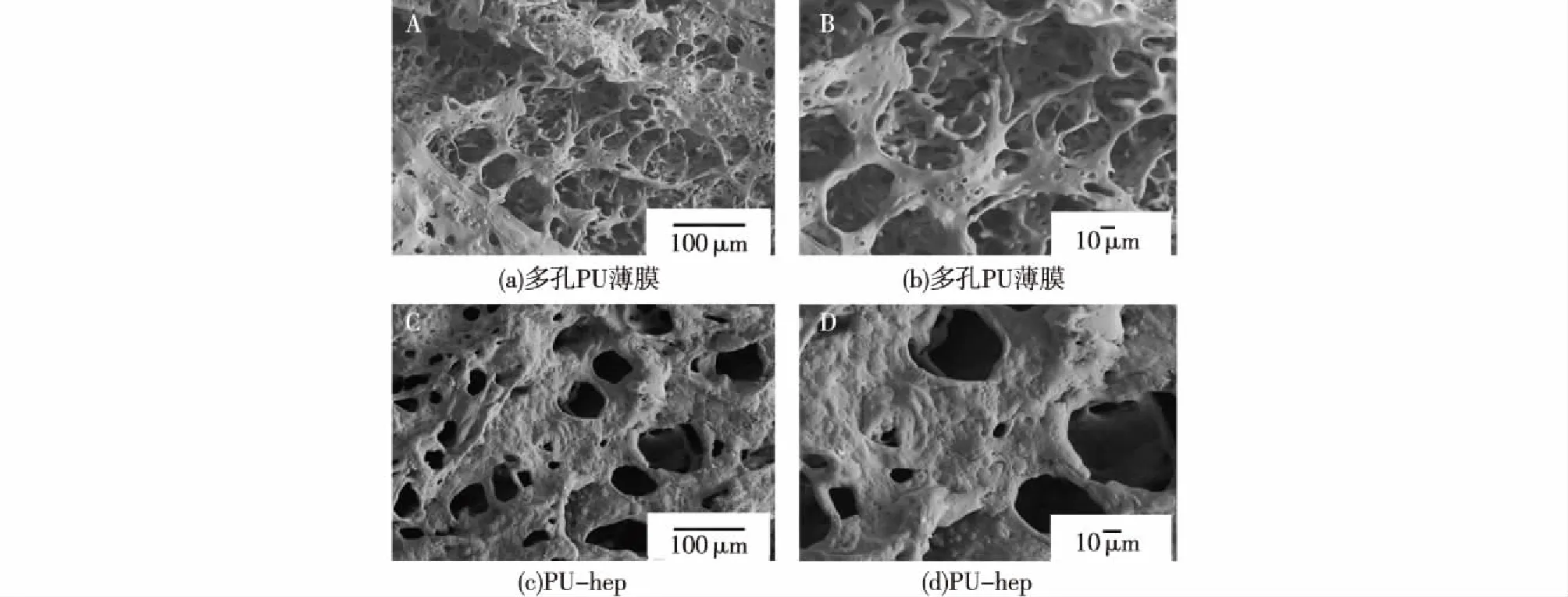
图4 PU和PU-hep薄膜的扫描电子显微镜结果Fig.4 SEM images of porous PU and PU-heparin films
2.4 多孔PU薄膜的力学性能测试
表2显示了多孔PU薄膜的力学性能测试结果。由表2可知:多孔PU薄膜的断裂伸长率为446%,杨氏模量为1.295;多孔PU-heparin薄膜的断裂伸长率为162%,杨氏模量为2.297。由于接枝肝素的过程中使用了等离子体处理,所以对膜的力学性能有一定损伤,多孔PU-heparin 薄膜的模量增大,断裂伸长率明显降低,多孔PU-heparin 薄膜的力学性能依然可以达到组织工程材料的要求[19]。
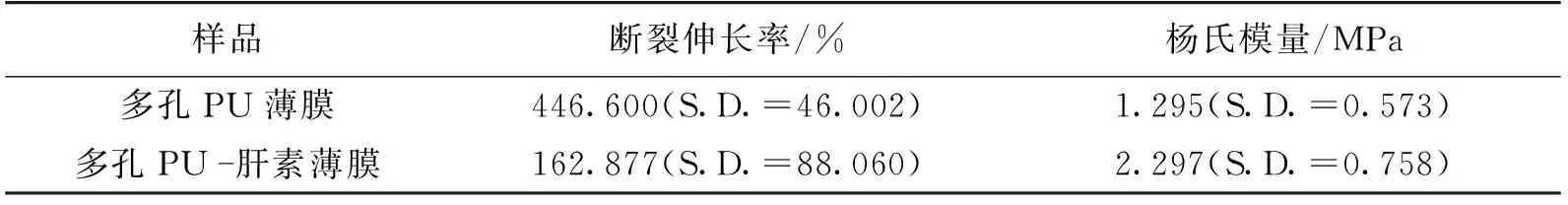
表2 多孔PU薄膜和多孔PU-肝素薄膜的断裂伸长率和杨氏模量
2.5 多孔PU薄膜的血液相容性评价
2.5.1 全血与血小板黏附情况分析
图5为多孔PU薄膜的血液相容性评价结果。由图5可知:在多孔PU薄膜上可以看到明显的红细胞和血小板黏附情况,大部分的血小板形貌破坏出现伪足;而多孔PU-heparin 薄膜的表面几乎未见黏附的红细胞和血小板。这表明了修饰肝素可以赋予多孔PU-heparin 薄膜优异的抗黏附特性。这是由于改性的肝素层中带有一定的负电荷,而红细胞膜本身也带有负电荷,通过静电排斥作用抑制了红细胞的黏附。

图5 血细胞黏附实验结果Fig.5 Results of blood-cell adhesion
2.5.2 体外凝血时间分析
体外凝血时间APTT、PT和TT常在临床上被用于判断血浆的异常情况。同时,它也可以被用于判断生物材料的体外抗凝血性能。分别对空白组、多孔PU薄膜和多孔PU-heparin 薄膜的体外凝血时间进行测定,结果见图6。由图6可知,肝素的修饰可以有效延长薄膜的体外凝血时间,赋予材料良好的抗凝血性能[20]。
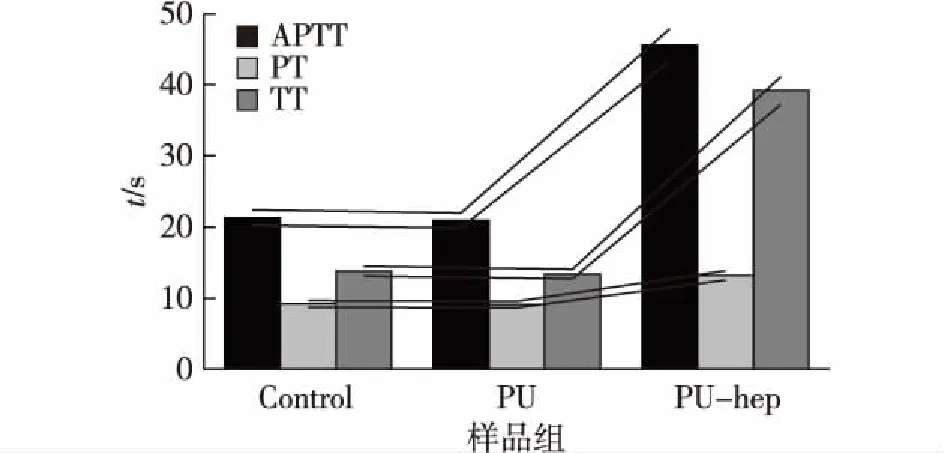
图6 多孔PU薄膜和多孔PU-heparin薄膜的 APTT/PT/TT体外凝血时间Fig.6 APTT/PT/TT of porous PU and PU-heparin films
2.5.3 溶血率分析
溶血率也是判断生物材料血液相容性的重要指标,生物材料必须满足溶血率<5%。图7为多孔PU薄膜和多孔PU-heparin薄膜的溶血率结果。由图7可知:多孔PU薄膜和多孔PU-heparin 薄膜溶血率均远小于规定值,因此可以判断薄膜具有良好的血液相容性能。

图7 多孔PU薄膜和多孔PU-heparin薄膜的溶血率Fig.7 Hemolysis of porous PU and PU-heparin memberances
2.5.4 红细胞形态分析
红细胞形态可以直观地反映材料的安全性能。图8为与多孔PU薄膜和多孔PU-heparin薄膜共孵化后的红细胞形态在光学显微镜下的照片。由图8可知,在PBS溶液中未经处理的红细胞显示出正常的凹饼状结构,而与多孔PU薄膜和多孔PU-heparin 薄膜孵化后,红细胞未出现形态学异常现象和凝集现象,与溶血率结果保持一致。

图8 光学显微镜下的红细胞形态照片Fig.8 Optical images of RBCs
2.5.5 补体激活和血小板激活情况分析
通过补体激活和血小板激活测试,可以从分子水平判断材料的血液相容性。在补体激活过程中,C3a是一个重要的标志物,它在血浆中的浓度可以直接反映补体激活程度。图9为多孔PU和PU-肝素薄膜的补体激活和血小板激活结果。由图9(a)可知,多孔PU-heparin 薄膜不会激活补体系统,将来这种材料植入体内由于不会激活补体系统所以不会进一步引发免疫系统的激活。
血小板激活能够在体内引起血栓的形成,所以血小板激活实验是评价与血液接触材料的一个必要实验。如图9(b)所示:相比于阴性对照组,多孔PU-heparin 薄膜组血小板激活率无明显差异,说明多孔PU-heparin 薄膜展示了良好的生物相容性,避免了在今后的植入应用中可能会引起的凝血级联反应及进而引发的血栓现象。

图9 与多孔PU和PU-肝素薄膜共孵化后的补体激活(a)和血小板激活情况(b)Fig.9 Complement activation (a) and platelet activation (b) upon interaction of porous PU and PU-heparin films
2.6 细胞活力评价
图10为多孔PU薄膜材料的细胞活力评价结果。由图10可见:加入VEGF培养的实验组吸光值均高于未加入VEGF的实验组吸光值,原因在于VEGF对HUVECs的生长有很好的促进作用,而且接枝肝素的聚氨酯多孔材料由于对VEGF有更高的装载量,同时对VEGF有着缓释作用,这些原因导致了多孔PU-heparin-VEGF薄膜比多孔PU -VEGF薄膜有更高的吸光值。从装载VEGF的时间上来看,装载24 h的吸光值也高于装载2 h的吸光值,说明装载时间也会对装载量造成影响。
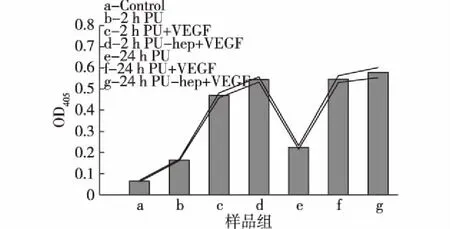
图10 细胞活力评价Fig.10 Cell viability evaluation
3 结论
采用热致相分离法制备了多孔PU薄膜,采用肝素进行多孔PU薄膜的功能化改性,实验结果表明,与改性前相比,修饰肝素可以赋予多孔PU薄膜优异的抗黏附特性,有效延长薄膜的体外凝血时间,降低溶血率,避免红细胞形态学异常现象和凝集现象,同时避免补体激活和血小板激活现象。因此,肝素修饰的多孔PU薄膜展示了良好的生物相容性。此外,进一步采用VEGF对薄膜进行修饰,可以有效提高生物活性涂层的细胞活性,促进细胞增殖,为多孔聚氨酯组织工程材料在新生血管方向的应用提供了新的思路。

