上转换纳米颗粒在肿瘤诊断与治疗中的研究进展
冯鹏程,王佳玲,李媛媛,张荣露,陶 佩,周 敏,朱静怡,缪文俊,黄 和
(1.南京工业大学药学院,江苏南京211800;2.南京工业大学生物与制药工程学院,江苏南京211800)
随着对疾病发生发展机制认识的不断深入和医学生物技术的不断发展,肿瘤的诊断与治疗技术也在不断完善和提高。但是恶性肿瘤仍然是全球范围内危害人类健康的重大疾病之一,也是人类疾病致死的第二大原因。据国家癌症中心2017年2月发布的最新统计数据显示,2013年我国总体癌症发病率每10万人186例,其中因癌症致死的有109例,而与2012年相比,肿瘤新发病例仍呈现增长的趋势,从358万增加到368万,增幅达3%[1]。
传统的肿瘤治疗方法有放射性疗法、化学疗法和手术治疗等,但这些方法都表现出副作用较大、产生耐受性和肿瘤复发的缺点[2],肿瘤患者的生存率和生活质量并未能得到显著改善。近年来,以靶向治疗、免疫治疗和细胞治疗为代表的新型肿瘤疗法方兴未艾,但尚未有革命性的突破。因此,亟待开发有效治疗恶性肿瘤的新方案。
上转换纳米颗粒(upconversion nanoparticles,UCNPs)基于近红外光(NIR)激发,可以将长波辐射转换为短波辐射,具有降低自发荧光背景干扰、较高的组织穿透能力以及优良的光学稳定性等优点,因而在肿瘤治疗领域备受青睐[3-4]。此外,UCNPs易于功能化修饰、生物毒性低,在很多方面都有应用潜能,如生物标记、细胞/活体成像、病变检测、DNA检测及生物传感等。本文中,笔者就UCNPs应用于肿瘤诊断和治疗的作用机制及研究进展进行系统介绍,同时对UCNPs在毒性检测和生物传感等方面的应用情况进行简要概述并指出其未来的研究发展方向。
1 上转换纳米颗粒(UCNPs)概述
UCNPs主要由氧化物、氟化物和卤氧化物等基质通过掺杂三价稀土离子构成,是一种低毒、稳定和发光寿命长的新型荧光探针[5-6],其经上转换发光过程可将连续吸收的2个或多个泵浦光子转化成为比泵浦光波长更短的光。通常采用近红外连续激光(700~1 100 nm)作为激发光源,因为它具有较深的组织穿透深度、对生物组织几乎无损伤及背景荧光干扰低等显著优势,从而被应用于生物成像,包括体外细胞成像、体组织和小动物活体成像以及多模式活体成像等方面[7-9]。
1.1 UCNPs的发光机制
UCNPs通过吸收两个或以上的低能光子而辐射出一个高能光子,这种现象称为上转换发光(upconversion luminescence,UCL),即上转换材料在NIR光激发下可发出可见光和/或紫外光,它最大的特点是材料所吸收的光子能量低于其发射出的光子能量,因此被称为“上转换材料”,这一过程是违背Stokes定律的,因此又被称为“反Stokes发光”[10]。UCNPs的发光机制(图1)主要分为激发态吸收(excited state absorption,ESA)、能量转移(energy transfer upconversion,ETU)和协同敏化(cooperative sensitization upconversion,CSU)等三类[11]。
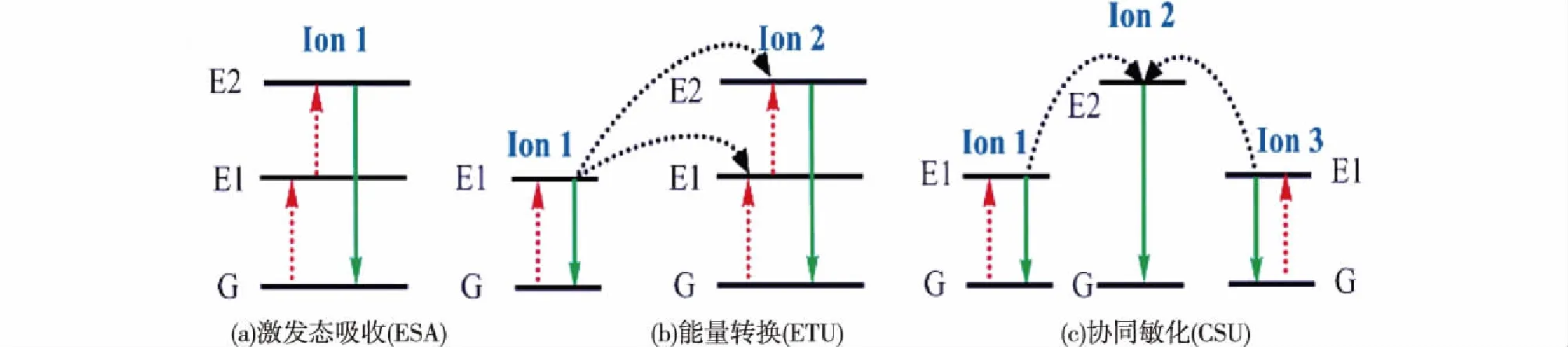
图1 上转换材料的发光机制[11]Fig.1 Principles of UCL process[11]
1.2 提高上转换发光效率的方法
对于UCNPs中掺杂的三价稀土离子,目前研究较多的有Er3+、Eu3+、Yb3+、Tm3+和Ho3+等,它们都具有丰富的能级,同时由于受到4f能级外层电子的屏蔽作用,表现出较高的上转换发光效率,常作为上转换材料的激活剂[12]。为提高上转换材料的发光效率,王霞等[13]将小半径的锂离子(Li+)分别掺入到α-TeO2:Tm3+/Er3+/Yb3+和β-TeO2:Tm3+/Er3+/Yb3+这两种稀土掺杂的上转换材料中,研究发现,掺入Li+后,前者的发光强度增强了3倍,后者增强了1倍,说明掺入Li+可以提高上转换的发光强度;对于不同的UCNPs,掺入Li+后的发光强度的变化差异性较大,所以在实际应用中应注意考察Li+掺入量及其发光强度的具体变化。胡荣璇等[14]通过调整Gd3+的掺杂量来控制溶剂热法制备的NaYF4:Yb3+,Tm3+/Er3+,由立方相到六方相的相变以及纳米产物的尺寸,可以实现上转换发光的有效增强,该研究中掺杂Gd3+取代部分Y3+,但由于两者的原子半径不同,在提高材料发光效率的同时也会改变纳米粒子的尺寸大小,因此对反应的定量要求较高。
刘珊珊等[15]利用溶剂热法制备了不同F-浓度条件下的NaYF4:20%Yb3+/2% Er3+上转换发光纳米晶体,结果发现:该材料在980 nm连续激光器激发下具有较强的上转换发光效应,F-浓度对纳米晶体的粒径及晶型结构起着关键性作用,随着F-浓度的增加,UCNPs的成核速度加快,合成的纳米晶体粒径较小且结构趋于稳定,但过高的F-浓度会使其吸附在晶体表面而影响荧光强度。因此,在UCNPs的合成过程中要注意控制F-浓度,以控制纳米颗粒的尺寸及结构,从而提高UCNPs的发光效率。
1.3 UCNPs的可控制备方法
UCNPs的尺寸、晶体结构、形貌和单分散性是影响其UCL性能的重要因素,需要控制其合成条件以达到控制其发光性能的目的。UCNPs代表性的合成方法有共沉淀法、热分解法和溶剂热法等[16]。针对一些具有特殊功能的纳米材料,可能需要联合多种方法进行制备。
1.3.1 共沉淀法
共沉淀法指的是将原料配制成溶液,加入沉淀剂,使原料中的离子以沉淀的形式析出,对沉淀进行洗涤、干燥及退火等处理后得到所需的纳米材料的方法。该方法简便、条件易达到且成本较低,可用于批量生产UCNPs。但此过程中常因沉淀剂或其他离子局部浓度过高而产生纳米颗粒粒径不均一的现象。因此,可通过加入稳定剂,如:聚乙烯吡咯烷酮(PVP)、聚乙烯亚胺(PEI)或乙二胺四乙酸(EDTA)等,使沉淀物发生配位化合反应,可有效控制UCNPs的生长[17]。
1.3.2 热分解法
热分解法指的是将前体物溶解在高沸点溶剂中制备单分散的UCNPs的方法。常用的高沸点溶剂有油酸(oleic acid,OA)和十八烯(octadecene,ODE)。北京大学严纯华院士课题组的Yin等[18]利用N2保护条件将稀土金属三氟乙酸盐溶于高沸点溶剂中,升高温度至250~340 ℃后反应6 h,制备一系列高质量的基于NaYF4的不同发光性质的UCNPs。尽管能制备出尺寸均匀、形貌可控、单分散性好且发光性能较高的油溶性UCNPs,但该方法所需要的条件较为苛刻、成本高,且副产物有毒性,不符合绿色合成理念,这在一定程度上限制了其应用。
1.3.3 溶剂热法
溶剂热法主要是在特殊的密闭体系中,以有机物或非水溶媒为溶剂,在一定的温度和溶液的自生压力下进行反应的合成方法。该法由清华大学李亚栋院士课题组的Wang等[19]首次提出后发展起来,通过在合适的溶剂体系中加入稀土离子溶液及合适的稳定剂来控制产物的形貌大小,在搅拌的条件下加入氟化物水溶液并搅拌均匀,通过调节温度、反应时间和离子浓度等反应条件来控制UCNPs的形貌、尺寸和表面性质等。
2 UCNPs用于肿瘤诊断与治疗的研究进展
目前,UCNPs在肿瘤诊断与治疗的研究主要集中在光动力疗法、光热疗法、化学联合疗法、多模成像指导的诊疗一体化及体外诊断等方面。
2.1 光动力疗法
光动力疗法(photodynamic therapy,PDT)是利用光敏剂吸收特定波长的激发光后,电子从基态跃迁到激发态,处在激发态的电子一部分通过辐射跃迁回基态发射荧光,另一部分电子则到达三重态与周围环境中的氧分子发生能量传递,产生有生物毒性的单线态氧(1O2)等活性氧簇(ROS),从而达到杀死肿瘤细胞的目的。光动力过程中包括特定波长的光、光敏剂(PS)和细胞及组织中的氧分子等3个基本要素[20]。光动力治疗具有选择性高、副作用小和创伤小等优点[21]。目前,PDT已经应用于皮肤、头颈部、食管、胰腺和膀胱等浅层及空腔脏器的肿瘤治疗中。
在1平方分米表象的建立中,教师引导学生利用手势做成大致1平方分米的小正方形,让学生带着这个随身携带的平方分米去寻找生活中的表象;1平方米表象的建立中,引导学生在一张1平方米的白纸站一站,数数能站的人数。通过实践、操作、游戏等活动,建构面积单位的模型。
UCNPs与光敏剂的结合能有效改善光敏剂体内递送困难、靶向性低等问题[22-23],具有良好的应用前景。UCNPs作为PDT的最佳理论材料,其NIR激发光具有更深的组织穿透能力,并且其发射的紫外光或者可见光可用于活化光敏剂,产生具有高度反应性的ROS,从而达到直接杀死癌细胞或摧毁肿瘤部位血管及激活宿主免疫系统等目的[24]。
2.1.1 UCNPs提高PDT的治疗深度
NIR光很少被水或血红蛋白等生物大分子吸收,具有较好的生物组织穿透能力。UCNPs在PDT中起到类似于光转换器的作用,能将吸收的近红外光转换为激活光敏剂的可见光或紫外光,从而增加PDT治疗深度。Wang 等[25]将酞菁锌(ZnPc)以静电吸附作用结合到LiYF4:Yb/Er UCNPs上,用于小鼠肿瘤的PDT,研究发现,治疗2周后,实验组的小鼠肿瘤体积相对于对照组明显减小。该研究证实了UCNPs应用于抗肿瘤治疗时能够增强PDT效果。Tian等[26]将3种常用的光敏剂二氢卟酚e6(Ce6)、酞菁锌(ZnPc)和亚甲蓝(MB)加载到α-环糊精修饰的NaYF4:Yb/Er UCNPs上形成Ps@UCNPs复合物,结果表明:在980 nm NIR光激发下,Ps@UCNPs复合物能有效产生1O2以杀死肿瘤细胞。Hou等[27]设计了一种基于TiO2壳包裹的具有核壳结构的复合材料(UCNPs@TiO2NCs),利用NaYF4:Yb3+,Tm3+@NaGdF4:Yb3+在NIR光激发下发射被TiO2吸收的紫外光,胞内产生ROS,降低线粒体的膜电位,释放出细胞色素C,从而激活Caspase-3诱导细胞凋亡(图2),研究发现:UCNPs@TiO2作为光敏剂,经NIR光激发,可以更有效地抑制荷瘤小鼠的肿瘤生长。
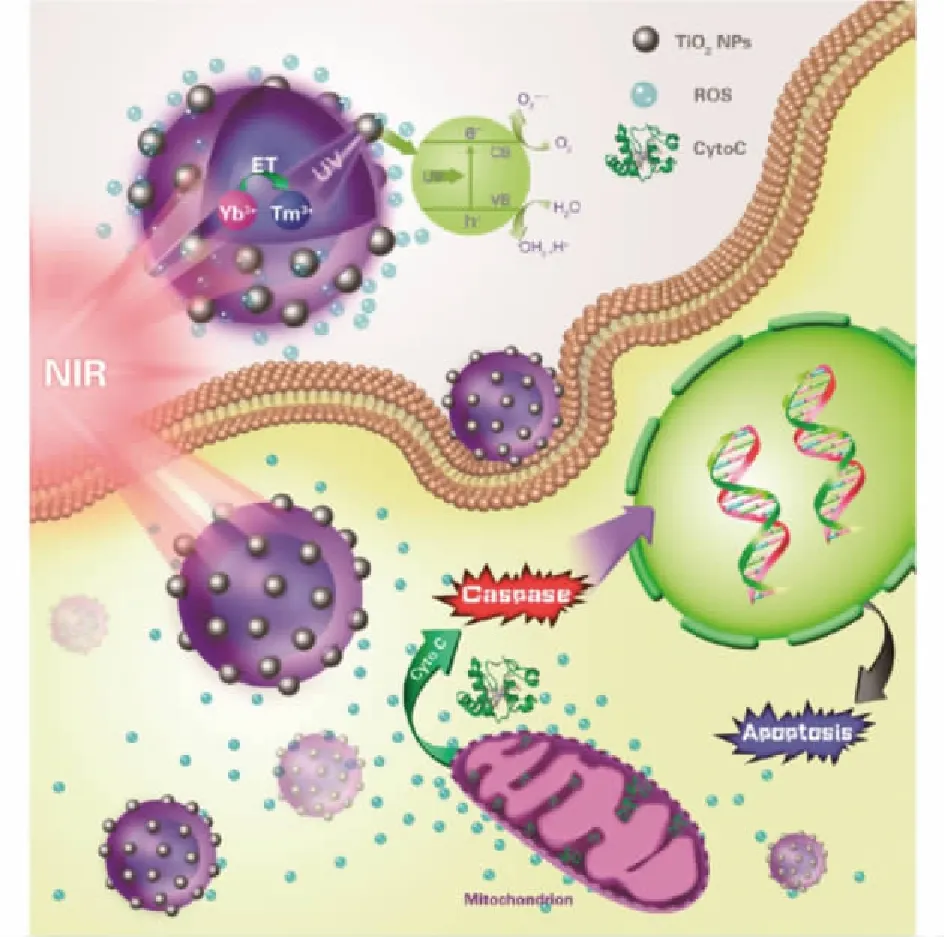
图2 基于上转换纳米复合材料的PDT诱导 细胞凋亡的分子机制[27]Fig.2 Molecular mechanism of induced apoptosis with upconversion nanocomplex mediated PDT treatment[27]
2.1.2 UCNPs提高PDT的肿瘤靶向性
UCNPs本身由于具有较强的实体瘤高通透性及滞留效应(enhanced permeability and retention effect,EPR),能够很好地被动靶向至肿瘤部位,通过进一步的表面修饰,可以提高其在肿瘤部位的特异性蓄积,从而提高疗效并减少对正常组织产生的不良反应。
肿瘤细胞表面高表达叶酸(folic acid,FA)受体[28],因此,叶酸分子可用于肿瘤细胞的靶向配体。Liu等[29]报道了用FA修饰的NaYF4:Yb3+,Er3+-RB的上转换纳米复合物能够提高对肿瘤细胞的靶向性,进而提高其参与的成像指导下的抗肿瘤疗效。Hou等[30]构建了紫外光-蓝光双重光敏剂上转换纳米平台,即多壳晶体材料NaYF4:Yb/Tm@NaYF4:Yb@NaNdF4:Yb NaYF4(UCNPs)与紫外光激发光敏剂二氧化钛(TiO2)及蓝光激发光敏剂竹红菌甲素(HA),该材料在外层修饰透明质酸(Hyal)来提高肿瘤靶向性,经808 nm光激发实现肿瘤的PDT。该研究表明,双光敏剂纳米平台通过有效的肿瘤靶向分子表现出增强的抗肿瘤效果,这对开发下一代NIR介导的PDT有着指导性意义。
2.1.3 以UCNPs为平台的联合治疗
近几年来,一些研究者致力于将多种治疗方式整合到UCNPs平台上,以实现协同增强的抗肿瘤效果。Liu等[31]构建了一个以UCNPs为核心、光敏共轭聚合物和转铁蛋白-二茂钛(Tf@Tc)为壳的多层次双光敏剂上转换纳米粒子UCNPs@PFSBT@Tf@Tc。在NIR照射下,UCNPs核产生的表观能量转移到光敏共轭聚合物和转铁蛋白-二茂钛构成的壳层中,利用该过程产生的ROS杀死癌细胞。研究发现,给予UCNPs@PFSBT@Tf@Tc纳米粒子的荷瘤小鼠,经NIR照射后,肿瘤生长被显著抑制,肿瘤体积在治疗的第14天下降到35%。
Zhao等[32]合成了新型Caspase-3响应性功能化的上转换纳米粒子(Caspase-3 responsive functionalized upconversion nanoparticles,CFUNs),实现了三重抗肿瘤效果的整合:近红外光触发的光动力学治疗/Caspase-3酶的活化以及Caspase-3酶响应性药物的释放和级联化疗作用的激活,CFUNs在体内外都表现出协同抗肿瘤效果,并且在黑暗条件下,其不产生治疗效果且细胞毒性极小。NIR激活的级联肿瘤治疗方法有两种不同的机制,这有利于克服肿瘤治疗过程中遇到的多药耐药性和肿瘤异质性问题。
Chen等[33]合成了一种新型核-壳-壳纳米材料(图3),由上转换核心NaYF4:Yb,Tm@NaYF4和竹红菌甲素(HA)/碳量子点吸附在介孔SiO2表面形成夹层壳结构,介孔SiO2作为外壳形成的纳米结构,通过将抗癌药物盐酸阿霉素包封在介孔SiO2中,并设计了光敏性邻硝基苄基衍生物接头(NB)作为“门”控制药物的释放,在980 nm光照射下,UCNPs转换发射的紫外光能够引起NB连接体和药物之间的化学键断裂,从而释放化疗药物,同时发射的可见光激发HA产生单线态氧,摄入的碳量子点也能通过吸收UCNPs发射出来的光释放热量。结果证明:该材料能够整合成像治疗、PDT、光热疗法(photothermal therapy,PTT)及化学疗法实现协同增强抗肿瘤效果,UCNPs与碳量子点、竹红菌甲素(HA)相结合的纳米复合材料将成为成像引导的抗肿瘤疗法的潜在候选者。
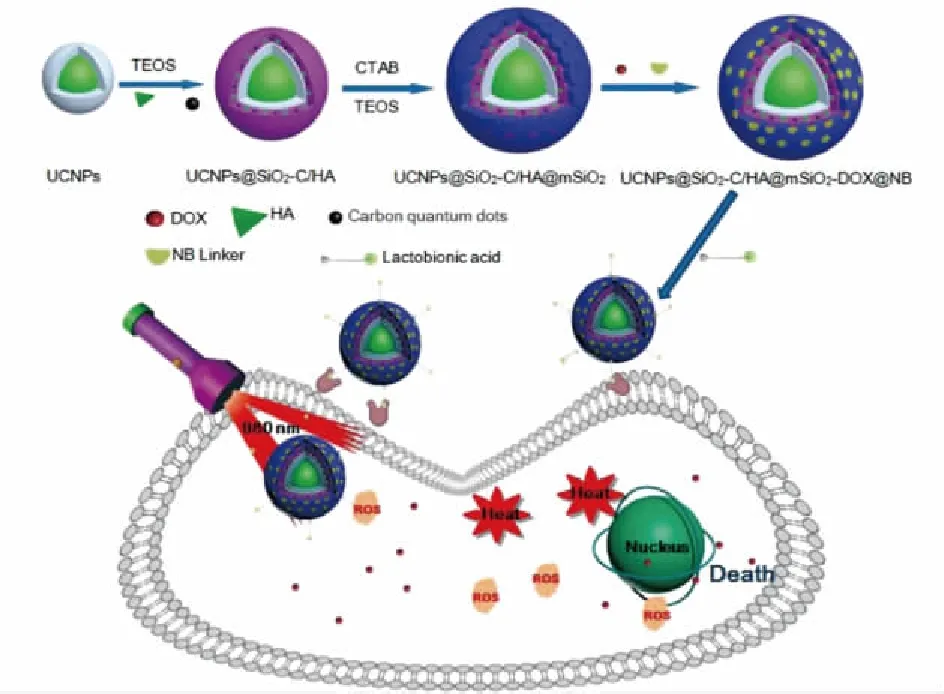
图3 LA-UCNPs@SiO2-C/HA@mSiO2-DOX@NB 纳米复合材料的制备及其联合抗肿瘤治疗作用 机制[33]Fig.3 Preparation and multiple-therapy mechanism of LA-UCNPs@SiO2-C /HA@mSiO2-DOX@NB nanocomposites[33]
2.2 光热疗法
PTT是一种新型肿瘤治疗方法,利用具备较高光热转换效率的材料作为光热剂,在NIR光照射下吸收光能并转化为热能,可以对肿瘤细胞或组织进行选择性地局部加热,从而杀死癌细胞。PTT的有效性主要取决于光热剂的光热转换效率。常用的光热剂为具有优良的等离子体共振吸收效应的贵金属纳米材料,如金、银纳米颗粒。应用于光热疗法的理想金属纳米材料应该具有强且可调的表面等离子共振吸收效应、易传输、毒性低以及容易与肿瘤细胞结合等优点[34];具有固定近红外吸收带的CuS[35]、Cu9S5[36]和LaB6[37]纳米粒子也是一类新型光热剂,用于PTT。Qian等[38]合成了NaYF4:Yb,Er@NaYF4@SiO2@Au纳米颗粒(70~80 nm),金纳米颗粒(~6 nm)沉积在SiO2表面,有效提高了光热转换效率。实验发现,该纳米材料能有效地破坏人神经母细胞瘤细胞,具有很好的抗肿瘤疗效。
2.3 化学联合疗法
为了实现可激活的光敏剂-化学药物的联合治疗,Hu等[41]首次设计了由可激活光敏剂和化疗前药构建的双重前药,利用UCNPs载入具有较低的全身毒性的化学前体药物丝裂霉素C(mitomycin C,MMC),开发了一个智能治疗平台来实现药物在病灶部位的精准治疗。MMC是一种含有醌结构的广谱DNA交联抗癌药物,可作为光致电子转移(photoinduced electron transfer,PET)荧光淬灭剂[42]。通过二硫键连接MMC与光敏剂乙烯基吡啶鎓取代的四苯基乙烯TPEPY,形成光敏剂和化学前药的双前体药物TPEPY-S-MMC。其中,TPEPY在聚集状态下能够产生强荧光并生成大量ROS[43];而化学前体药物MMC具有醌结构,作为单线态氧淬灭剂,可以阻断光敏剂(TPEPY-SH)的光敏活性,即TPEPY-S-MMC不发出荧光也不能产生ROS。同时,MMC的氮原子处的吸电子酰基能够降低TPEPY-S-MMC的系统毒性,当药物与谷胱甘肽(GSH)反应后,TPEPY-S-MMC被激活成具有光动力活性的TPEPY-SH和化学药物MMC,从而发挥联合抗肿瘤效果。具有智能控制激活过程的PDT和化疗平台组合并不多见,集成可激活的光敏剂和化学-前药的组合疗法是非常有意义的,可激活的光敏剂还能适当降低药物的副作用,提供更有利的治疗效果。
2.4 多模成像指导的诊疗一体化式纳米平台
多功能纳米平台通常是将生物传感、成像诊断,如计算机断层扫描(computer tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、超声成像(ultrasound imaging,UI)、荧光成像(fluorescence imaging,FI)和治疗功能,如PDT、PTT及化学疗法等集成到单一的纳米结构中。由于纳米科学和生物医学的迅速发展,这样的整合体系可以达到更高的诊断要求和更优异的肿瘤治疗效果,已经引起越来越多的关注。Liu等[44]构建了一种结合UCL成像、MRI成像、CT成像、PTT及化学疗法五大功能的多模态纳米探针UCNPs@PDA5-PEG-DOX,该方法将聚多巴胺(PDA)壳涂布在β-NaGdF4:Yb3+,Er3+@β-NaGdF4上转换纳米颗粒(UCNPs)核上形成核壳结构的纳米载体,通过聚乙二醇修饰后,载入药物盐酸阿霉素(DOX),结果发现:该材料的毒性低,抗肿瘤活性强,在808 nm NIR激光照射下,该纳米药物能够完全根除患结肠癌小鼠体内肿瘤。此外,通过溶血试验、组织学分析以及血液分析等研究发现该载体具有可以忽略的毒性。
为了提高药物抗肿瘤效果,通常将UCNPs与其他具有特定功能的材料通过化学或物理方式相结合,实现协同抗肿瘤作用。Feng等[45]开发了一种多功能纳米系统,即合成的UCNPs@ZrO2-Ce6/DOX/PCM纳米系统(图4),通过将化疗药物盐酸阿霉素和光敏剂Ce6加载到涂覆有中空介孔二氧化锆(ZrO2)的Nd3+掺杂的UCNPs中,并在NIR光照射下温度升高,利用温敏相变材料(phase change material,PCM)十四烷醇作为控制释放阿霉素和ROS的开关。该材料通过静脉注射给荷瘤小鼠,在温和的NIR激光照射下(0.5 W/cm2,5 min)表现出优异的体内协同抗肿瘤效果,提示UCNPs@ZrO2-Ce6/DOX/PCM可以作为理想的纳米平台,用于多模成像引导的肿瘤治疗。
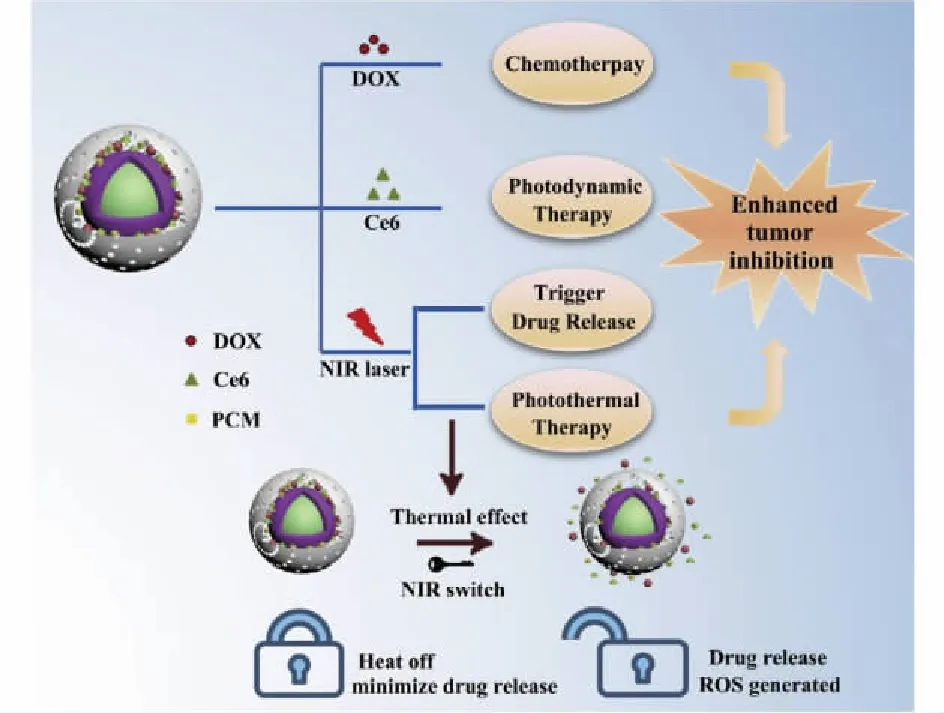
图4 在808 nm激光照射下UCNPs@ZrO2-Ce6/ DOX/PCM的联合抗肿瘤示意图[45]Fig.4 Schematic illustration of combined cancer therapy under mild 808 nm laser irradiation of UCNPs@ZrO2-Ce6/DOX/PCM multifunctional nanotheranostics[45]
Cen等[46]开发了聚多巴胺(PDA)修饰的核壳型多功能上转换纳米平台,用于肿瘤细胞内相关mRNA的检测,同时结合NIR光触发的PDT及PTT协同疗法,增强抗肿瘤效果。先合成油酸修饰的疏水性UCNPs(OA-capped NaYF4:Yb,Er,Tm,OA-UCNPs),通过表面接枝SiO2壳载入亲水性光敏剂亚甲蓝(MB)中,多巴胺(DA)通过氧化自我聚合,在多种底物表面形成聚多巴胺(PDA)壳,形成核壳纳米结构UCNPs@SiO2-MB@PDA(图5)。PDA与单链DNA的结合能力强于双链DNA,并且由于自身具有优异的荧光淬灭性能,通过在PDA上吸附荧光标记的hairpin DNA(hpDNA)形成UCNPs@SiO2-MB@PDA-hpDNA发夹型纳米探针用于监测细胞内肿瘤相关mRNA,可以区分正常细胞和癌细胞。在655 nm光激发下,UCNPs发射的上转换荧光被光敏剂MB分子吸收,可用于PDT;在800 nm光激发下,由于PDA具有强NIR光吸收效率及高的光热转换效率,UCNPs发射的上转换荧光能够被PDA吸收,可用于PTT。该体系用于人乳腺癌细胞MCF-7、人宫颈癌细胞HeLa和人肝癌细胞HepG2时,在无激光照射条件下,细胞的存活率均接近100%;而当激光照射时,细胞的存活率明显降低,其中MCF-7的存活率最低降至仅12%,这些表明所开发的多功能纳米平台在未来的肿瘤治疗领域具有可观的开发前景。
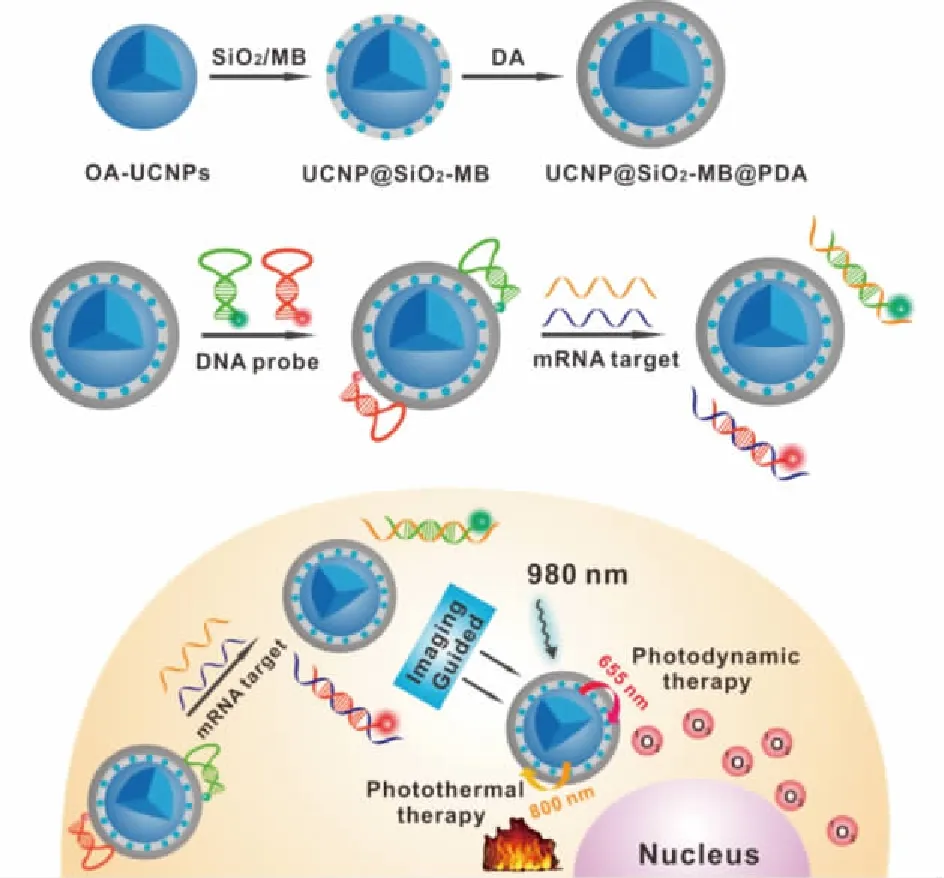
图5 UCNPs@SiO2-MB@PDA多功能纳米平台的 构建及其作用机制[46]Fig.5 The construction and mechanism of UCNPs@ SiO2-MB@PDA multifunctional nanoplatform[46]
2.5 UCNPs在肿瘤的体外诊断方面的应用及研究进展
肿瘤的诊断分为体内和体外诊断两方面,其中,体外诊断又可分为两类,一类是对肿瘤组织的病理检查,另一类是通过采集体液样本进行的液态活检。组织病理检查对肿瘤的筛查、分期及位置的确定有着极其重要的作用。此外,肿瘤液态活检技术也发展迅猛,该技术只需要检测血液样本,其便利性将推动新型血液诊断的快速发展[47-48]。
UCNPs由于具有优异的荧光性能,在肿瘤体外诊断方面的研究也受到了广泛关注,很多基于UCNPs的体外诊断试剂盒已被开发。华东等[49]发明了一种利用抗体功能化磁性纳米材料和上转换荧光纳米材料及抗原-抗体反应对癌胚抗原(carcinoembryonicantigen,CEA)进行检测的试剂盒。该研究将两种纳米材料与抗原-抗体特异性反应原理相结合,建立了一种高度灵敏、稳定且快速的CEA检测方法,利用抗-CEA第一抗体(捕获抗体)功能化的磁性纳米材料对血液样本中的CEA进行富集并分离;同时利用UCNPs荧光的高灵敏度和有效避免样本生物背景荧光干扰的特点,用抗-CEA第二抗体(检测抗体)标记UCNPs(NaY78%F4:Yb 20%,Ho 2%)作为最终检测探针。目前该试剂盒已在临床及科研中用于检测CEA的含量、肿瘤的辅助诊断、指导治疗及提示预后等。
除了特异性结合的免疫反应方面的应用,基于稀土纳米荧光探针的肿瘤标志物超灵敏体外检测方面的研究也引起了广泛的关注。有研究表明,肿瘤患者的血液及其他体液中的循环肿瘤基因(circulating tumor DNA,ctDNA)是一种非常有潜力的肿瘤生物标志物,可用于实时跟踪肿瘤的发展以及肿瘤治疗的监控[50]。在临床应用中,可通过采集ctDNA信息,来评估抗肿瘤药物的选用、疗效以及预后,甚至可用于肿瘤的早期发现和诊断。然而,在肿瘤患者的外周血中,循环肿瘤细胞的密度极低,大约平均 106个细胞中仅有一个循环肿瘤细胞。由于ctDNA含量低(<1.0%)、片段短以及半衰期短(<2 h),检测十分困难,而且二代测序背景噪声很高,用常规建库测序方法会使肿瘤信号完全淹没在背景噪声中,这些都对核酸提取纯化技术提出了全新的挑战。因此,针对循环肿瘤细胞的高效捕获和检测的方法在肿瘤早期诊断和预后评估中起着极为重要的作用。
Shuai等[51]首次提出将UCNPs结合核酸适配体(aptamer)作为纳米探针来识别循环肿瘤细胞,并利用磁性纳米材料富集循环肿瘤细胞。在该探针中,UCNPs 结合生物素以及特异性识别靶细胞蛋白酪氨酸激酶PTK-7 的核酸适配体形成Biotin-UCNPs-Aptamer复合物,可特异性识别靶细胞人急性淋巴细胞白血病T淋巴细胞(CCRF-CEM)。另一方面,用修饰了亲和素的磁性纳米材料来分离靶细胞,便于对靶细胞进行进一步分析。该纳米探针利用UCNPs 无自发性荧光的特性以及磁性纳米材料对靶细胞的有效分离功能,避免了检测过程中背景荧光信号的干扰,也大大降低了检测分离中的非特异性吸附,实现了检测的高灵敏度和高捕获率,有望用于临床上采集ctDNA信息。
3 UCNPs的其他生物医学应用
3.1 UCNPs作为免疫荧光探针
UCNPs除了在抗肿瘤方面具有广泛的应用前景,在生物医学领域的其他方面也有着较多的研究。利用荧光共振能量转移(fluorescence resonance energy transfer,FRET)原理设计成纳米探针可用于DNA、RNA 及其他生物分子的免疫分析,朱瑾等[52]制备了一种用于快速测定血清中降钙素原(procalcitionin,PCT)的免疫层析试纸条,基于功能化修饰后的UCNPs作为荧光标记物。PCT的线性范围为0.05~50 μg/L,检测限为0.020 μg/L。应用制得的免疫层析试纸条测定血清样品中的PCT结果与罗氏电化学发光法所测结果一致,表明该检测探针具有好的灵敏度及检测限。
3.2 UCNPs用于药物体内毒性检测
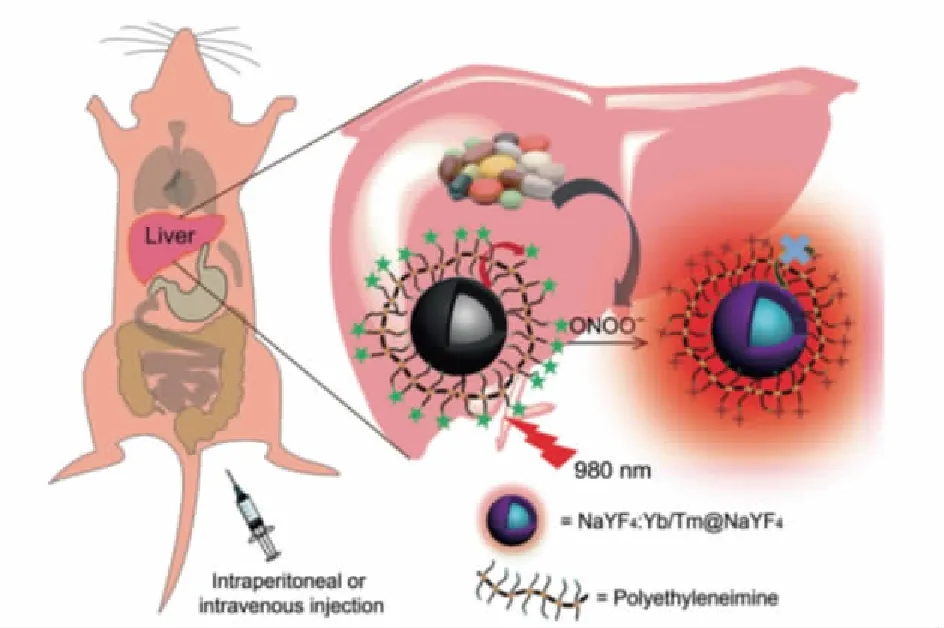
图6 发色团组装的UCNPs的合理设计用于 活体检测亚硝基化肝毒性[53]Fig.6 Rational design of chromophore-assembled UCNPs for the detection of nitrosative hepatotoxicity in vivo[53]
药物毒性是药物研发领域中重点关注的问题,常规的血液检查不能提供实时可视化的毒性监测结果。Peng等[53]利用UCNPs的发光性来评估体内急性肝毒性(图6)。体内注射该纳米探针后,它们会聚集在肝脏部位,纳米颗粒的发光性会由于能量转移到发色团上而受到抑制。但若出现肝毒性,肝脏中会产生大量的过氧化亚硝酸阴离子(ONOO-),它可以通过与多种生物大分子,如蛋白质、脂质和核酸等结合导致细胞迅速死亡,常被作为肝毒性的直接指标。ONOO-能够漂白发色团使纳米颗粒恢复荧光。该材料可利用NIR光的高穿透能力实现对活体动物肝毒性的可视化实时监测,与现阶段临床前常用的肝毒性筛查方法,即与检测表征肝损伤的血清丙氨酸转氨酶(ALT)的酶含量相比,该方法为评估研发药物的肝毒性提供了便利的筛选策略。但ONOO-的半衰期过短,在血浆中的检测难度大,通过在UCNPs探针表面涂覆聚乙烯亚胺(PEI)和花菁素(Cy7)制备Cy7-PEI-UCNPs纳米探针材料,可以增强检测灵敏度[54]。
3.3 UCNPs用于生物传感器
刘映等[55]设计了一个基于上转换荧光猝灭的新型pH传感器。UCNPs (NaGdF4:Yb3+/Tm3+)在980 nm光激发下,在475 nm处有较强的发射峰,可与异硫氰酸荧光素(FITC)发生荧光能量共振转移,并且对FITC荧光的淬灭程度取决于环境的pH。研究发现,该传感器在pH 3~5时的响应敏感度较高,与荧光背景易受到干扰的传统方法相比,该新型传感器具有简单、快速、灵敏的优点和较强的抗干扰能力。除此之外,其生物相容性好、绿色环保,顺应现代绿色化学的发展要求,为UCNPs在生物分析领域的应用提供了新的思路。
4 结语
肿瘤的有效治疗仍为当今医药领域亟待解决的难题,而传统的治疗方法已经不能满足肿瘤患者生理心理需求。随着材料科学、纳米科学技术和生物医药学的快速发展,肿瘤的新型治疗手段也越来越先进。近年来,基于稀土元素上转换发光材料的研究越来越深入,发现该材料具有独特的光学特性、理化性质及优良的生物相容性等特点,为其开发成为新型抗肿瘤药物载体奠定了良好的基础。
尽管现阶段UCNPs在肿瘤的诊疗方面应用研究进展很快,但是UCNPs仍面临着诸多挑战。一方面,目前UCNPs所使用的激发波长主要是980 nm,这一波长范围的光会被水吸收产生较强的热效应,从而对正常组织细胞产生危害。因此,在提高PDT效率的同时,如何减少对机体正常组织的损害成为目前的研究热点。一些研究致力于改变激发波长以降低热效应并加深穿透深度。Wang 等[56]使用Nd3+构建的UCNPs能被808 nm的近红外光激发,实现更好的PDT效率。当然,UCNPs除了在肿瘤治疗领域有着广阔的发展前景,在生物医学领域其他方面的发展也是非常乐观的,如生物样品检测、生物成像以及其他疾病的诊疗一体化平台的构建。
另一方面,现阶段UCNPs的研究还仅仅停留在基础研究阶段,并没有相关的临床应用。UCNPs若要应用于临床,需要对其毒性进一步研究确证。尽管很多研究声称UCNPs在短期应用下并不会对机体造成较大的毒性影响,但其长期毒性和慢性毒性仍有待进一步研究。此外,对于如何合理构建UCNPs来实现疾病的诊疗一体化是另一研究热点,即在将来的UCNPs的研究中,主要的研究方向将会是如何通过UCNPs载体来构建综合实现肿瘤的诊断、成像、靶向治疗及药物的精准释放等的一体化平台。
此外,随着UCNPs在生物医学领域应用的日益广泛,如何采用更加简便绿色的方法合成出小尺寸、高转换效率的水溶性UCNPs,如何对其表面进行功能化修饰以实现更好的生物相容性及更多领域的应用将成为研究重点。同时,纳米材料的尺寸、结构都会影响其在生物体内的行为,包括分布代谢情况、纳米生物效应、急性毒性和长期毒性等,因此,需要系统地研究UCNPs的性质及其生物学行为之间的关系。

