细菌衍生物载体在肿瘤治疗中的研究进展
朱辰奇,钱 晨,徐 柳,陈 瑞,胡荣峰,陈志鹏
(1.南京中医药大学药学院,江苏南京210023;2.苏州市立医院本部药剂科,江苏苏州215002;3.安徽中医药大学药学院,安徽合肥230038)
近年来,恶性肿瘤的治疗仍然是困扰人类的一个重大难题。化疗是肿瘤治疗中最主要的手段,但传统化疗药物的靶向性和特异性较差,对正常组织和细胞会造成严重的不良反应。因此,非常有必要开发高特异性的药物递送系统,这对研究者来说也是一个巨大的挑战[1]。
纳米载药系统因其独特的高渗透、长滞留效应(EPR)在肿瘤治疗中[2-4]具有很好的前景。因此,众多优良的纳米载体被不断地开发出来,比如介孔二氧化硅[5]、氧化石墨烯[6]、碳纳米管[7]、金纳米载体[8]和磁性纳米载体[9]等。
纳米有机载体因其低毒性、高生物相容性和可降解性的优点,受到了研究人员的青睐。聚乙二醇(PEG)[10]、聚乳酸-羟基乙酸共聚物(PLGA)[11]、人血清白蛋白[12]和脂质体[13]等有机材料作为纳米载体已经获得批准,并在临床上得到广泛的运用。这些载体通过结合多肽、配体等靶向基团的修饰,可进一步提高其特异性,聚集于肿瘤部位[14-15],但是这些带有靶向基团的纳米载体制备难度和成本较高[16],且由于人体自身存在的血液、肿瘤组织和肿瘤细胞等屏障[17],达到肿瘤部位的载体数量十分有限[18-19]。
生物载体,如细菌载体,能够克服多重生理屏障,并且可以通过基因工程获得特定的靶向功能,这引起了研究人员的兴趣[20]。细菌或者细菌衍生物首次作为载体用于递送系统的研究可以追溯到20世纪90年代中期,Wells等[21]将食物中的乳酸菌用作黏膜疫苗的载体。不同种类的细菌,如梭状芽胞杆菌(Clostridiumnovyi)[22]、鼠伤寒沙门氏菌(Salmonellatyphimurium)[23]、大肠杆菌(Escherichiacoli)[24]、李斯特菌(Listeriamonocytogenes)[25]和乳酸菌(lactic-acid bacteria)[26],作为载体被应用于癌症、糖尿病和结肠炎等疾病的治疗研究,得到了很多临床试验的证明[27]。但是,活菌作为一个外来体,直接作为载体时容易引起人的免疫反应,内毒素的存在也可能引起宿主细胞的毒性反应。而细菌衍生物相对于活菌来说具有低免疫原性、低毒性的特点,并且其制备工艺简单,可大规模生产,因此,其作为载体应用于递释系统具有很好的前景。以下就常见的细菌衍生物——细胞外膜囊泡、微细胞和细胞原生质体囊泡作为递释系统的研究进展进行综述。
1 细菌外膜囊泡(outer membrane vesicles,OMVs)
1.1 OMVs的来源及组成
细菌会在生长过程中的各个阶段自然地将细胞膜上的纳米脂蛋白分泌到膜外[28],这种分泌囊泡的现象虽然被发现了40多年[29],但是近几年研究人员才发现这是细菌生长过程中的普遍现象,尤其是细菌受到外界刺激时[30],更易分泌各种囊泡。这些囊泡的直径在20~250 nm,通常是球形[31],主要是由革兰氏阴性菌中细菌的外膜(outer membrane,OM)释放出来,因此被命名为OMVs[32]。近年,在少数革兰氏阳性菌中也有OMVs存在的报道[33]。
由于细菌超强的变异性,当前对OMVs的产生机制还不明确。主要有3种假说:①Wensink等[34]提出,在OMVs的生物合成过程中,OM相对于肽聚糖底层生长更快,导致两层之间的共价键被破坏,并开始形成囊泡;②Mcbroom等[35]提出,由于细胞周质错误折叠的蛋白质和肽聚糖片段不断地累积,对OM施加了一种向外的压力,OM最终膨胀至破裂并释放出囊泡;③Schertzer等[36]提出,OMVs的形成是由于细胞外小叶不均匀延伸。虽然OMVs产生和调控背后的机制途径和功能原因暂时还不明确,但是它们在细胞间信息交流、基因转移及毒力因子、抗原和毒素的转运等作用已经得到了证实[37-42]。
大多数革兰氏阴性细菌OM的主要组成部分是脂多糖,因此,它们的OMVs是免疫细胞的一种非常有效的激活剂。OMVs可以引导正常的宿主细胞发生适应性免疫应答,可以应用于疫苗和佐剂的开发。另一方面,在药物递送的过程中,理想的载体应该是非免疫原性或者非炎性的,避免引起患者炎症反应。常见的可以有效降低细菌OMVs免疫原性的策略包括:①选择非致病性细菌;②通过基因工程,移除、添加或修改产生OMVs菌株的膜蛋白和表面抗原[43]。
1.2 OMVs在药物递释系统中的应用
在某些情况下,自然产生的OMVs可以直接作为递药载体,例如:用细菌的OMVs装载免疫调节分子或者抗菌肽,OMVs通过黏附或者融合的方式将装载的药物递送到靶细菌。通过融合蛋白,可以溶解或者杀死靶细菌,Kadurugamuwa等[44]发现铜绿假单胞菌囊泡包含自溶素——胞壁质水解酶,其能够裂解其他革兰氏阴性菌和革兰氏阳性菌。利用这一特性可以将OMVs制成抗生素载体来杀死致病菌。
OMVs来自于不同的细菌种类,所以会展现出一系列不同的生物学效应。利用生物工程技术,分离出来的OMVs表面可以结合特定的配体,如抗体、细胞靶向肽、寡核苷酸适配体或抗原等,通过分子适应或体外生物缀合技术形成靶向纳米载药系统。利用基因工程技术,编码OMVs细菌的细胞外膜表面或者其他膜结合蛋白的特定序列,从而产生可以靶向宿主细胞或组织的OMVs。Gujrati等[45]利用ClyA的寻址特性在大肠杆菌OMVs上表达对原癌基因人类表皮因子受体2(HER2)高亲和力的HER2配体(AffiHER2OMVs),如图1所示。HER2是一种具有络氨酸激酶活性的跨膜受体,其会在乳腺癌、卵巢癌及胃癌等肿瘤细胞中过度表达[46-47]。利用其对HER2的靶向,Gujrati[45]将装载siRNA的OMVs递送到肿瘤细胞,成功地使目标基因沉默,抑制肿瘤细胞生长。
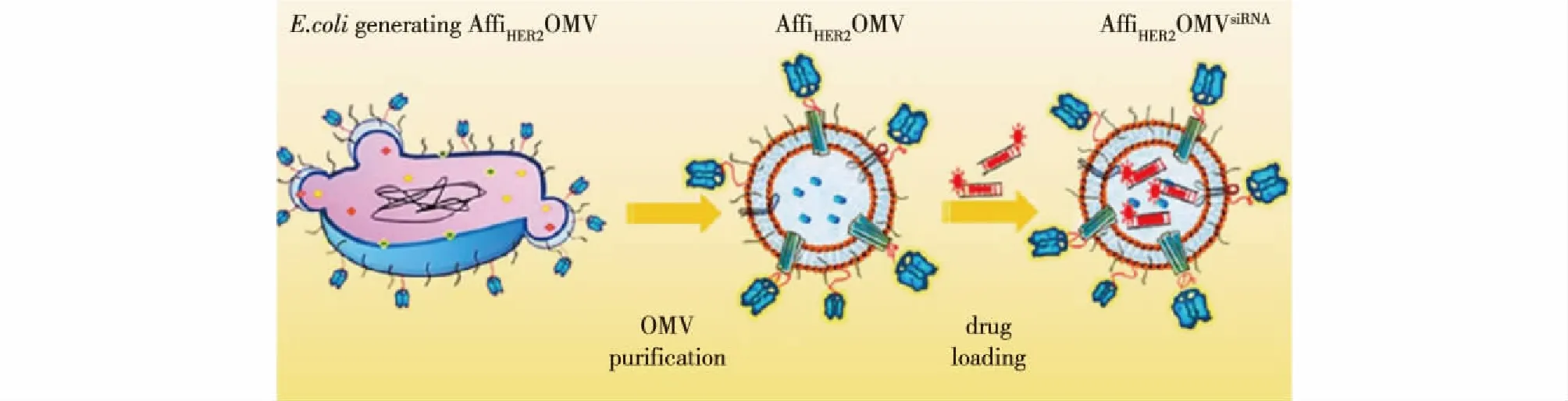
图1 表达HER2特异性亲和体的OMV的示意图[45]Fig.1 Schematic representation of OMVs expressing HER2-specific affibody (AffiHER2OMV)[45]
1.3 OMVs装载DNA的机制
核酸运用于肿瘤的治疗[48]是当前研究热点,OMVs可以用来传递DNA[49],但是关于DNA的装载机制还存在很多争议。Renelli等[50]在2004年提出的模型中,细菌裂解后释放的细胞外DNA通过类似于细菌转化中使用的机制被内化在囊泡中,通过检测出OMVs中的“裸”质粒DNA来证实这个模型。他们还提出外源DNA可能通过打开和关闭一小部分OMVs来内化,但是检测到的DNA数量并不能完全证实这个猜想。
2010年Mashburn-Warren等[51]提出,在细菌OMVs释放前,DNA是以某种方式从细胞质透过质膜再直接被OMVs包封,然而支持这个模型的实验数据还不够充分。
另一个是Pérez-Cruz等[52]在2013年通过高压冷冻和冷冻置换(HPF-FS)的透射电子显微镜(TEM)技术,观察到了北极泡状希瓦氏菌M7T会产生双层的OMVs,通过蛋白组学研究证实了该菌株的OMVs中存在质膜和细胞质蛋白质,并使用免疫金渗滤法证实了囊泡内DNA的存在。他们的研究也证实了Kadurugamuwa等[53]在1995年提出的观点,肽聚糖层可以被自溶素降解,这种短暂和局部的破坏会导致细菌形成OMVs,OMVs中包含了DNA等物质。
2 细菌原生质体囊泡(bacterial protoplast-derived nanovesicles,PDNVs)
2.1 PDNVs的来源及组成
PDNVs是指细菌去除细胞壁剩下的部分[54],制备PDNVs的方法较多,例如,酶降解[55]或用基因工程阻止细胞壁的合成[56]等。虽然PDNVs的毒性较小,目前还没有体内实验证实其是否对人体存在安全性问题[55-56],但是,它可以作为一个多功能的载体,容纳不同特性的分子,如蛋白质、化学物质、核酸和脂质。
2.2 PDNVs在药物递释系统中的应用
Kim等[54]利用大肠杆菌制成了无毒的PDNVs(图2),以此作为疫苗的载体,比目前的疫苗载体引起更强的抗原特异性体液免疫应答和细胞免疫应答,更重要的是,PDNVs可以避免因细菌抗原引起的小鼠败血症,利用这些特性,PDNVs能在肿瘤免疫疗法中有很大的潜力。
肿瘤细胞已经被证实会过度表达表皮生长因子受体(EGFR)[58-59],表皮生长因子(EGF)可以作为PDNVs的靶向部分,以靶向肿瘤细胞表面的表面生长因子受体。2017年, Kim等[60]设计并制造了表达EGFR的大肠杆菌原生质体纳米囊泡(EGFR-PDNV),在体内和体外实验中以此来载药的EGFR-PDNV都能有效地将药物递送至小鼠体内肿瘤细胞,抑制肿瘤细胞生长,并且没有发生有害反应。同时,他们提出了新的研究方向:①使用GE11肽或者HER2结合亲和体分子作为靶向部分;②用聚乙二醇覆盖PDNVs,延长血液循环时间。

图2 PDNVs和载入抗原的PDNVs制备的示意图[57]Fig.2 Schematicdiagram of PDNVs and antigen-loaded PDNVs preparation[57]
3 微细胞(minicells)
3.1 微细胞的来源和组成
MacDiarmid等[61]发现鼠伤寒沙门氏菌(S.typhimurium)、大肠杆菌(Escherichiacoli)、弗氏志贺氏菌(Shigellaflexneri)、铜绿假单胞菌(Pseudomonasaeruginosa)和单核细胞增多性李斯特氏菌可以通过minCDE蛋白产生染色体缺失的突变体——微细胞, minCDE蛋白通过抑制FtsZ来控制正常细菌的细胞分裂[62](图3)。虽然这些微细胞直径一般为(400±20) nm[58],但是De Jong等[63]发现一个微细胞中可以装载多达一百万个药物分子。
微细胞形态上呈一个稳定的圆形,依然保持着由20多种脂多糖(内毒素)组成的细胞壁结构[64],类似于亲代细菌。同时,微细胞有其亲代细胞的除了染色体DNA以外的所有成分。
Lee等[65]用谷氨酸棒状杆菌(Corynebacteriumglutamicum)产生无内毒素的微细胞。谷氨酸棒状杆菌是革兰氏阳性菌,其符合美国FDA食品添加剂的安全性指标。乳酸菌是一种有益菌,乳酸菌的革兰氏阳性细胞壁主要由肽聚糖、磷壁酸、蛋白质和多糖组成[66]。Giacalone等[64]将乳酸菌的微细胞作为递药载体,实验证明其具有很好的安全性和生物相容性。
3.2 微细胞在药物递释系统中的应用
微细胞可以通过EGFR、人类表皮生长因子受体Ⅱ(ERBB2)、CD33或CD3的双特异性抗体靶向肿瘤细胞[45,67]。微细胞通过受体介导的内吞作用进入肿瘤细胞,在体内实验中,装载阿霉素的微细胞能够抑制小鼠体内乳腺、卵巢或肺部肿瘤生长[61]。Solomon等[68]已经进行了装载紫杉醇的微细胞的Ⅰ期临床试验,其表现出了良好的抗肿瘤活性,并且没有导致促炎性因子的增加。MacDiarmid等[69]以17个不同品种的带有晚期脑肿瘤的狗为模型,证明了微细胞载药体系在脑肿瘤靶向和治疗方面的巨大潜力。
Vinh等[70]和Nguyen等[71-72]将鼠李糖乳杆菌(L.rhamnosus)和嗜酸乳杆菌(L.acidophilus)通过葡萄糖和果糖产生最大尺寸小于400 nm的微细胞,并将其用于递送顺铂、紫杉醇和头孢菌素。MacDiarmid等[61]成功把siRNA和shRNA包封入来自鼠伤寒沙门氏菌的微细胞中,并通过BsAb靶向EGFR。Jivrajani等[73]利用由叶酸来修饰包封shRNA的微细胞靶向肿瘤细胞,再释放shRNA抑制血管内皮生长因子A(VEGFA),如图3所示。

图3 FAminicellsVEGFA制备的示意图[73]Fig.3 Preparation of FA minicellsVEGFA[73]
4 结论与展望
细菌载体的出现为纳米载药系统的研发提供了新思路,为肿瘤治疗提供新的途径。其中,细菌衍生物载体具有更好的操控性和安全性,并在实验中有很好的表现。但细菌衍生物载体毕竟还是一个崭新的领域,很多细菌衍生物产生的机制和载药的机制尚不明确,如何高效地把载体靶向至肿瘤组织或细胞,如何降低或消除细菌衍生物的毒性,这些问题都是未来的研究难点和重点。相信随着生物工程技术和基因工程技术的不断发展和完善,细菌衍生物载体技术会越来越成熟,最终运用至肿瘤患者的临床治疗中。

