巯基化γ-聚谷氨酸微纳米纤维及其抗氧化性能
徐婷婷,王 瑞,李 莎,迟 波,徐 虹
(南京工业大学食品与轻工学院材料化学工程国家重点实验室,江苏南京211800)
随着医学研究的发展,研究者发现体内自由基的不平衡与某些慢性疾病有关[1]。在人体正常代谢范围内,自由基能够起到抗菌、消炎、抗老化、调节内分泌及抗癌等作用。但是,超过人体代谢水平的自由基,会破坏蛋白质结构、脂肪组织、细胞膜及DNA结构等,进而引起慢性疾病[2]。
抗氧化剂是指能够有效抑制自由基发生氧化反应的一类物质。目前,抗氧化剂主要有植物源、动物源及微生物源等抗氧化剂[3-4],比如:茶多酚、阿魏酸、枸杞多糖、肌肽、谷胱甘肽、壳聚糖、蚕丝蛋白和聚氨基酸等。抗氧化生物高分子在护肤品和医用材料方面有着良好的应用前景。研究者发现蚕丝蛋白抗氧化水凝胶支架材料可有效保护皮肤成纤维细胞,免受自由基的伤害[5];壳聚糖基水凝胶材料可有效对氧自由基清除,在髓核再生和护肤品研发方面具有很好的前景[6-8]。
γ-聚谷氨酸(γ-PGA)是通过生物发酵法制备的以酰胺键聚合的阴离子型多肽聚合物,分子量从几千到两百万不等[9]。γ-PGA的主链上的有大量羧基,可进行功能化修饰形成衍生化γ-PGA,广泛应用于食品、农业、化妆品和医用材料领域[10-12]。在组织工程应用方面,γ-PGA可被制备成水凝胶、纳米纤维等支架材料,仿生细胞外基质,为细胞提供三维空间支架,供细胞黏附、增殖和分化[13-15]。Yang等[16]将聚乙烯醇(PVA)与聚谷氨酸(PGA)混合后进行静电纺丝,在接种后细胞增殖数量最多,表明该材料在组织工程应用中具有较好的潜质。Koeda等[17]利用静电纺丝聚谷氨酸纳米纤维中封装活性蛋白质,通过蛋白活性的测试,证明其具有良好的装载生物活性物质的能力。张天娇等[18]研究得出γ-聚谷氨酸在体外有中等程度的抗氧化活性及良好的透明质酸酶抑制活性,在功能性化妆品中具有广阔的应用前景。但是具有高抗氧化性能的γ-PGA支架材料研究甚少。
本研究中,笔者采用L-半胱氨酸(L-Cys)修饰γ-PGA,利用静电纺丝法制备可交联γ-PGA(γ-PGA-SH)微纳米纤维,并研究交联后的γ-PGA-SH纤维(γ-PGA-SS)抗氧化性能,开发其在医用材料和化妆品领域的应用。
1 材料与方法
1.1 试剂与仪器
γ-PGA(重均分子量7.0×105,南京轩凯生物科技有限公司);1-乙基-(3-二甲基氨基丙基)、碳酰二亚胺盐酸盐(EDC·HCl)、2-羟基-4’-(2-羟乙氧基)-2-甲基苯丙酮(I2959)、甲醇、N-羟基琥珀酰亚胺(NHS),国药集团化学试剂有限公司;L-半胱氨酸盐酸盐、水杨酸钠、邻苯三酚三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(DPPH),上海阿拉丁试剂有限公司;铁氰化钾、磷酸钠、三氟乙酸、FeCl3、FeSO4、H2O2、无水乙醇,上海凌峰化学试剂有限公司。
核磁共振氢谱仪(1H NMR)(Avance 400 MHz),德国Brucker公司;Nicolet 8700型红外光谱仪,美国Thermo公司;TL-01型静电纺丝机,通力微纳科技有限公司;S-4800型扫描电子显微镜,日本Hitachi公司;TGA4000型热重分析仪,北京恒久科学仪器有限公司;1510型酶标仪,美国Thermo公司;DZF-6050型真空干燥箱,上海一恒科学仪器有限公司;ALPHA 1-2 LD plus型冷冻干燥机,德国Martin Christ公司。
1.2 γ-PGA-SH原料的合成及表征
称取1 g的γ-PGA溶于80 mL去离子水中,放置于100 mL烧杯中充分溶解后,加入0.093 mol/L的EDC/NHS缩合剂进行活化,活化时间为30 min。将L-半胱氨酸盐酸盐溶于20 mL去离子水中,然后缓慢滴加到反应体系中,控制反应pH(pH=4.8),N2保护并避光反应24 h。使用12 000重均分子量的透析袋透析72 h,注意保持透析液pH=5。
将上述合成的γ-PGA-SH溶解于氘代水中,采用核磁共振氢谱仪(1H NMR)和红外光谱仪进行表征。
1.3 静电纺丝法制备γ-PGA-SH微纳米纤维
室温下,将γ-PGA-SH溶于5%(体积分数)的三氟乙酸水溶液中,磁力搅拌24 h,配成质量分数为25%的均匀溶液。在γ-PGA-SH纺丝溶液的喷丝头到接收装置之间的距离25 cm、直流电压25 kV、接收距离25 cm、温度为室温以及纺丝溶液的推进速率为0.1 mL/h的条件下进行静电纺丝,制备成未交联γ-PGA-SH微纳米纤维。
1.4 γ-PGA-SS微纳米纤维的制备
在制得的γ-PGA-SH微纳米纤维膜上滴加0.5%(质量分数)的I2959甲醇溶液,在365 nm的紫外灯下光照10 min,使得纤维中的巯基形成二硫键(S—S)发生交联反应,从而得到在水中具有良好稳定性的γ-PGA-SS微纳米纤维。
1.5 γ-PGA-SH和γ-PGA-SS微纳米纤维的性能测试
1.5.1 扫描电子显微镜(SEM)
使用Hitachi S-4800型场发扫描电镜观察纤维表面形貌。并使用Image-ProPlus 6.0(IPP6.0)软件对纤维直径分布统计和利用Origin高斯(Gaussa)拟合分析。
1.5.2 热重分析(TGA)
将烘干的纤维样品剪碎,称取5 mg,放入坩埚内,在热重分析仪中设定温度范围为40~600 ℃,升温速率10 ℃/min,得到温度与质量损失的曲线。
1.6 γ-PGA-SS微纳米纤维抗自由基测试
1.6.1 还原能力测定
先将2 mg交联后的γ-PGA-SS微纳米纤维浸入2 mL蒸馏水中充分溶胀,再加入2 mL磷酸缓冲液(pH=6.0,0.2 mol/L)、2 mL的1%铁氰化钾,混匀放入50 ℃的恒温水浴20 min。冷却至室温后,加入2 mL 10%的三氟乙酸、0.5 mL 0.1%的FeCl3和2 mL去离子水,反应10 min。以去离子水为空白对照,常温下在700 nm处测定吸光值(A)。
还原能力的计算见式(1)。
还原力吸光度值=A1-A0
(1)
式中:A0为空白样品;A1为样品。
1.6.2 ·OH清除能力测定
将2 mg的交联后的γ-PGA-SS微纳米纤维浸入1 mL蒸馏水中充分溶胀,加入2 mL FeSO4、2 mL H2O2(0.01%),混合均匀,然后加入2 mL水杨酸-乙醇溶液。将各试管放入37 ℃恒温水浴中,反应1 h。冷却到室温,充分摇匀,取上清液,在510 nm波长处测量吸光值(A′)。
清除率的计算见式(2)。
清除百分率=((A0′-A1′)/A0′)×100%
(2)
1.6.3 DPPH·清除能力
根据Yang等[19]实验方法进行改性。配制50 mg/ml的DPPH无水乙醇溶液。将2 mg改性的γ-PGA-SH原料和交联后γ-PGA-SS纤维分别浸泡在2.5 mL的去离子水中,加入0.5 mL的DPPH乙醇溶液,混合后,室温下避光反应30 min。结束后,取1 mL的反应液在519 nm下测其吸光值(A″),无水乙醇为空白对照组。通过式(3)计算DPPH·清除率。
清除率=((A0″-A1″) /A0″)×100%
(3)
2 结果与讨论
2.1 γ-PGA-SH的合成与表征结果
通过EDC/NHS的缩合,在γ-PGA的羧基与L-Cys的氨基之间形成酰胺化反应,从而制备γ-PGA-SH。合成路线如图1所示。
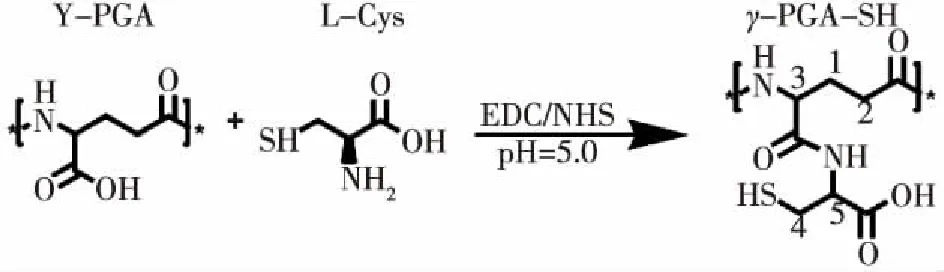
图1 γ-PGA-SH合成路线Fig.1 γ-PGA-SH synthetic route
经核磁共振氢谱仪(300 MHz,D2O)的表征,结果如图2所示。从图2可知:化学位移(δ)=4.08~4.28为γ-PGA的α碳原子(CH)的H原子吸收峰,δ=2.25~2.47和δ=1.85~2.22 分别为γ-PGA的β碳原子和γ-碳原子(CH2)的H原子吸收峰。 在γ-PGA-SH图谱上,δ=3.35~3.58为L-Cys的α碳原子(CH)的H原子吸收峰,δ=2.78~3.08为L-Cys的β碳原子(CH2)的H原子吸收峰。根据γ-PGA以及γ-PGA-SH吸收峰的位置和峰型,判断L-Cys成功接枝在γ-PGA主链上。并且根据L-Cys的α碳的H原子吸收峰面积与γ-PGA的α碳的H原子吸收峰面积之比,得出接枝率为55.6%。
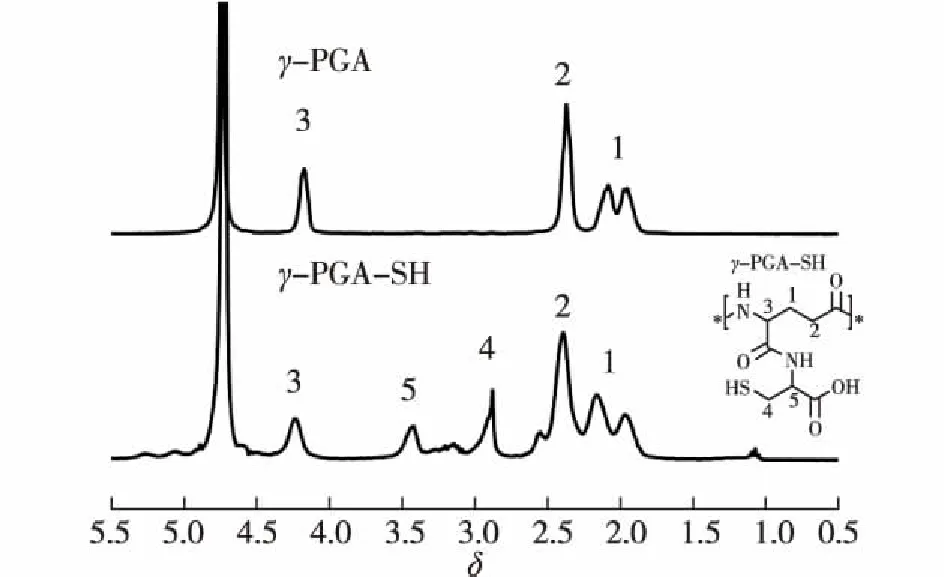
图2 γ-PGA-SH的1H NMR图谱Fig.2 1H NMR spectrum of γ-PGA-SH

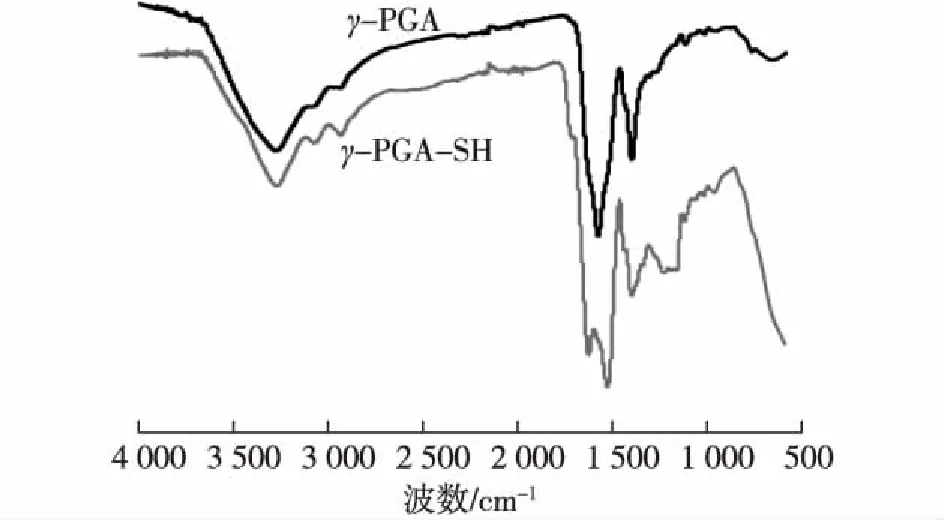
图3 γ-PGA和γ-PGA-SH的FT-IR红外光谱Fig.3 FT-IR spectra of γ-PGA and γ-PGA-SH
2.2 纤维形貌和直径分布分析
通过SEM观察未交联γ-PGA-SH和交联后
γ-PGA-SS微纳米纤维的形貌,如图4所示。由图4可知:未交联γ-PGA-SH微纳米纤维分布均匀且连续;而交联后γ-PGA-SS微纳米纤维经处理后依然保持连续性且具有良好纤维形状。通过图4(c)和4(d)纤维直径分布图可得,未交联的纤维直径分布在几十纳米至1 μm,且平均直径分布在800 nm左右;而交联后的纤维直径有所变大,主要分布在400 nm~1.0 μm,平均直径分布在1 100 nm。交联后直径比交联前有所提高,主要由于纤维之间的交联反应使得纤维之间接触面增加,纤维形貌变得扁平。由此可知,交联后的纤维仍有空隙和空间结构。
2.3 热重分析结果
图5为微纳米纤维热重分析结果。由图5可知:未交联的γ-PGA-SH纤维和交联后的γ-PGA-SS纤维热分解主要分3个阶段。第一阶段在50~220 ℃,主要是由于纤维水分蒸发而造成的;第二阶段在230~440 ℃,主要是纤维中γ-PGA-SH分子的热分解;第三阶段是450~600 ℃,这是γ-PGA-SH内部分子作用力被破坏而热分解。在230~310 ℃时,交联后的γ-PGA-SS纤维的热分解速度比未交联的γ-PGA-SH纤维的热分解速度慢,主要由于γ-PGA-SS纤维之间通过S—S形成一定交联网络,提高了纤维的热学性能。说明交联后的γ-PGA-SS纤维热稳定性有所提高。
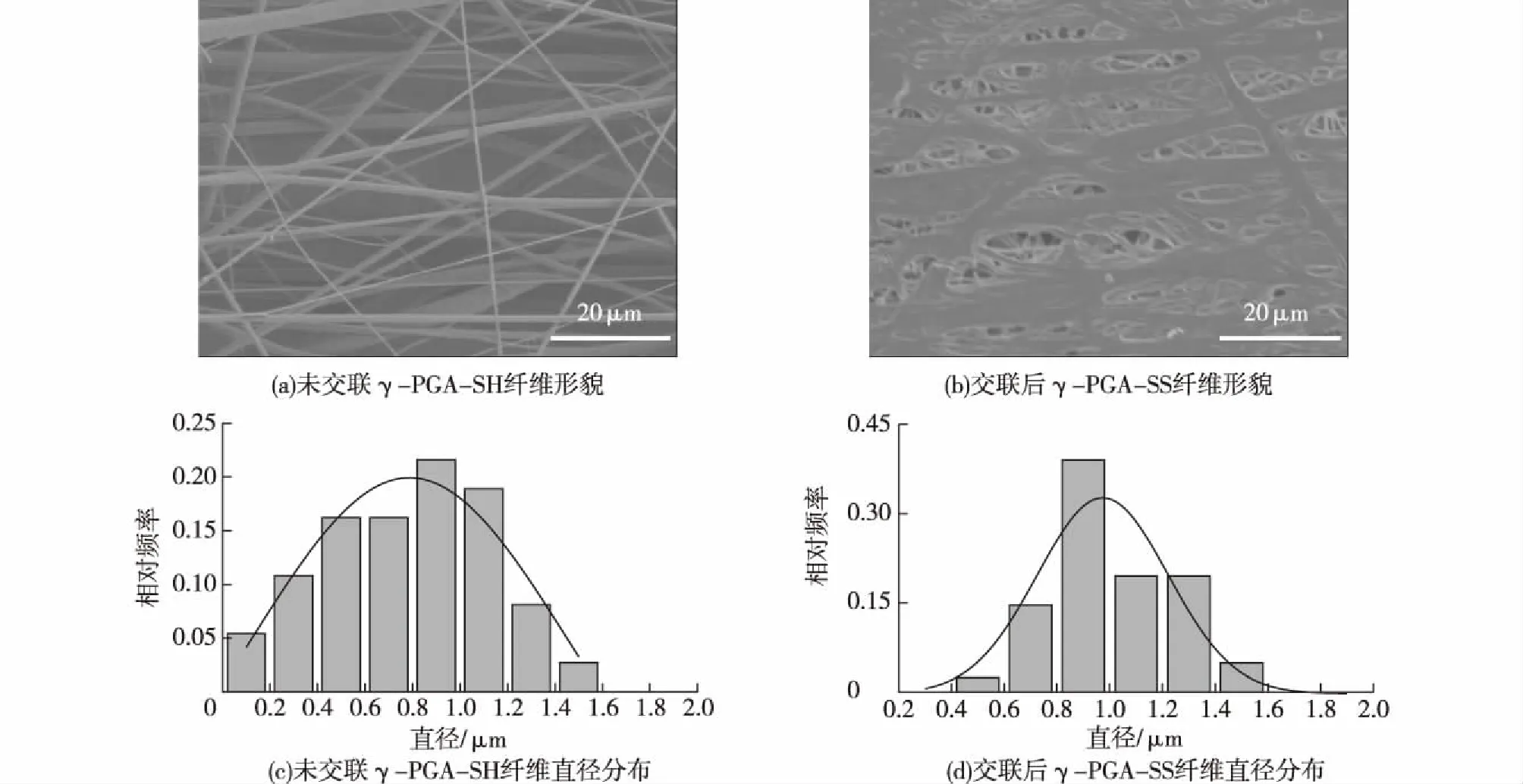
图4 SEM观察的纤维形貌图和纤维直径分布Fig.4 Fibers morphology characterized by SEM and the diameter distribution
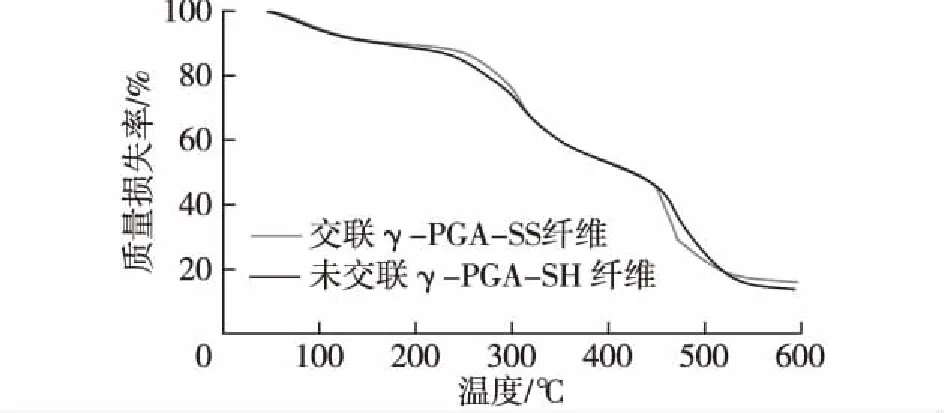
图5 未交联γ-PGA-SH纤维和交联后 γ-PGA-SS纤维的热重分析Fig.5 Thermogravimetric analysis of uncrosslinking and ncrosslinking γ-PGA-SH fiber
2.4 抗氧化性能
通过多种指标来评价γ-PGA-SH原料和交联后γ-PGA-SS纤维抗氧化性能,结果如表1所示。由表1可知:相比γ-PGA-SH原料,交联后γ-PGA-SS纤维的抗氧化性能发生了明显下降。主要由于纤维在交联时消耗部分巯基,这个现象与热重分析的现象一致。但是其抗氧化水平作为纤维支架在生物医用材料上仍然具有很大的优势。
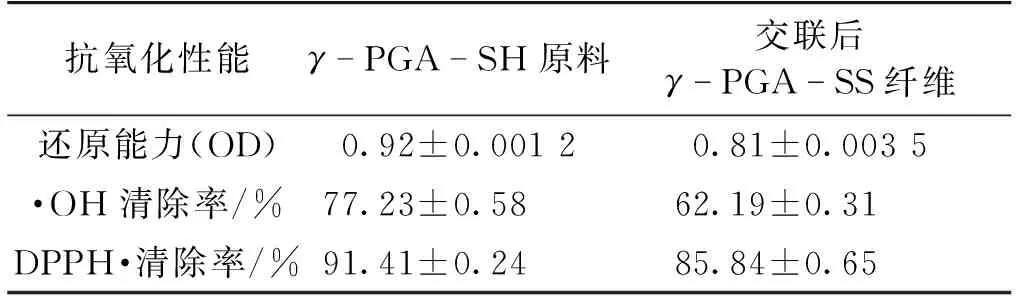
表1 γ-PGA-SS纤维的抗氧化性能
注:通过SPSS 18.0进行数据分析分析,同种性能不同样品差异显著(P<0.05;数据为平均值±标准差)。
3 结论
静电纺丝法制备γ-PGA-SS微纳米纤维,不仅可以通过S—S交联纤维,使得纤维形成交联网络状三维结构,仿生天然细胞外基质,还具有良好的抗氧化性。在细胞生长时提供支撑,且能够清除病损部位过量的自由基,加速伤口愈合和促进皮肤修复。因此,γ-PGA-SS微纳米纤维在医用材料和美容护肤有着很好的应用前景。

