三维打印羟基磷灰石/磷酸三钙骨支架工艺中粉体材料组分比及黏结剂对骨支架性能的影响
杨明明,汪焰恩,魏生民,魏庆华,柴卫红,李欣培
(西北工业大学机电学院,陕西西安710072)
由于成分组成及物理特性与自然骨中的无机矿物盐很接近,磷酸钙基生物陶瓷广泛应用于骨组织工程[1]。羟基磷灰石(hydroxyapatite,HA)是骨组织的主要无机矿物盐,占整个干骨质量的 60%~70%,并且具有良好的生物相容性和骨传导性,但是纯HA支架存在易脆、降解速度慢等缺点;磷酸三钙(β-TCP)具有良好的生物降解性和生物相容性,植入体内能逐渐降解,并被新生骨取代,但是β-TCP在生理环境下降解速度过快,力学强度低。当前生物骨材料研究的热点是通过多种磷酸钙基材料混合制备性能优良的复合支架材料,以克服单相生物骨材料缺陷。双相钙磷酸盐(biphasic calcium phosphate, BCP)[2]是由两个或更多的陶瓷相复合而成,可以克服单相陶瓷的缺点。
随着骨组织工程的发展,出现了基于计算机辅助设计和制造的快速成型技术(rapid prototyping,RP)。利用快速成型技术[3]制备组织工程支架,可克服传统方法制备人工骨支架尺寸精度不高、力学强度不佳、无法实现个性化定制骨支架和很难制备复杂结构的骨支架等缺陷。三维打印[4](three dimension printing,3DP)是快速成型技术的一种,其工作原理是三维打印机读取零件三维截面信息数据,通过控制喷嘴,喷洒黏结剂,选择性地将生物骨材料黏在一起形成截面轮廓,层层递进,最后得到零件整体。而在粉末黏结三维打印骨支架的制备过程中,黏结剂对支架的微观结构、力学性能、尺寸精度和生物相容性起到关键的作用,因此,在粉末黏结三维打印骨支架的制备过程中,黏结剂的合理选取显得尤为关键。
近年来,各种HA/β-TCP复合比例已经被研究,但是很少应用于临床[1],最佳的HA/β-TCP复合比值也还没有确定。Hench等[5]认为:对3D打印的酸性胶水溶液进行优化可以改善骨支架的打印精度、力学强度和生物相容性。很少有人研究黏结剂-粉末系统。因此,新的黏结剂-粉末系统对于骨组织工程是非常关键的,这种黏结剂-粉末系统使得打印的骨支架具有良好的力学性能和生物相容性。
本研究中,笔者通过使用不同胶水(聚乙烯醇(PVA)和磷酸)制备具有不同HA/β-TCP比例的复合骨支架,并对骨支架的孔隙率、吸水性、力学性能、微观结构以及生物相容性等基本性质进行实验研究和探讨,以期为三维粉末打印骨生物陶瓷支架基体材料和胶水的优化、配比选择提供工艺指导。
1 材料和方法
1.1 材料
生物材料HA和β-TCP,购于西安博恩生物科技有限公司。HA 和β-TCP粉末的Ca/P化学组成比分别是1.67和1.5。称量合适的HA和β-TCP,完全混合以制备理想的HA/β-TCP质量配比(100∶ 0、20∶ 80、40∶ 60和60∶ 40)作为打印机粉料。此外,配制PVA(分子量为79 156,青岛优索化学科技有限公司)溶液和磷酸(85%,天津市百世化工有限公司)溶液作为3D打印机黏结剂用于制备骨支架。实验发现,当PVA黏结剂质量分数为0.8%、磷酸黏结剂的质量分数为8.75%时,骨支架的力学性能最佳,故本文中,笔者选用PVA黏结剂的质量分数为0.8%,磷酸黏结剂的质量分数为8.75%。
1.2 骨支架制备
使用三维建模CAD软件设计大孔骨支架(高为3 mm、直径为10 mm、孔隙率为70%、大孔直径为600 μm),并将其导出*.STL格式输入到3D打印机(Zprinter 250,美国ZCorporation有限公司),制备设计的骨支架模型,打印过程中铺粉厚度为0.1 mm,黏结剂的控制用量为0.3 L/m2。待打印完毕,骨支架放在打印机中干燥2 h(干燥温度维持在50 ℃),然后取出试样支架,去除未黏结的粉末,完成骨支架制备。图 1(a)为用于 ZPrinter 250打印机的骨支架设计模型;图1(b)为所打印的人工骨支架,其直径、高度与设计尺寸(直径φ=10.0 mm及高度H=3 mm)基本一致。
使用3D打印机制备两组骨支架,根据使用的黏结剂命名为聚乙烯醇骨支架和磷酸骨支架。每组骨支架有4种不同HA/β-TCP比例的骨支架被制备。表1对不同成分的骨支架进行了标记。

表1 不同成分骨支架的标记
1.3 骨支架性能测试
1.3.1 吸水率
通过骨支架吸水率实验来评价亲水性。将骨支架置于去离子水中,利用ME203E型微量天平(梅特勒-托利多公司)每隔一段时间(5、10、30、60、120和240 min)测量骨支架质量,称质量前用滤纸将骨支架表面自有液体吸出。最后根据测量数据计算骨支架的吸水率(bibulous rate),吸水率[6]的计算见式(1)。
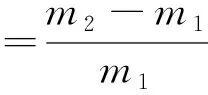
(1)
式中:m1为骨支架净质量;m2为骨支架各时间点所测量的质量。
1.3.2 孔隙率
使用重量分析法测量骨支架的孔隙率(porosity),其孔隙率P[7]的计算见式(2)。
P=(1-ρa/ρt)×100%
(2)
式中:ρa和ρt分别表示骨支架的实际密度和材料的理论密度,理论密度是指由HA粉体材料及黏结剂构成的密实结构所对应的密度,经测定,其值为3.08~3.17 g/cm3(HA和β-TCP的理论密度[8]分别为3.156和3.07 g/cm3),骨支架的实际密度等于其总质量除以总体积。
1.3.3 力学性能
利用CTM250型力学电子万能试验机(上海协强仪器制造有限公司)对样件支架进行抗压测试。加载时,压头速度2 mm/min,每组测6个样件。
1.3.4 支架微观特性
本研究使用X-MAX20/INCA 250型扫描电子显微镜(SEM,TESCAN公司)分别在100倍、200倍和500倍放大倍率下观察人工骨支架的微观形貌。
1.4 细胞增殖和分化实验
选出生1个月的大鼠,麻醉处死,无菌条件下从胫骨中获取骨髓间充质干细胞,制成单细胞悬浮液,接种于培养瓶内,放置在37 ℃、体积分数5% CO2、相对湿度95%的环境下培养,达到85%铺满,胰酶进行消化传代,1×104个/cm2的细胞密度接种,每隔2 d换培养液。第3代细胞被用于后续试验。
将8种支架分别置于100%酒精溶液中浸泡24 h处理,然后分组放入24孔培养板内。用完全培养基将第3代骨髓间充质干细胞制成细胞悬液调整成2×106个/mL细胞浓度的悬浮液,并往装有骨支架的孔内分别滴加10 μL骨髓间充质干细胞悬液。而后静置于37 ℃、5% CO2、相对湿度95%的细胞培养箱内,3 h 后取出并翻转骨支架,再滴加 10 μL骨髓间充质干细胞悬液,并继续置于细胞培养箱内静置3 h。之后向装有骨支架样本的培养孔内分别添加质量分数为10%磷酸盐缓冲液(PBS)的完全培养基,每隔2 d对培养基进行更换。分别于细胞接种骨支架后3、7和14 d将骨支架取出(每组样本数为6),用无菌PBS冲洗后重新放置于新24孔板内,按照CCK-8细胞增殖检测试剂盒的说明进行操作,最后将反应液转移至96孔板内,并通过紫外酶标仪450 nm测定其吸光度。
1.5 统计学分析
采用SPSS 13.0统计软件包进行数据分析,实验结果以均值±标准差(x±s)表示,统计结果采用方差分析及q检验,P<0.05为有统计学意义。
2 结果与讨论
2.1 HA/β-TCP的比例对骨支架吸水性的影响
记录两组支架不同时间的质量,根据式(1)计算两组支架的吸水率,图2为两组支架吸水率-时间的曲线。由图2可知:在这两组支架中,HA/β-TCP的比例对支架的亲水性没有明显影响。磷酸骨支架的平均吸水率为173%,然而聚乙烯醇支架的平均吸水率是248%。显然,就吸水率而言,聚乙烯醇骨支架的亲水性更好,这是由于聚乙烯醇有高的吸水性。
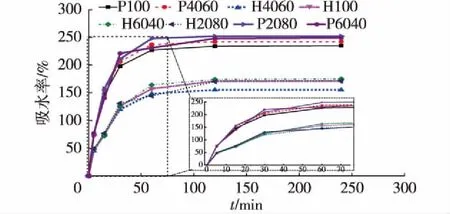
H-聚乙烯醇,P-磷酸图2 HA/β-TCP比例对骨支架 吸水率的影响Fig.2 Effects of different HA/β-TCP ratios on bibulous rate of scaffolds (P-polyvinyl alcohol scaffolds, H-phosphoric acid scaffolds)
2.2 HA/β-TCP的比例对骨支架孔隙率的影响
孔隙率的测量是为了评价骨支架的设计孔隙率与实际孔隙率的差别,这个信息对于定制骨支架起到关键作用。图3为两组支架孔隙率测量结果。由图3可知:骨支架的实际孔隙率与设计的孔隙不一致。对于聚乙烯醇骨支架,骨支架的实际孔隙率明显低于设计孔隙率 (p<0.05)。然而,磷酸骨支架样件的实际孔隙率呈现出少于5%的偏差。结果表明胶水对孔隙率的打印精度有明显影响。此外,骨支架的孔隙是由两部分组成的:一部分是设计的孔隙,另一部分是粉体材料堆积时颗粒之间的微小空隙。无论是聚乙烯醇骨支架还是磷酸骨支架,样件的实际孔隙率都低于设计的孔隙率,这可以归因于支架内部没黏结的粉末没能充分去除。

虚线为设计孔隙率(70%),*表示聚乙烯醇骨支架孔隙率低于设计孔隙率图3 HA用量对骨支架孔隙率的影响Fig.3 Effects of HA concentration on the scaffold porosity
2.3 力学性能分析
经抗压强度测量,两组支架的抗压强度如表2所示。由表2可知,显然磷酸骨支架抗压性能明显优于聚乙烯醇骨支架。单位化柱状图(图4)可以更好地表述不同材料配比及黏结剂选用对支架结构性能的影响。由图4可知:对于磷酸骨支架,其平均抗压强度σbc度为4.7 MPa,当HA与β-TCP的比例为40∶ 60和60∶ 40时,抗压强度σbc分别是(4.9±0.20)和(4.84.8±0.23)MPa,而弹性模量E则为75~200 MPa,当HA与β-TCP的比例为60∶ 40时,骨支架弹性模量取得最大值(200 MPa)。聚乙烯醇骨支架的平均抗压强度则为2.7 MPa,弹性模量为30~60 MPa。此结果表明,适当的HA与β-TCP复合比例可明显提高骨支架的力学特性。
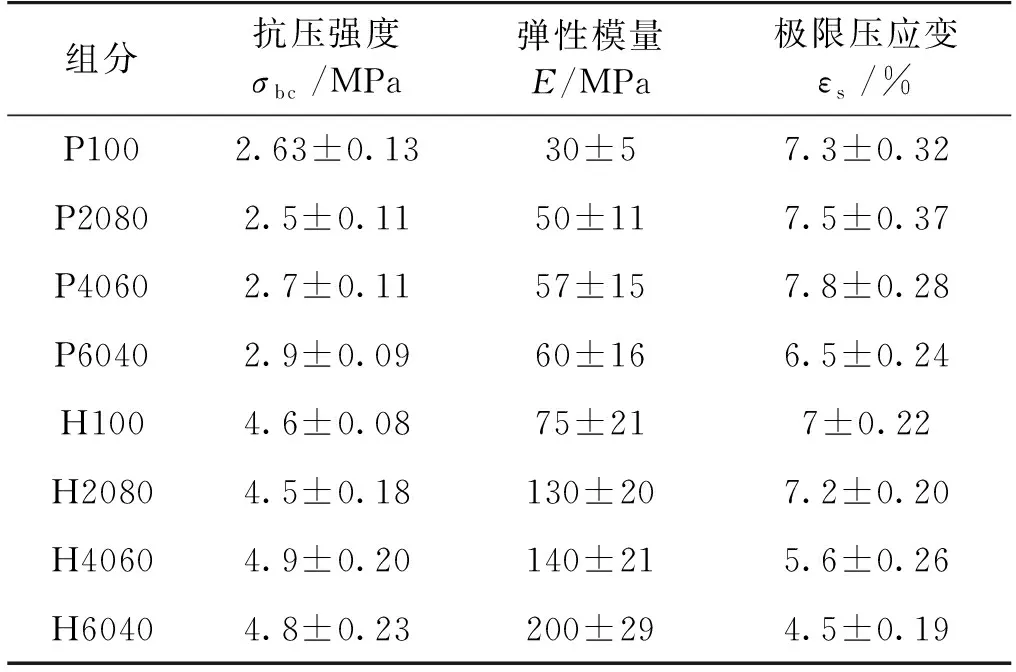
表2 骨支架的力学特性
Rouvillain等[9]认为TCP对支架强度起关键作用,骨支架力学强度随着β-TCP含量增加而降低。然而,本研究结果表明,骨支架的强度和β-TCP含量不存在简单的单调关系,制造方法等其他因素对支架的强度的影响不可忽略。
不同黏结剂的使用对骨支架力学强度有着很大影响。显然,笔者所研究的2组骨支架力学性能有很大差别。由于聚乙烯醇的黏度远大于磷酸,降低了聚乙烯醇的流动性及浸润特性,进而影响了其黏结生物陶瓷粉末的强度。
人们普遍认为,人工骨支架应该具有与自然骨相似的力学特性。松质骨的抗压强度是2 ~12 MPa[10],因此磷酸骨支架的力学特性更接近于松质骨。
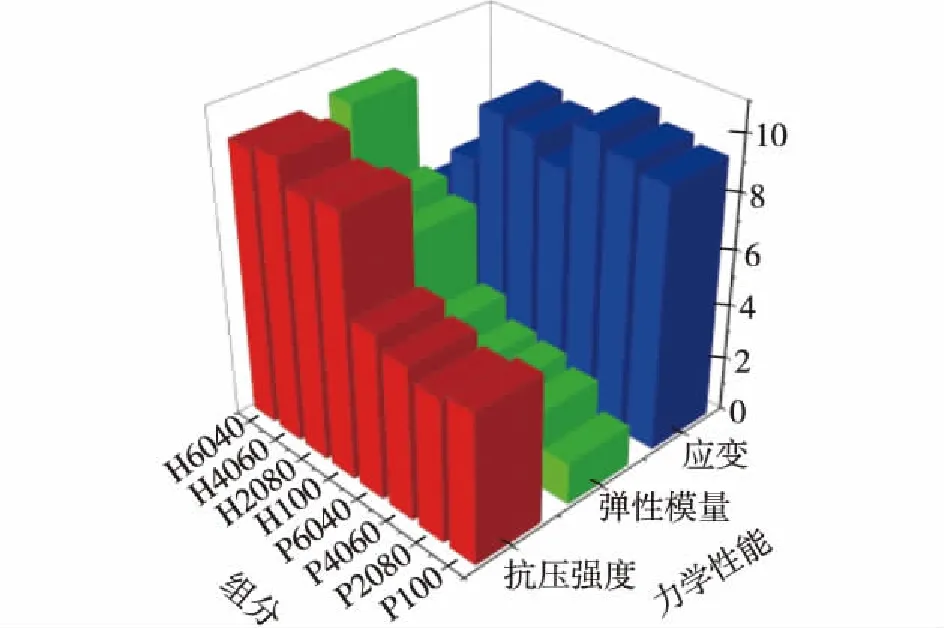
图4 骨支架力学性能单位化柱状图Fig.4 Normalized bar graph of scaffolds mechanical properties
2.4 骨支架微观结构
通过不同放大倍数的扫描电镜探究人工骨支架的微观形态,可以看出3D打印磷酸人工骨支架的支架内部富含多孔结构,骨支架的SEM照片如图5所示。由图5可知:由HA和β-TCP均匀混合黏结成的人工骨支架,其实际大孔尺寸与设计的大孔尺寸非常接近(图5(a))。由图5(b)及图5(c)可以看出:所打印骨支架上遍布HA和β-TCP颗粒形成的2~30 μm微孔。由图5(d)可以看出:聚乙烯醇骨支架微观形态与磷酸骨支架的形态非常相似,但聚乙烯醇骨支架的实际大孔尺寸略小于设计尺寸,这主要是由于聚乙烯醇具较大的黏度影响了流动性,造成了内部部分颗粒未能黏结牢固,坍塌或堵塞了部分内部孔道。另外,从图5(e)、图5(f)可以观察到聚乙烯醇骨支架上同样布满2~30 μm的微孔,与磷酸骨支架内部的微孔差异很小,这说明支架内部微孔形成于粉末与粉末之间,主要由粉末原材料尺寸决定。由于本文打印磷酸骨支架和聚乙烯醇骨支架所用粉末材料相同(均为HA和β-TCP),故两组骨支架内部微孔结构尺寸非常相似。图5结果表明,使用2种不同黏结剂制备的骨支架表面形态相似,均具有粗燥的外表面和实验表面,这种不规则微观表面有利于细胞黏附[11]。聚乙烯醇骨支架内部的设计大孔出现了堵塞现象。同时,2种骨支架内部均布满2~30 μm由HA、β-TCP颗粒材料堆积形成的微孔,这种随机微孔构成了次级连通孔隙网络,这些次级微孔连同设计大尺寸孔隙网络可有效完成营养物质的输送,从而促进成骨细胞向支架内部的攀爬及维持内部细胞的新陈代谢。大量实验表明,用于输送营养物质到支架内部的的连通孔隙网络是维持和促进支架内骨细胞生长发育的关键因素[12-13]。
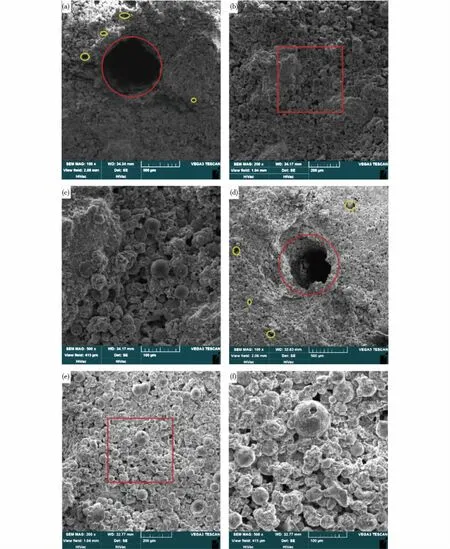
(a)和(d)分别是磷酸骨支架放大100倍和200倍的SEM;(b)和(e)分别为聚乙烯醇骨支架放大100倍和200倍SEM;(d)和(f)中分别是图(b)和(e)中红色矩形区域500倍SEM;此外,图中黄圈内为粉末颗粒间的微孔,红圈部分为设计孔道图5 骨支架的SEM照片Fig.5 SEM images of bone scaffolds
2.5 细胞增殖和分化结果
为了评价所制备骨支架的生物兼容性,将小鼠骨髓间充质干细胞分别在8种骨支架上培养3、7和14 d后,测量、观察各骨支架细胞增殖的吸光值(OD值),结果如图6所示。由图6可看出:8组支架上均能够培养小鼠骨髓间充质干细胞。开始前 3 d,8种支架的 OD 值均在上升,到第7天测量时,8种支架 OD 值均大于第3天测量值,其中H6040支架的 OD值是磷酸骨支架中达到最大的(分别为H100、H2080和H4060 的 222.58%、127% 和 106.15%);而P6040支架的 OD值则在聚乙烯醇骨支架中达到最大(分别为P100、P2080和P4060 的 234.28%、115.49% 和 103.79%)。无论是磷酸骨支架还是聚乙烯醇骨支架,当HA和β-TCP的复合比例为60∶ 40时,骨支架的OD值达到最大值,表明HA和β-TCP复合比例为60∶ 40的人工骨支架更加有利于细胞生长。此外,第14天测量结果表明8组支架的 OD值均小于第7天时的测量值,即培养后期所有支架的OD值均呈现下降趋势,这是由于经过前期的培养,细胞逐渐成熟并进入矿化阶段(mineral stage),从而导致 OD值减少。由于8种支架的OD值在前 7 d均呈上升趋势,因此所制备的8种支架均具有骨生长及骨化能力。
3 结论
首先使用 3D打印技术制备了具有连通孔道的HA/β-TCP骨支架,为了比较不同黏结剂及复合比例对骨支架性能的影响,分别选用磷酸和聚乙烯醇制备了不同复合比例的骨支架。其次,通过测量孔隙率、强度试验、电镜扫描及细胞培养试验,分别从微观结构、力学性能及生物兼容性方面分析了所制备各组骨支架的性能。试验结果表明,使用磷酸作为黏结剂的骨支架具有更加优越的力学性能和微观结构,细胞培养实验更进一步表明磷酸骨支架比聚乙烯醇骨支架具有更好的生物相容性。基于本文结果,磷酸骨支架(H6040)更有可能在临床试验中取得成功。
本研究将HA与β-TCP制备成复合材料,可集两单组分材料的优点,弥补二者各自的缺陷,是一种性能优良的生物骨材料。因此,HA/β-TCP合适的复合比例对于磷酸钙材料在组织工程的应用提供了有利条件。

