配位聚合物在生物医学中的研究进展
张翠婷,李 菁,孙敏捷
(中国药科大学药学院,江苏南京210009)
配位聚合物(coordination polymers,CPs)的概念首先由Bailar课题组提出[1-3]。配位聚合物是指由可以提供孤对电子或不定域电子的有机配体和可以接受电子的金属离子或金属簇通过配位键形成的无机-有机杂化化合物。配位聚合物在空间上呈现一维(1D)、二维(2D)或三维(3D)及无限网络状结构[4],配位聚合物的金属离子、有机配体之间通过配位相互作用和一些弱作用力,如氢键、π-π堆积及范德华力,自组装形成小的结构单元,然后这些结构单元通过上述作用力进一步组装成配位聚合物。
构建配位聚合物的有机配体和金属元素的选择非常广泛。有机配体作为金属离子之间的桥连基团,必须含有两个以上供电子原子。有机配体的构型、长度和功能均会影响配位聚合物结构和性能。过渡金属离子、镧系金属离子、碱金属离子及碱土金属离子作为配位聚合物的金属中心均有相应报道,金属离子的大小、配体场稳定能、配位构型也是决定配位聚合物结构和性能的重要因素[5-6]。
配位聚合物由无机金属离子和有机配体构成,因此兼具无机物和有机物的优良性质,如多孔性、比表面积大、可修饰和良好的热稳定性等[7-9]。同时,配位聚合物显示出固有的特性:1)利用配位方式的多样性控制和调节配位聚合物的空间结构或者纳米尺寸;2)配位聚合物中金属元素和有机配体的选择非常广泛,使其组成、结构及性能具有可设计性,更加丰富了配位聚合物在气体吸附与分离、催化、发光、分子识别[10]和生物医学等诸多领域的应用[11-13];3)很多金属元素在生物体中具有特定的功能,如O2的递送、基因的活化、肽酶的催化,可以利用此类金属元素使配位聚合物具有特定的生物学功能[14-16];4)纳米尺寸的配位聚合物可以实现肿瘤靶向,增强其在肿瘤部位的蓄积,降低全身毒性[17]。
近年来,配位聚合物已经成为配位化学、材料化学和生命科学等领域的前沿方向之一[18-19]。由于其高度的可调性和多功能性,在药物递送、生物成像等方面展示出不可估量的应用前景,成为生物医学领域新兴的研究热点。由于人体环境的特殊性,要求配位聚合物具有良好的生物相容性、在生理环境中优异的稳定性以及抵抗体内竞争配体的能力[20]。本文中,笔者对配位聚合物在生物医学中的应用进行了综述,列举了近年来这类配位聚合物的研究成果和开发进展,并对其发展前景进行展望,期望为今后开发新型配位聚合物提供依据。
1 配位聚合物用于药物的包载与递送
金属-有机框架 (MOFs)是一类特殊的配位聚合物,具有高孔隙率、高比表面积、可调的孔尺寸及可功能化的孔结构等优点,在气体的分离和存储、催化和药物包载等许多领域有巨大的应用潜力[21-23]。
目前,MOFs已作为载体用于包载药物或者荧光素,Zhuang等[24]采用去除金属-有机框架孔隙内有机溶剂的方法成功包载小分子荧光素,但是这种制备方法非常复杂,原材料比较昂贵,最大的缺点是金属-有机框架的孔隙大小不能调整,可以包载的化合物很有限[25-26]。Zheng等[27]利用一锅法制备包载抗肿瘤药物阿霉素的沸石咪唑类骨架材料8(ZIF-8)金属-有机框架(DOX@ZIF-8),如图1所示。这种制备方法简单、高效,而且金属-有机框架的孔隙大小可以通过调整包载的小分子浓度进行控制,结果证明:阿霉素分子均匀分布于框架中,且可以调节药物的包载量。另外,ZIF-8无毒、生物相容性好,且具有pH响应性,是非常有潜力的药物递送系统。
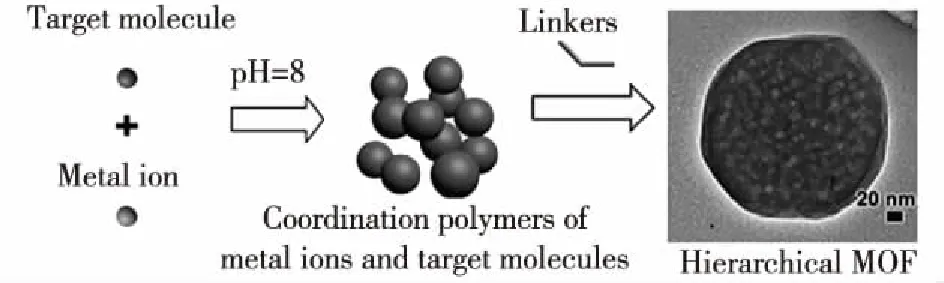
图1 负载目标分子的ZIF-8金属有机框架[27]Fig.1 ZIF-8 MOFs encapsulated target molecules[27]
通过金属-有机框架进行药物包载的缺点是载药量小,而且有的金属-有机框架在水中稳定性差,因此,Rieter等[28]、Poon等[29]设计并合成了一种新型的以铂类药物为配体的纳米配位聚合物,利用Tb(Ⅲ)离子与丁二酸修饰的顺铂配位,这种用药物作为有机配体的方法大大提高了载药量(图2)。合成的配位聚合物纳米粒,具有球状形态,平均粒径为(58.3±11.3)nm。由于配位聚合物在水中不稳定,因此用无定型SiO2外壳进行包裹,并且通过改变SiO2外壳的厚度可以有效地控制铂类药物的释放。另外,将带有巯基的RGD环肽接枝到纳米粒表面,能够增强配位聚合物纳米粒与血管肿瘤高表达蛋白的亲和力,从而增强细胞摄取。

图2 铂类药物配位聚合物纳米粒[28]Fig.2 Pt-based coordination polymer for effectively control release of the Pt species[28]
如上所述,由于高孔隙率、可调的孔尺寸及可功能化的孔结构等特性,多种金属-有机框架均可以作为良好的药物包载与递送系统。
2 配位聚合物用于生物成像
2.1 磁共振成像(MRI)
现代医学中,磁共振成像是最重要的非侵入性临床诊断方法之一。磁共振成像具有如下优点:软组织对比分辨率高;具有任意方向直接切层的能力,可以任意方位成像,全面显示被检查器官和组织的结构;能够直接做出横断面、矢状面和各种斜面的图像,方便进行解剖结构或病变的立体追踪;无创伤、无放射性损害[30-31]。
迄今为止,最广泛使用的造影剂是Gd(Ⅲ)配合物[32-33]。Kim等[34]报道了一种基于Gb(Ⅲ)的金属-有机框架,具有非常高的MRI弛豫率,但是Gd(Ⅲ)泄露导致的毒性限制了其临床应用,已有研究发现Gd(Ⅲ)会与内源性金属,如Zn(II)、Cu(II)发生交换,导致患者肾脏纤维化[35-36]。因此,含铁元素的配位聚合物由于生物毒性低,被广泛用于磁共振成像的研究,Liu等[37]报道了一种基于Fe(Ⅲ)的超小粒径配位聚合物,该配位聚合物具有pH敏感的磁共振成像效果,但含Fe(Ⅲ)的造影剂易产生伪像,从而导致误诊[38-39],因此,开发低毒且成像效果好的造影剂迫在眉睫。Taylor等[40]报道了基于Mn(II)的配位聚合物,该配位聚合物使用对苯二甲酸和苯均三酸作为配体,在反相微乳中与等摩尔的MnCl2反应18 h,然后用SiO2包裹在外层形成壳核型结构,将带有巯基的RGD环肽接枝到表面,使其具有肿瘤靶向性,结果发现:该配位聚合物毒性非常低,而且这类新型配位聚合物与细胞内蛋白质结合后表现出非常高的体内纵向MRI弛豫率,是非常有潜力的造影剂。
2.2 荧光成像
大多数光学成像剂是基于量子点(QDs)或掺杂染料的量子点,它们在光化学和代谢上具有很好的稳定性,并具有可调的发射光谱[41-42],但是,基于量子点的配位聚合物存在毒性大、易氧化和水中不稳定等问题。Soenen等[43]利用高分子包裹量子点,降低了部分毒性。
有研究表明超小粒径的配位聚合物量子点(<10 nm)能够显著降低量子点的毒性,Zhang等[44]报道了一种平均粒径为(3.0±0.5) nm的PZn配位聚合物量子点(图3),由Zn(II)和有机配体3,4,9,10-苝四羧酸钾构成。光学表征显示PZn配位聚合物量子点具有优异的水分散性、光稳定性和较高的光致发光量子效应。将制备好的PZn配位聚合物量子点用作荧光团,在455 nm波长下对A498细胞进行标记,荧光强度在3 min内保持不变,照射20 min后荧光强度仍然大于50%,与无机半导体量子点相近,优于传统荧光染料,传统的异硫氰酸荧光素染料荧光信号在2 min内基本消失。此外,PZn配位聚合物量子点与A498细胞共孵育24 h后,细胞活力几乎达到100%,表现出优异的生物相容性。
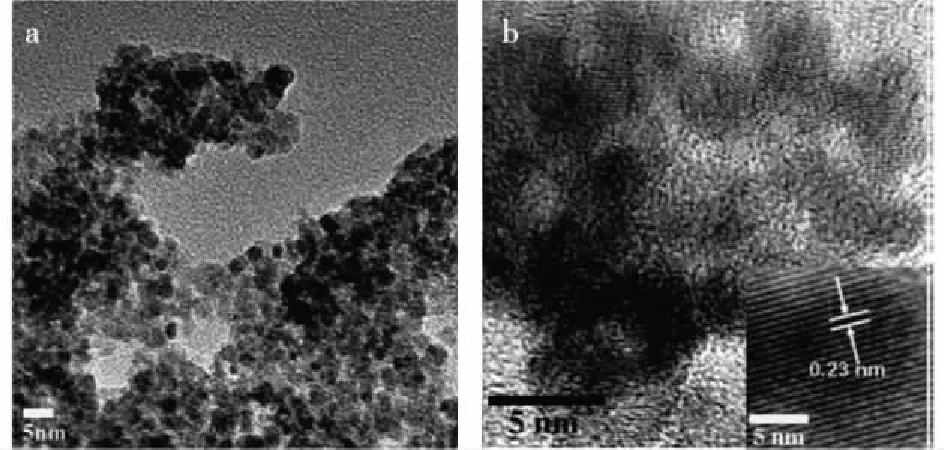
图3 PZn配位聚合物量子点的透射电镜(TEM)(a)和 高分辨透射电镜(HRTEM)照片(b)[44]Fig.4 TEM images (a) and HRTEM image (b) of PZn QDs, the inset is the corresponding HRTEM image[44]
2.3 近红外成像
镧系离子如Er(Ⅲ)(1 530 nm)、Nd(Ⅲ)(1 060 nm)和Yb(Ⅲ)(980 nm)以及研究较少的Pr(Ⅲ)(1 300 nm)和Tm(Ⅲ)(1 500 nm),作为近红外发光材料在生物医学上具有很大的潜力[45-47]。将这些具有近红外发射性镧系离子与有机配体制备成配位聚合物,能够得到一系列近红外成像材料。Marchal等[48]报道了2种水合配位聚合物[Nd(tpabn)]H3O·6H2O 和[Er(Htpabn)]·14H2O,两种水合物的近红外发光都是可检测的,但由于羟基振荡产生的猝灭效应导致强度较弱。因此,从镧系配位聚合物中去除水分是改善近红外发光的有效手段,Herrera等[49]利用Ru与二嘧啶制备去除水分的配位聚合物,表现出良好的近红外成像性能。
另外,有研究发现通过改变有机配体也能够明显改善和提高近红外成像效果,Foucault-Collet等[50]利用Yb(Ⅲ)离子构建一种新颖的配位聚合物纳米粒Yb-PVDC-3,由于Yb(Ⅲ)离子禁阻的f-f跃迁性质导致较低的消光系数,利用有机配体PVDC与Yb(Ⅲ)离子配位制备成配位聚合物,借助来自配体的能量传递或天线效应来激活(敏化)Yb(Ⅲ)离子近红外发光,结果表明该配位聚合物纳米粒具有高效的近红外成像效果。
2.4 多模式成像
单模式成像,因其各自固有的缺点,不能满足肿瘤的精确定位。目前,科研人员正在探索多模式成像材料,通过互补的成像方式对肿瘤进行精确定位,一些材料将磁共振成像、光学成像等相互结合用于肿瘤的监测并可为肿瘤的个性化诊治及精准治疗提供依据[51-52]。
Yang等[53]报道了一种多模式成像配位聚合物,同时具有T1加权磁共振成像和T2加权磁共振成像的功能。T1加权图像可以很好地显示脂肪等正常软组织的解剖学,而T2加权图像显示肿瘤和炎症的病理特征,因此,T1/T2双模式磁共振成像能够互相补充信息,得到精确的诊断结果。该研究利用纳米沉淀法,以1,1′-二羧基二茂铁(Fc)为结构单元,具有磁性的Gd(Ⅲ)离子为金属节点,获得直径约为80 nm的纳米配位聚合物,并在表面修饰RGD靶向肽,使其可以靶向到肿瘤部位,增强肿瘤部位蓄积。体内磁共振成像实验表明,静脉注射该配位聚合物具有明显的T1/ T2双模式成像效果。
磁共振成像与光学成像联合可提高其成像的准确性[54-56],Zhou等[57]利用Ir(Ⅲ)、Gd(Ⅲ)及吡啶类有机配体得到的配位聚合物具有优异的多模式成像效果。但是由于自体荧光、强光散射等原因限制了其临床应用。计算机断层扫描(CT)的空间和时间分辨率很高,但只能用于二维成像,将其与三维成像的磁共振成像结合,可用于肝血管分流术、动静脉畸形和膀胱造影,Alric等[58]报道了一种Gd(Ⅲ)配位聚合物包裹的金纳米粒,具备计算机断层扫描和磁共振成像的双模成像功能,有很好的应用前景。
综上所述,配位聚合物具有磁共振成像、荧光成像、近红外成像等多种生物成像功能,优异的成像效果和生物相容性使其具有很好的应用前景。
3 配位聚合物用于诊疗一体化
传统的肿瘤诊断与治疗过程是相互分离的,导致诊治效率低下,诊疗一体化这种全新的医疗诊治模式近年来越来越得到医生和科学家的关注。诊疗一体化是将诊断和治疗两个原本独立的过程整合在一起,在得出疾病诊断结果的同时进行治疗[59-61]。某些恶性肿瘤组织具有异质性和耐药性,诊疗一体化材料利用多种成像的优势,互相补充信息,能够区分肿瘤内部不同特点的区域,根据诊断结果,制定个性化的治疗方案,对不同特点的肿瘤组织进行相应的治疗。因此,利用配位原理构建诊疗一体化配位聚合物,将诊断用造影剂和治疗用药物有机结合于一体,可为肿瘤的个性化诊治及精准治疗提供新的思路和方法[62-63]。
Horcajada等[64]报道了一种由Fe(Ⅲ)与富含羧基的小分子构成的金属-有机框架,这种材料具有生物相容性、生物可降解等优点,在药物递送方面是非常有潜力的纳米载体。该纳米金属-有机框架不仅能够包载亲水性的叠氮胸苷、西多福韦,还能够包载疏水性的阿霉素、布洛芬等药物以及两亲性的白消安、咖啡因等,表现出优异的载药特性。除此之外,该金属-有机框架还具有基于Fe(Ⅲ)的磁共振成像性能,是非常优异的造影剂。因此,该金属-有机框架可用作磁共振成像与化疗联合治疗。
另外,将多模式成像与治疗相结合能够得到更精确的诊断信息,并指导精准治疗。Lu等[65]报道了一种由聚乙烯吡咯烷酮(PVP)、具有磁性的Gd(Ⅲ)离子以及含羧基的磷光铱(Ir)构成的水溶性配位聚合物(Ir-Gd),如图4所示。Ir-Gd配位聚合物在生理条件中显示出良好的稳定性,并且具有很低的细胞毒性。Ir-Gd配位聚合物在可见光区存在吸收,在560 nm波长激发下显示红色的磷光,因此可以用作活细胞的光学探针。Ir-Gd配位聚合物具有较高的纵向弛豫效率,可用于T1加权磁共振成像。此外,由于铱的重原子效应,用激光照射时产生单线态氧,促使Ir-Gd配位聚合在光动力治疗中的应用。因此,Ir-Gd配位聚合物可用作多模式成像介导的光动力治疗。
总而言之,利用配位聚合物构建诊疗一体化体系,将诊断与治疗有机的结合为一体,能够得到更精准的诊断结果并且同时进行治疗。
4 总结和展望
近年来,配位聚合物化学、纳米科技和材料学的发展日新月异,为制备具有特定结构以及预期功能的配位聚合物材料提供了科学的理论依据,同时也为药物的包载与递送、生物成像、诊疗一体化等相关领域提供了新的思路和理念。虽然配位聚合物在生物医学上的研究还处在早期阶段,但是由于配位聚合物结构和功能的多样性,已表现出巨大的应用潜力。
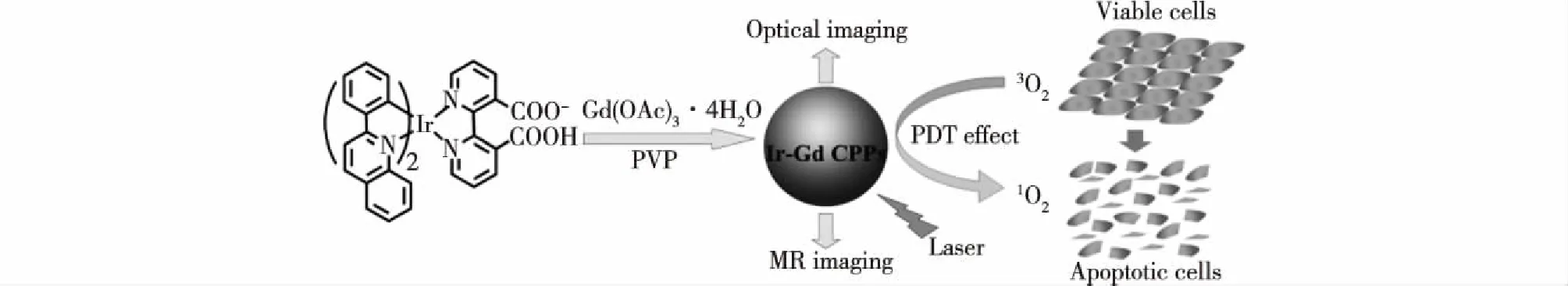
图4 Ir-Gd配位聚合的合成及应用示意图[65]Fig.4 Synthesis and theranostic applications of Ir-Gd[65]
然而配位聚合物在生物医学上的应用仍有一些问题有待解决。首先,活性成分的体外释放机制、体内药代动力学等不是十分清楚,因此,加强对体外释放机制、体内药代动力学的研究,以便更好地控制活性成分的释放及体内过程;其次,制备稳定的单分散配位聚合物溶液仍存在许多困难,在目前的研究中,一般通过调节金属离子、配体的性质或者表面改性的方法改善这一问题,但是仍需要进一步提高。相信随着配位聚合物理论与应用研究的进一步深入,以上问题均能够被解决,从而使其在生物医学领域发挥出更好的效果。

