甜菊单倍体的离体诱导初探
杨永恒,张永侠,徐晓洋,孙玉明,张 婷,原海燕,黄苏珍
(江苏省中国科学院植物研究所,江苏南京210014)
单倍体 (Haploid)是指含有配子染色体数目的个体。对单倍体进行加倍可在一个世代内获得遗传上100%纯合的双单倍体(Doubled haploid,DH),双单倍体不存在等位基因位点的显隐性作用,隐性基因控制的性状能够获得充分体现,因此可极大降低筛选育种材料时的误选概率[1]。此外,单倍体和双单倍体还可为突变体筛选、转基因研究、基因功能鉴定、遗传群体构建、细胞学研究等提供理想材料。单倍体作为重要的遗传材料和研究对象,是当前植物研究领域的一大热点[2]。
甜菊(Stevia rebaudiana Bertoni)又名甜叶菊,为原产南美洲的菊科多年生草本植物。其植物体(主要是叶片)独有的甜菊糖苷(Steviol glycosides)因具有高甜度、低热量的特性[3]和降血糖[4-5]、降血压[6-8]等药用价值而备受关注。我国自1976年引种甜菊以来就开始了全国范围的推广种植,目前已经成为世界第一的甜菊种植大国和甜菊糖苷原料出口大国[9]。随着甜菊产业的发展,甜菊遗传育种研究越显得重要和迫切。由于进行甜菊单倍体培养有助于快速纯化育种材料,加快育种进程,克服其自交不亲和障碍,提高育种效率,因此人工诱导甜菊单倍体发生势在必行。但目前相关研究很少,仅有Flachsland等1996年通过甜菊花药培养获得再生植株的报道,且其细胞学分析发现再生植株均为二倍体(2n=22)[10],而通过未受精胚珠进行雌核发育诱导的研究尚无报道。为此,本研究对甜菊花药和未受精胚珠分别进行离体培养诱导单倍体,以期获得单倍体植株,为甜菊育种及遗传学研究奠定基础。
1 材料与方法
1.1 材料
以本课题组自育的高甜菊苷(Stevioside)和高莱鲍迪苷A(R-A)‘中山6号’为材料。试验材料栽种于江苏省中国科学院植物研究所甜菊种质资源圃,于2015年7—10月甜菊花期采集头状花序作为外植体。
1.2 方法
1.2.1 甜菊花形态及花药发育时期观察 于晴天上午8~12时采集甜菊头状花序,立即置于铺有湿润滤纸的培养皿中送回实验室,4℃冰箱中保存备用。花形态观察:剥取头状花序中小花,观察开花前不同天数的花序外观及其对应小花的形态。花药发育时期观察:从小花中剥取花药,用改良石炭酸品红染色5~8 min后,压片,显微镜观察花药及花粉形态。
1.2.2 花药离体培养 采集适宜大小的甜菊头状花序,置于铺有湿润滤纸的培养皿中送回实验室,4℃低温处理24 h。外植体消毒:头状花序用纱布包裹,于流水下冲洗30 min,沥干水分转移至超净工作台,先用75%乙醇消毒30 s后,0.1%升汞浸泡3~4 min,再用无菌水清洗3~4次,然后将花序放置于铺有无菌滤纸的培养皿中晾干。花药分离与接种:用无菌小镊子剥开头状花序苞片,从花序中拔出花蕾,用解剖针刺破花蕾的花冠顶部,挤出花药。将分离出的单个花药用解剖针接种于培养基表面,培养皿用保鲜膜封口。花药培养:将接种花药的培养皿置于暗处培养,每7天换一次新鲜培养基。形成愈伤组织后进行继代或转移至分化培养基。
1.2.3 未受精胚珠离体培养 花序套袋:甜菊盛花期,选择健壮植株上的花序,用镊子去掉已经开放的小花,用硫酸纸袋将整个花序套住并用回形针封口。花蕾采集:从套袋花序中采集开花前2天至开花后2天的头状花序,置于铺有湿润滤纸的培养皿中,4℃冰箱中保存备用。外植体消毒方法与花药培养相同。
未受精胚珠分离与培养:用无菌小镊子从头状花序中取出花蕾,并根据花蕾形态按开放时间进行分类,再用解剖针轻轻划开子房壁,用针尖剥出胚珠,将分离出的单个胚珠用解剖针接种于培养基表面,不同时期的胚珠分开接种,培养皿用保鲜膜封口,置于25℃培养,每7~10天换一次新鲜培养基。生根:待胚状体萌发后将其移入不含激素的1/2 MS培养基诱导生根。移栽:生根后将幼苗移入无菌营养土,常规养护。
1.2.4 再生植株倍性鉴定 染色体计数法:取2~3 mm的再生植株幼嫩根尖,经卡诺固定液处理过夜,45%乙酸软化后,切取根尖部分用改良石炭酸品红染色5~10 min,覆上盖玻片,然后用镊子轻轻敲片,以便根尖组织散开,在显微镜下观察。选取染色体分散较好的体细胞进行拍照,统计染色体数。
1.2.5 再生植株的性状调查 于2016年2—4月在温室中扦插繁殖亲本‘中山6号’和再生植株‘15-01’、‘15-02’,5月初选植株大小一致的扦插苗同时移栽花盆,每盆1棵,每株系移栽10盆,统一养护管理,观察和测量各植株现蕾期、株高、叶长、叶宽等性状。
1.2.6 数据统计 诱导率(%)=有胚状体发生的外植体数/外植体总数×100。试验数据采用Excel统计分析。

图1 开花前0~5天的甜菊花序和花的形态Fig.1 Morphology of stevia capitulum and flower before 5 days of flowering
2 结果与分析
2.1 甜菊花形态及花粉发育时期观察
甜菊开花当天(0d)至开花前五天(-5d)的头状花序及花形态如图1所示。甜菊一般由5~6朵花聚生为头状花序,外被5枚苞片,管状花冠,具冠毛,下位子房。开花前第5天 (-5d),头状花序长0.6~0.8 cm,苞片紧闭,花浅绿色,长0.05~0.08 cm,子房长度为花冠的 1/6~1/5;开花前第 4 天(-4d),头状花序长 1.0~1.2 cm,苞片闭合,花浅绿色,长0.1~0.15 cm,子房长度为花冠的 1/6~1/5;开花前第 3 天(-3d),头状花序长 1.0~1.2 cm,苞片上端微微张开,花长0.3~0.4 cm,子房长度为花冠的1/6~1/5;开花前第2天(-2d),头状花序长1.0~1.2 cm,苞片张开,花长为0.4~0.6 cm,与冠毛等长,子房长度为花冠的1/3~1/1.8;开花前第1天(-1d),苞片张开,花冠顶部变白,花长0.5~0.7 cm,子房长度为花冠的1/1.8~1/2;开花当天(0d),花冠白色且高于苞片,花长0.8~1.0 cm,子房长度约为花冠的1/2。观察发现同一花序中花发育不一致,开放时间相差1~3 d。
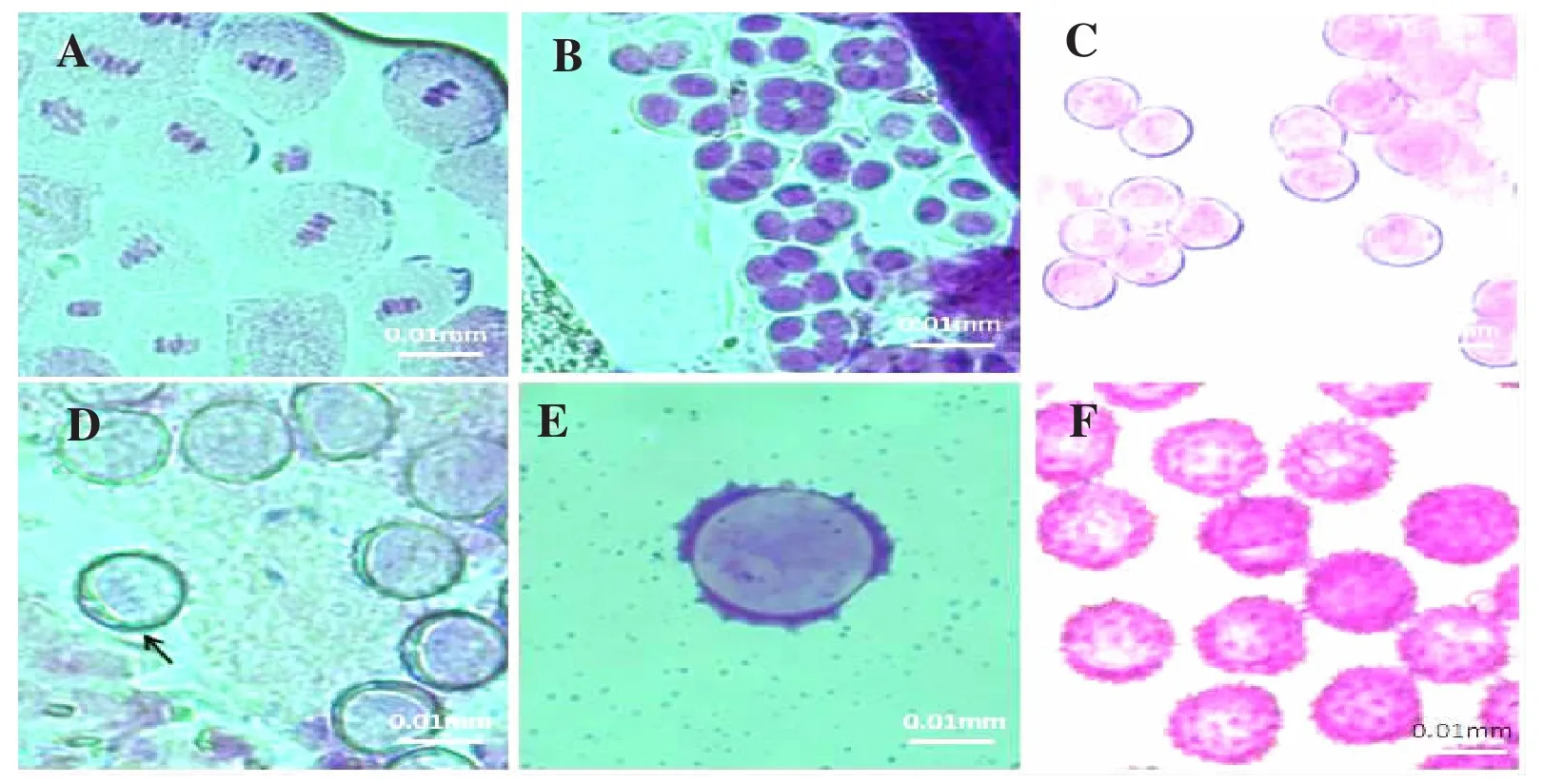
图2 甜菊花粉发育过程Fig.2 The development process of stevia pollen
观察头状花序及花形态的同时分离花药,通过改良石炭酸品红染色压片,显微镜观察小孢子发育时期(图2),结果表明开花前第5天(-5d)花粉母细胞开始进行减数分裂并在同一天内形成四分体和单核小孢子(图 2 A、B、C、D),开花前第 5~4 天(-5~-4d)形成花粉壁(图 2 E),至开花前第 3 天(-3d)就已经形成成熟的花粉粒(图2 F),成熟的甜菊花粉呈圆球形,表面密布刺状纹饰,有3条辐射对称的萌发沟。通过对甜菊花蕾的大小形态和小孢子发育时期的观察发现,开花前第5天头状花序长0.6~0.8 cm,苞片紧闭,花蕾长度约0.08 cm时,其小孢子多数处于四分体时期或单核早期,前人研究认为单核靠边期(图2,D)的花药适于单倍体诱导[11]。因此甜菊花序的外观和花蕾的大小能间接指示小孢子发育的大概时期,可作为花药培养取材时期的判断依据。

表1 甜菊花药诱导单倍体的培养基激素配比Table 1 Concentration of hormone in medium for stevia haploid induction by anthers culture
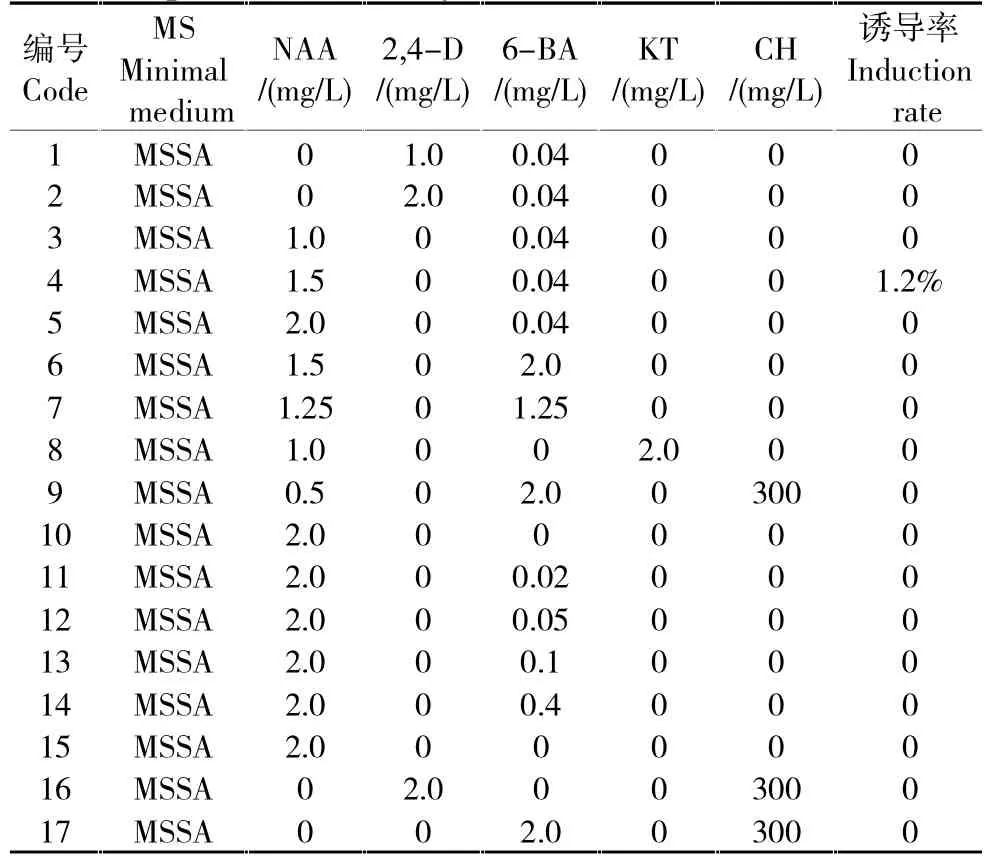
表2 甜菊未受精胚珠诱导单倍体的培养基激素配比Table 2 Concentration of hormone in medium for stevia haploid induction by unfertilized ovules culture
2.2 花药培养诱导单倍体
在花粉观察的基础上选取长度约0.08 cm的花蕾,分离花药进行单倍体诱导。以MS培养基为基础添加6-BA、NAA、KT等植物激素的诱导培养基组合(表1),结果表明花药接种在愈伤诱导培养基(培养基1~17)上7天即可诱导出愈伤,其中MS+1.5 mg/L 6-BA+0.5 mg/L NAA诱导率最高,为80%(图3 B、C),然而转接分化培养基(培养基18~20)后只出现少量绿点,多次转接后褐化死亡,未能诱导分化形成胚状体及植株(图3 D),因此花药愈伤的诱导分化还需进一步研究。

图3 甜菊花药离体培养Fig.3 Stevia anther culture in vitro
2.3 未受精胚珠培养诱导单倍体
分离不同开花时期花蕾的胚珠进行离体培养,配置 MS+0~2.0 mg/L 6-BA+0.5~2.0 mg/L NAA+0~300 mg/L水解酪蛋白 (CH)+4%~10%蔗糖一系列诱导培养基(表 2),每种培养基分别接种各时期胚珠50~100个。结果表明开花当天(0d)的胚珠适于诱导培养,开花前2 d(-2d)和前 1 d(-1d)的胚珠较幼嫩,接种后没有膨大,会变黄并慢慢干瘪,而开花后 1 d(+1d)和 2 d(+2d)的胚珠会快速膨大,但是最终变透明空瘪(表3)。培养基筛选结果表明MS+0.04 mg/L 6-BA+1.5 mg/L NAA+4%蔗糖是最适培养基,可直接诱导出胚状体,诱导率为1.2%。本试验共诱导出胚状体4个,转接不含激素的1/2 MS培养基后2株生根,并移栽存活,但经根尖细胞染色体计数发现均为二倍体(2n=22)(图 4)。
2.4 再生植株的性状调查
观察发现两个再生植株的现蕾期分别比亲本‘中山6号’晚4天和8天,‘15-01’的株高小于亲本,茎节数和分枝较少,茎也较细弱,但其叶片较细长,叶长宽比平均为7.21;而‘15-02’株高高于亲本,但其茎节数和分枝少于亲本,叶片长宽也小于亲本(表4)。两个再生植株根尖染色体计数结果表明其均为二倍体,但形态学上两再生植株相互间,及其与亲本之间差异明显,推测可能是单倍体自然加倍的结果,然而这一推测还有待进一步试验证明。

表3 不同时期对甜菊未受精胚珠单倍体诱导的影响Table 3 Effect of days to bloom on haploid induction by stevia unfertilized ovules culture

图4 甜菊未受精胚珠离体培养Fig.4 Stevia unfertilized ovules culture in vitro
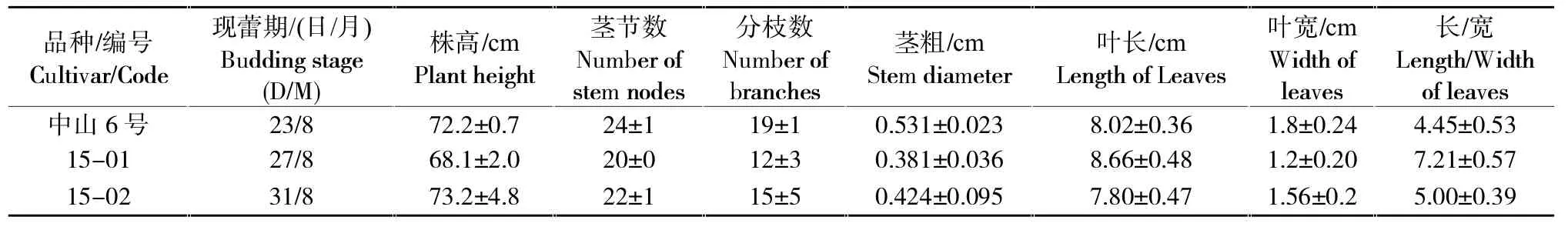
表4 亲本及再生植株的性状统计Table 4 Characters of the parent and two regeneration plants
3 讨论
3.1 花药离体培养诱导单倍体发生
因为甜菊的花和花药极小,处于单核靠边期的花蕾仅0.08 cm,其花药更小,且每个头状花序仅5~6朵花,每朵花仅5枚花药,同一花序中小花发育不一致,使得分离适宜时期的花药难度很大,操作耗时。本试验虽然得到大量愈伤组织,但是未能诱导分化出再生植株。由于花药离体培养诱导单倍体在大麦(Hordeum vulgare L.)[12]、 小麦 (Triticum aestivum L.)[13]、 玉米 (Zea mays L.)[14]、 烟草 (Nicotiana tabacum L.)[15]、 番茄(Lycopeisicvm esculenetum Mill)[16]、辣椒(Capsicum annuum L.)[17]等多种植物中已成功应用,且研究认为影响小孢子单倍体诱导效率的因素主要有:(1)材料基因型及生长状态;(2)小孢子发育时期;(3)可引发小孢子胚发生的预处理;(4)培养基种类及相关添加物。因此,今后通过扩大诱导材料基因型的选择范围,尝试多种预处理方法,以及筛选适宜培养基和添加物等,有望摸索出甜菊花药诱导单倍体的方法。
3.2 未受精胚珠离体培养诱导单倍体发生
植物离体雌核发育最初主要是未授粉胚珠或子房的培养,但近年来有越来越多的研究者通过培养花蕾甚至花序来获得雌性单倍体,目前离体雌核发育应用得最成功的植物是甜菜(Beta vulgaris L.),其次是洋葱(Allium cepa L.)、非洲菊(Gerbera jamesonii Bolus)、烟草等[18]。甜菊中尚未有相关报道,本研究中通过对甜菊未受精胚珠进行离体培养仅诱导出4个胚状体,最终得到两个再生植株且均为二倍体。由于离体诱导雌性单倍体的效果受到供体植株的基因型、生理状态、胚囊发育时期、材料预处理,培养基、培养方式、培养条件等一系列因素的影响[18],因此想在甜菊中通过雌核成功诱导单倍体仍需要大量试验摸索。
3.3 单倍体培养再生植株的自然加倍
本研究中利用甜菊未受精胚珠离体培养获得两个再生植株,经根尖染色体计数发现均为二倍体。以往的研究发现,通过单倍体培养获得的再生植株多是一个由单倍体、二倍体及多倍体构成的混杂群体,且非单倍体率在不同作物以及不同基因型间存在显著差异。温鑫等接种74200个‘嘎啦’苹果(Malus pumila‘Gala’)花药,最终成功诱导形成386个胚状体,经分化培养获得64株再生苗,移栽获得30个成活再生株系,其中包括28个二倍体株系,1个单倍体株系和1个四倍体株系[19]。王丽花等对23个非洲菊花药培养再生植株的倍性进行分析,结果21.7%为二倍体,43.5%为单倍体,34.8%为混倍体[20]。由于两再生植株的现蕾期、株高、茎粗、叶形等性状与亲本差异明显,推测可能是单倍体自然加倍的结果。染色体自然加倍现象在植物单倍体培养中广泛存在,Zhang和Takahata 2001年报道了45个大白菜基因型的小孢子再生植物的自然加倍情况,其中95%的基因型自然加倍率超过50%[21]。Chatelet等在花椰菜的小孢子培养研究中发现27个基因型的自发二倍体率均在55%以上[22]。染色体自然加倍现象同样也发生在大孢子单倍体诱导研究中,李伟通过西葫芦未受精子房离体培养获得再生植株,其中二倍体植株占被检测植株的60%[23]。尽管单倍体自然加倍现象普遍存在,但其机理尚不完全清楚,主要有核内复制、细胞核融合、核内有丝分裂等假说[24]。

