辣椒花药开放式培养及不同基因型对花药培养的影响
杨博智,周书栋,董亚静,刘荣云,欧立军,刘 峰,郑井元,马艳青*
(1.湖南省农业科学院蔬菜研究所,湖南 长沙 410125; 2.湖南湘研种业有限公司,湖南 长沙 410100)
辣椒(Capsicum annuumL.)是一种重要的蔬菜作物,适应性很强,广泛栽培于世界各地。近年来,我国辣椒产业发展迅速,辣椒种植面积基本稳定在150万~200万hm2,居蔬菜种植首位[1]。创制优异种质资源是选育辣椒新品种的重要基础,而花药培养是创新种质资源的一种重要手段,不仅能缩短常规杂交育种所需的年限,提高选种效率,而且还能充分表现各种配子组合的基因型类型,在育种和基因工程研究中都具有很大的潜力。辣椒花药培养研究开始较早,采用花药培养获得单倍体植株的报道较多[2-6]。我国应用花药培养技术选育出的海花系列花药培养辣椒品种已应用推广。
对辣椒花药进行培养时,用于单倍体培养的花蕾的花萼与花瓣齐平(此时小孢子处于单核靠边期),常规灭菌方式无法对花萼与花瓣间隙中的细菌彻底灭菌,接种后花药染菌率仍然居高不下;特别是中国南方地区,由于夏季高温多雨,各种菌类大量滋生,虽然此时的辣椒花药最适宜诱导胚状体产生,但过高的污染率导致了花药培养效率变低。常规辣椒花药接种方法是在超净工作台上进行,用尖头镊子挑开灭菌后的花蕾,夹取花药接种至培养基中。辣椒花药较小(花药宽1 mm左右),镊子夹取花药易夹伤或夹死花药,且该方法耗时长,所需人工成本高。另外,基因型特异性强也是限制花药培养技术在辣椒遗传改良中广泛应用的因素[7-9]。
本研究通过改进花蕾灭菌和花药接种方式,以及往培养基中添加抑菌剂,简化了花药培养技术流程,既能提高花药培养操作效率,又有效降低了花药染菌率;同时,采用该方法比较23个辣椒品种进行的花药培养效果,筛选出高再生频率的辣椒品种,以期为提高辣椒花药培养效率,加快辣椒花药培养技术的实用化奠定基础。
1 材料和方法
1.1 试验材料
辣椒品种为博辣红牛、博辣5号、博辣8号、博辣红艳、博辣瑞美、基地火辣、金线王、博辣红星、兴蔬绿剑、H15、215、博辣天星、新粗条椒、绿金线、春研13号、37-74、908、福湘锦绣、福湘佳玉、恒丰圣美、辣八螺丝王、久保田、新优早王,均由湖南省蔬菜研究所提供。
1.2 试验方法
1.2.1 辣椒花药培养的方法探讨
1.2.1.1 花蕾灭菌 于博辣红牛现蕾期,采集花萼与花瓣齐平或花萼微露出花瓣的花蕾,放入自封口袋。置于4 ℃冰箱中低温预处理 48 h。取出花蕾,分成2份,一份直接用于灭菌,另一份用尖头镊子绕离花蕾顶端约3/4处轻轻划圈,剥去花蕾顶部的花萼,露出青绿色花瓣,再灭菌。灭菌方式为将花蕾置于50%的84灭菌液中灭菌10 min,再用无菌水冲洗2~3次。花药接种采取用镊子夹取的常规方法。接种14 d后统计花药染菌率和死亡率,确定最佳灭菌方式。
1.2.1.2 花药接种 对剥去3/4花萼再用50%的84灭菌液消毒10 min的花蕾,采用2种方式接种花药。处理组用浸泡在75%酒精中的镊子尖微微挑开花瓣,再徒手轻轻挤压花瓣,使花药自然脱落于培养基表面;对照组采用镊子直接夹取花药接种至培养基表面。接种14 d后统计花药染菌率、死亡率,确定最佳灭菌方式。
1.2.1.3 抑菌剂种类和浓度选择 选择两性霉素B和氨苄青霉素作为抑菌剂。两性霉素B和氨苄青霉素浓度处理见表1。将博辣红牛花药分别接种至添加0.5 mg/L KT、2.5 mg/L NAA、不同种类和浓度抑菌剂的NTH培养基中,置于恒温培养箱中(35.0±0.5)℃黑暗培养 8 d,再转入培养室(25.0±0.5)℃暗培养至有白色胚状体产生。培养8 d后观察花药染菌率和死亡率,并将未染菌的花药重新接种至上述培养基中继续培养;培养30 d后,观察愈伤组织、胚状体诱导情况。筛选合适的抑菌剂及其适宜浓度。
1.2.2 花药培养技术在不同辣椒品种中的应用
取不同基因型辣椒品种(23个)花蕾,并采用优化后的灭菌方式进行灭菌,再将其接种至添加最佳抑菌剂浓度的培养基中,培养30 d后,观察花药褐化及愈伤组织、胚状体诱导情况。筛选出高再生频率的辣椒品种。
1.3 数据处理
统计指标及计算公式为:花药染菌率=染菌的花药数目/接种的花药数目×100%;花药褐化率=褐化的花药数目/接种的花药数目×100%;死亡率=死亡的花药数目/接种的花药数目×100%;愈伤组织诱导率=产生愈伤组织的花药数目/接种的花药数目×100%;胚状体诱导率=产生胚状体的花药数目/接种的花药数目×100%。
所有试验处理重复3次,结果取其平均值。数据采用Excel软件做图,SPSS16.0软件分析显著性差异。
2 结果与分析
2.1 辣椒花药培养方法探析
2.1.1 两种花蕾灭菌方式比较
由表2可知,对剥去3/4花萼的花蕾灭菌时更易杀死花蕾表面细菌和内生菌。接种14 d后发现,与不剥去花萼相比,剥去3/4花萼处理中花药染菌率显著降低,降幅为66.48%;花药褐化率和花药死亡率增加,但差异不显著。由此可知,采用剥去3/4花萼的花蕾进行灭菌是合适的处理方式。
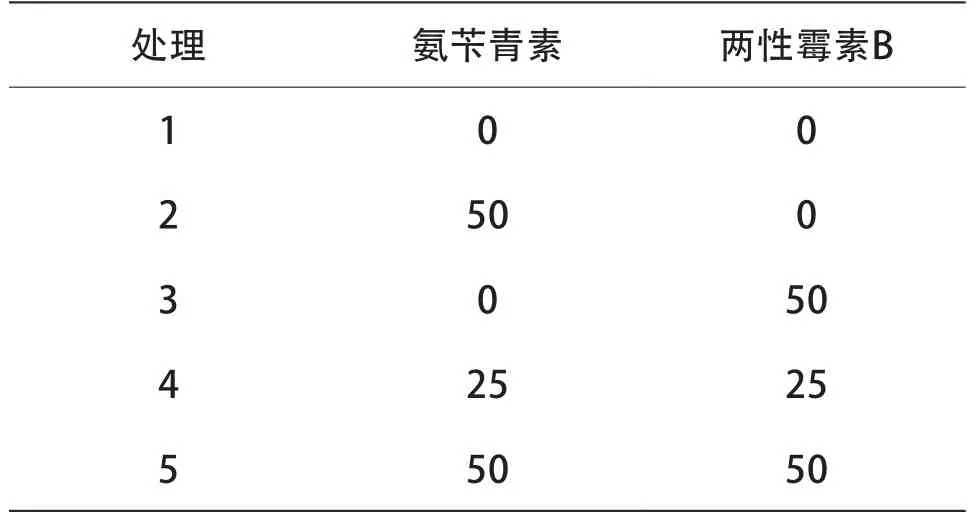
表1 抑菌剂种类及浓度处理mg/L

表2 花蕾灭菌处理对博辣红牛花药染菌率、褐化率及死亡率的影响%
2.1.2 两种花药接种方式比较
由表3可知,与镊子夹取花药相比,徒手挤压对花药伤害小。接种14 d后观察,徒手挤压花药处理,花药死亡率和愈伤组织诱导率极显著低于镊子夹取处理,其降幅分别达80.36%、80.04%,说明镊子夹取花药易夹死或夹伤花药,导致花药产生愈伤组织或死亡,而徒手挤压花药则可降低对花药的伤害;褐化率降低,但与镊子夹取处理差异不显著;花蕾接种速度为镊子夹取处理的2.18倍,说明徒手挤压花药省时、省工,可有效降低人工成本。
2.1.3 抑菌剂种类和浓度对花药培养的影响
由表4可知,氨苄青霉素和两性霉素B均可显著降低花药染菌率。2种抑菌剂合用比单独使用一种抑菌剂效果更佳;高浓度抑菌剂虽然可以有效降低花药染菌率,但也同时显著提高了花药死亡率、愈伤组织诱导率,抑制了胚状体的诱导。往培养基中同时添加25 mg/L的氨苄青霉素和25 mg/L的两性霉素B,培养8 d后观察到花药染菌率为1.42%,死亡率为3.89%;培养30 d后,愈伤组织诱导率为13.51%,胚状体诱导率为3.87%,由此说明,25 mg/L的氨苄青霉素和25 mg/L的两性霉素B适宜于辣椒花药培养。
2.2 花药培养技术在不同基因型辣椒品种中的应用效果
由图1可知,花药培养时,花药受损易产生愈伤组织(图1A),胚状体诱导受抑制。观察到的胚状体包括子叶形胚和畸形胚(球形胚、含根毛的胚)2种类型。子叶形胚(图1G)可直接分化成苗,而球形胚、畸形胚状体继续培养虽可以生根,但因缺乏生长点而无法成苗(图1B、C、D、 E、F)。

表3 两种接种方式对博辣红牛花药培养及花蕾接种速度的影响
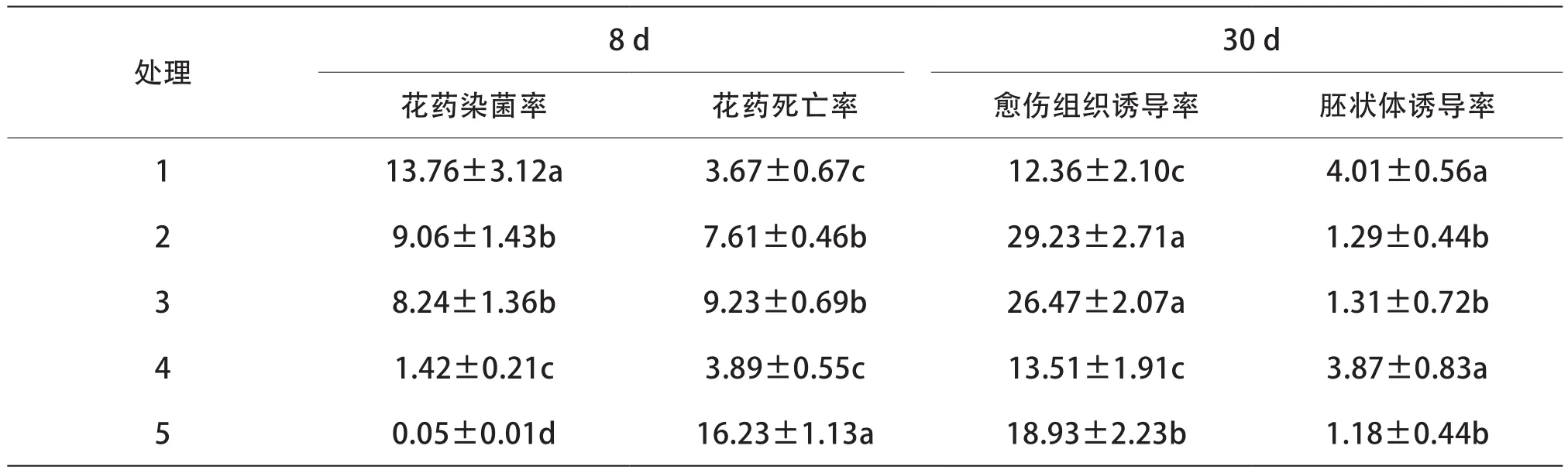
表4 氨苄青霉素和两性霉素B处理对博辣红牛花药培养的影响%

图1 花药培养胚状体情况
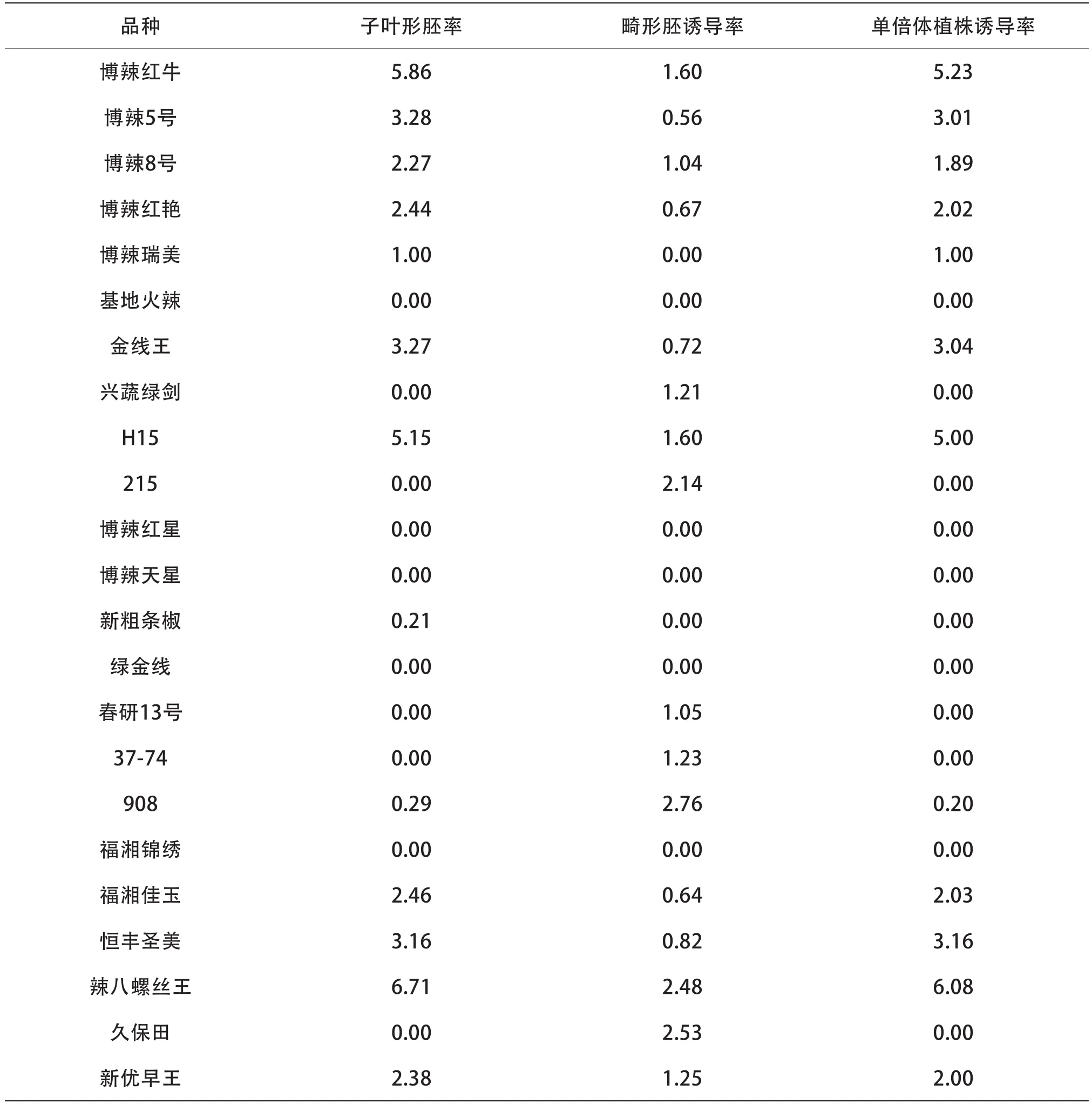
表4 不同基因型辣椒品种花药胚状体和单倍体植株诱导情况%
由表4可知,基因型不同,花药胚诱导率均存在差异。23个基因型中,子叶形胚状体诱导率在0.00%~6.71%,畸形胚状体为0.00%~2.76%。11个辣椒品种能够同时产生子叶形胚状体和畸形胚状体,5个辣椒品种仅能产生畸形胚。其中博辣红牛、H15、辣八螺丝王的花药的子叶形胚状体诱导率大于5%,满足种质创新条件。
3 结论与讨论
目前,大多辣椒花药培养文献报道均采用花蕾直接灭菌,由于花萼与花瓣间隙中的细菌难以彻底杀死,接种后花药染菌率仍然居高不下。本试验剥去花蕾3/4的萼片再进行灭菌,花药染菌率降低至5%以下,说明该方法更易杀死花蕾表面细菌和内生菌,具有可行性。
常规的花药培养基需要高压灭菌,接种需要在超净工作台中用镊子夹取花药转至培养基表面。该方法需要特定的试验环境,且由于辣椒花药小,接种花药费时费工,难以进行规模化生产。其他植物进行组织培养时,研究者们提出了一种新的组织培养方法,即通过往培养基中添加抑菌剂,使植物组织培养脱离严格无菌的操作环境进行组织培养的一种方法,称之为开放式组织培养[10-11]。目前,已广泛应用于葡萄、香蕉、烟草等植物的组织培养中[12-14]。在开放组织培养过程中,添加了抑菌剂的培养基不需要在高温高压下进行灭菌,接种外植体也不需要在超洁净的工作台上进行;因此,该方法从根本上简化了组织培养环节,降低了成本。
本研究中,选择氨苄青霉素和两性霉素B作为抑菌剂,用于在开放条件下博辣红牛花药培养。结果显示,25 mg/L的氨苄青霉素和25 mg/L的两性霉素B适宜用于辣椒花药培养,花药染菌率1.42%,死亡率为3.89%,愈伤组织诱导率为13.51%,胚状体诱导率为3.87%,由此说明,25 mg/L的氨苄青霉素和25 mg/L的两性霉素B适宜于用做开放式培养抑菌剂。此外,还改进了花药接种方式,试验结果表明:徒手挤压花药可降低对花药的伤害,花药接种速度与传统方法相比可提高2.18倍,说明徒手挤压花药省时、省工,可有效降低人工成本。
作物花药胚状体诱导率与基因型密切相关。辣椒花药培养受基因型、生长环境、植株状态、培养基成分等多种因素的影响,基因型是影响辣椒花药培养的重要因素之一[15]。本研究也表明不同基因型间花药胚状体诱导率存在差异,且从23个基因型品种中筛选到了3个高诱导频率的辣椒品种,其胚状体诱导率大于5%,可满足种质创新条件。

