EGCG对Ro52介导的THP-1细胞凋亡及炎症因子的影响
张懿,刘畅
(1.锦州医科大学,辽宁 锦州 121000;2.锦州医科大学附属第一医院内分泌科,辽宁 锦州121000)
系统性红斑狼疮(systemic lupus erythematous,SLE)累及多系统、多器官,发病机制复杂[1-2]。茶多酚活性成分表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)对狼疮性肾炎的调控作用显著[3-4]。SSA/Ro52(Ro52)是SLE的关键调控靶点[5-9],其调控机制可能与单核-巨噬细胞凋亡和炎症反应密切相关[10-13]。EGCG能显著抑制正常体细胞中Ro52的表达[14]。然而,单核-巨噬细胞中EGCG与Ro52的功能和调控关系并不清楚。本研究旨在探索不同浓度EGCG对Ro52介导的单核-巨噬细胞THP-1凋亡及炎症反应的调控效应,为SLE发病机制的研究提供新思路。
1 材料与方法
1.1 主要材料与试剂
1.1.1 主要材料 人单核-巨噬细胞THP-1(中国科学院上海微生物所菌种保藏中心),Ro52过表达质粒(pCMV-Ro52)(北京Biovector公司)。
1.1.2 主要试剂及仪器 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素 -1β(Interleukin-1β, IL-1β)、IL-13检测试剂盒购自美国Trevigen公司,M-MLV逆转录酶(美国Clontech公司),SYBR Green Master Mix(美国 Life Technologies公司),BCA蛋白检测试剂盒、anti-Ro52、anti-甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、辣根过氧化酶二抗购自美国Santa Cruz Biotechnology公司,RPMI 1640培养基(美国Abcam公司),膜联蛋白-荧光素异硫氰酸酯(Annexin V-fluorescein isothiocyanate, AV-FITC)(美国 BD Pharmingen 公司),碘化丙啶(propidium iodide, PI)(美国Sigma公司),Trizol试剂盒(美国Invitrogen公司),逆转录试剂盒(德国Fermentas公司),聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)(美国Millipore公司),酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)试剂盒(美国Santa Cruz公司)Image-Pro Plus 6软件(美国 Media Cybernetics公司),BD FACSCalibur™系统(美国BD公司),Beckman CXP软件(美国Brea公司)。
1.2 人单核-巨噬细胞THP-1的培养与分组
1.2.1 人单核-巨噬细胞THP-1的培养 在37℃、5%二氧化碳CO2条件下,用含10% FBS和1%青-链霉素的RPMI 1640培养基培养人单核-巨噬细胞THP-1。细胞2 d或3 d换液1次,细胞融合率达80%时,进行传代,将细胞浓度调整为1.0×106个/ml用于后续实验。
1.2.2 细胞分组 正常培养的THP-1细胞为对照组,20μg pCMV-Ro52为 pCMV-Ro52组,20μg pCMVNC为pCMV-NC组[15],以及Ro52过表达48 h后继续使用0、5、10、20和50 mg/L EGCG处理24 h的0、5、10、20 和 50 mg/L EGCG 组[16]。
1.3 Ro52过表达质粒的构建与细胞转染
采用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)对人源Ro52的cDNA(NM_003141.3)进行扩增,并且将产物插入pCMV质粒,进行转染效率优化筛选。将浓度为1.0×106个/ml的THP-1细胞转入24孔板中培养,参考谢军等[17]的研究,使用pCMV-NC质粒或者pCMV-Ro52分别对THP-1细胞进行转染。48 h后采用qRT-PCR进行扩增。Ro52正向引物:5’-AGAGAGACTTCACCTGTTCTGT-3’,反向引物:5’-TCAGTTCCCCTAATGCCACCT-3’。采用 Western blot检测THP-1细胞中Ro52的表达。
1.4 qRT-PCR
参照qRT-PCR试剂盒说明书抽提细胞总RNA,采用Trizol试剂盒和逆转录试剂盒将5.0μg RNA作为模板合成cDNA,用SYBR Green Master Mix进行基因表达的实时分析。反应条件:95℃变性5 min,95℃延伸5 s,60℃退火1 min,共40个循环。采用2-ΔΔCt法计算mRNA的相对表达量,每组数据以倍数变化进行展示。GAPDH用于qRT-PCR结果的标准化处理。
1.5 Western blot检测
收集各处理组细胞进行裂解,并抽提总蛋白质。采用12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离不同大小的蛋白质,用聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)进行湿法转膜。用3%脱脂牛奶对转膜完成的PVDF膜室温封闭1.5 h,PBS洗涤3次,5 min/次,采用一抗包括goat源性的Ro52(1∶900)和GAPDH(1∶2 000)4℃孵育过夜。洗去一抗,在室温条件下用辣根过氧化酶二抗(1∶18 000)孵育1.5~2.0 h,洗涤抗体液。采用增强化学发光法显影。Western blot检测结果用Image-Pro Plus 6软件进行图像分析。
1.6 细胞凋亡实验
收集各组细胞,采用BD FACSCalibur™系统、AV-FITC及PI试剂盒,依据试剂盒说明书进行细胞凋亡检测。主要步骤为:不同处理条件下的细胞以1.0×106个/ml的密度悬浮于100 ml结合缓冲液,将细胞用AV-FITC和PI孵育15 min,在FC-500流式细胞仪上使用Beckman CXP软件进行分析。
1.7 ELISA
收集各组细胞,将细胞悬液6 070 r/min离心15 min。将上清液收集并储存于80℃,用于炎症因子分析。根据试剂盒说明书进行操作,炎症因子TNF-α、IL-1β、IL-13采用ELISA试剂盒进行检测。
1.8 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ro52过表达效果
2.1.1 Ro52 mRNA 检测pCMV-Ro52转染48 h后对Ro52 mRNA和蛋白表达的影响。对照组、pCMV-NC组、pCMV-Ro52组Ro52 mRNA相 对 表达 量 分 别 为(0.988±0.021)、(1.003±0.029) 和(2.558±0.418),经方差分析,差异有统计学意义(F=8.543,P=0.000)。进一步两两比较经LSD-t检验,pCMV-Ro52组Ro52 mRNA表达水平较对照组升高(P<0.05);而pCMV-NC组与对照组比较,差异无统计学意义(P>0.05);与pCMV-NC组相比,pCMVRo52组Ro52 mRNA表达水平升高(P<0.05)。
2.1.2 Ro52蛋白 对照组、pCMV-NC组、pCMVRo52组Ro52蛋白相对表达量分别为(0.989±0.021)、(1.000±0.065)和(2.291±0.815),经方差分析,差异有统计学意义(F=62.134,P=0.000)。进一步两两比较经LSD-t检验,pCMV-Ro52组Ro52蛋白表达水平较对照组升高(P<0.05);而pCMV-NC组与对照组比较,差异无统计学意义(P>0.05);与pCMVNC组相比,pCMV-Ro52组Ro52蛋白表达水平升高(P<0.05)。结果表明,pCMV-Ro52转染THP-1细胞48 h可上调Ro52的表达。见图1。
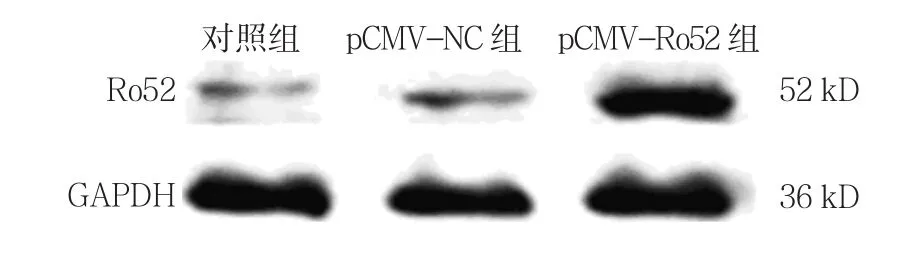
图1 各组Ro52蛋白的表达
2.2 Ro52过表达对THP-1细胞凋亡的影响
Ro52过表达质粒pCMV-Ro52转染细胞48 h后检测其对THP-1细胞凋亡比例的影响。对照组、pCMV-NC组、pCMV-Ro52组THP-1细胞凋亡率分 别 为(2.401±1.030)%、(2.532±0.512)% 和(10.337±0.987)%,经方差分析,差异有统计学意义(F=62.134,P=0.000)。进一步两两比较经LSD-t检验,pCMV-Ro52组THP-1细胞凋亡率较对照组升高(P<0.05);而pCMV-NC组与对照组比较,差异无统计学意义(P>0.05);与pCMV-NC组相比,pCMVRo52组THP-1细胞凋亡率升高(P<0.05)。结果表明,pCMV-Ro52转染THP-1细胞48h可上调THP-1细胞凋亡率。见图2。
2.3 Ro52过表达对THP-1细胞炎症因子水平的影响
Ro52过表达质粒pCMV-Ro52转染细胞48 h后对照组、pCMV-NC组、pCMV-Ro52组TNF-α、IL-1β、IL-13水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,pCMV-Ro52组 TNF-α、IL-1β、IL-13水 平较对照组升高(P<0.05);pCMV-NC组与对照组TNF-α、IL-1β、IL-13水平比较,差异无统计学意义(P>0.05);与pCMV-NC组相比,pCMV-Ro52组 TNF-α、IL-1β、IL-13水 平 升 高(P<0.05)。结果表明,pCMV-Ro52转染THP-1细胞48 h可上调THP-1细胞分泌的炎症因子TNF-α、IL-1β与IL-13。见表1。

图2 Ro52过表达对THP-1细胞凋亡的影响
表1 各组炎症因子水平的变化 (ng/ml,±s)
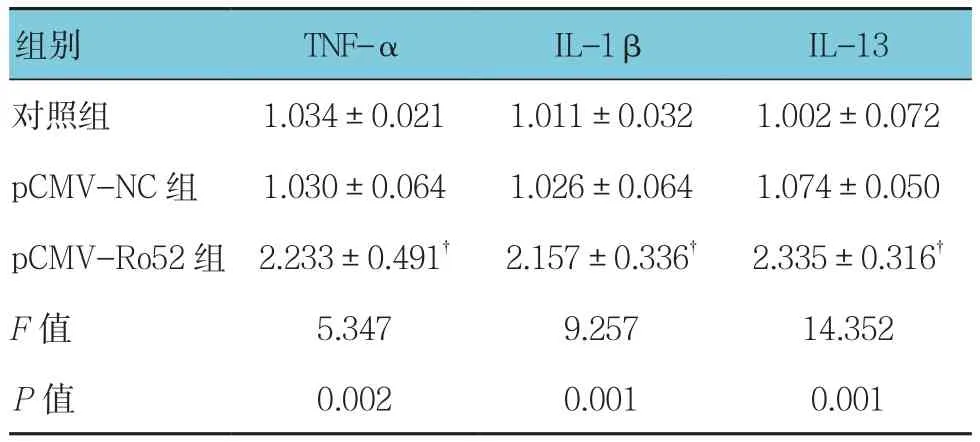
表1 各组炎症因子水平的变化 (ng/ml,±s)
注:†与对照组、pCMV-NC组比较,P <0.05
组别 TNF-α IL-1β IL-13对照组 1.034±0.021 1.011±0.032 1.002±0.072 pCMV-NC 组 1.030±0.064 1.026±0.064 1.074±0.050 pCMV-Ro52组 2.233±0.491† 2.157±0.336† 2.335±0.316†F值 5.347 9.257 14.352 P值 0.002 0.001 0.001
2.4 EGCG抑制Ro52的过表达
使用0、5、10、20和50 mg/L EGCG处理过表达Ro52的细胞24 h,对照组,以及0、5、10、20和50 mg/L EGCG组Ro52蛋白相对表达量分别为(0.974±0.069)、(2.425±0.562)、(2.032±0.683)、(1.907±0.637)、(1.715±0.367)、(1.308±0.102),经方差分析,差异有统计学意义(F=31.342,P=0.000)。进一步两两比较经LSD-t检验,与0 mg/L EGCG组相比,20和50 mg/L EGCG组Ro52蛋白水平降低(P<0.05);0 mg/L EGCG 组 与 10 mg/L EGCG 组 比较,差异无统计学意义(P>0.05);0 mg/L EGCG组与5 mg/L EGCG组比较,差异无统计学意义(P>0.05)。见图3。
2.5 EGCG调控THP-1细胞凋亡
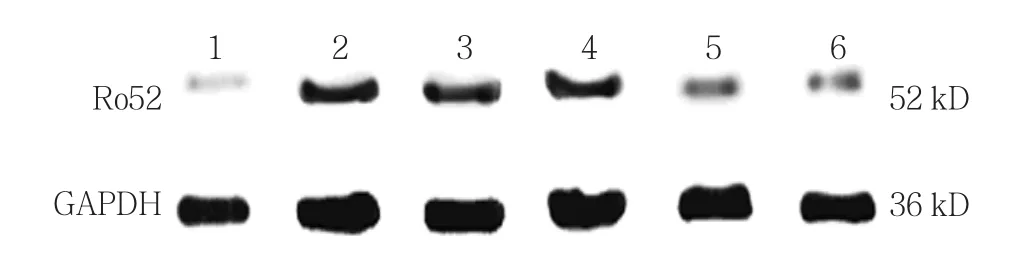
图3 不同浓度EGCG对Ro52蛋白表达的影响
使用不同浓度(0、5、10、20和 50 mg/L)EGCG处理过表达Ro52的THP-1细胞24 h后,对照组,以及0、5、10、20和50 mg/L EGCG组THP-1细胞凋亡率分别为(2.362±0.213)%、(10.380±0.682)%、(10.061±0.123)%、(9.650±0.781)%、(6.352±0.902)%、(5.234±0.321)%,经方差分析,差异有统计学意义(F=82.354,P=0.000)。进一步两两比较经LSD-t检验,与0 mg/L EGCG组相比,20和50 mg/L EGCG组细胞凋亡率降低(P<0.05);0 mg/L EGCG组与10 mg/L EGCG组比较,差异无统计学意义(P>0.05);0 mg/L EGCG组与5 mg/L EGCG组比较,差异无统计学意义(P>0.05)。见图4。
2.6 EGCG阻断Ro52对细胞炎症因子的影响
2.6.1 TNF-α 使用不同浓度(0、5、10、20和 50 mg/L)EGCG处理过表达Ro52的THP-1细胞24 h后,对照组,以及0、5、10、20和50 mg/L EGCG组TNF-α、IL-1β、IL-13水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与0 mg/L EGCG组相比,20和50 mg/LEGCG组TNF-α水平降低(P<0.05);0 mg/L EGCG组与10 mg/L EGCG组比较,差异无统计学意义(P>0.05);0 mg/L EGCG组与5 mg/L EGCG组比较,差异无统计学意义(P>0.05)。见表2。
2.6.2 IL-1β对照组,以及0、5、10、20和50 mg/L EGCG组IL-1β水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与0 mg/L EGCG组相比,20和50 mg/L EGCG组 IL-1β 水平降低(P<0.05);0 mg/L EGCG 组与10 mg/L EGCG组比较,差异无统计学意义(P>0.05);0 mg/L EGCG组与5 mg/L EGCG组比较,差异无统计学意义(P>0.05)。见表2。

图4 EGCG对THP-1细胞凋亡的影响
表2 各组炎症因子水平的变化 (ng/ml,±s)
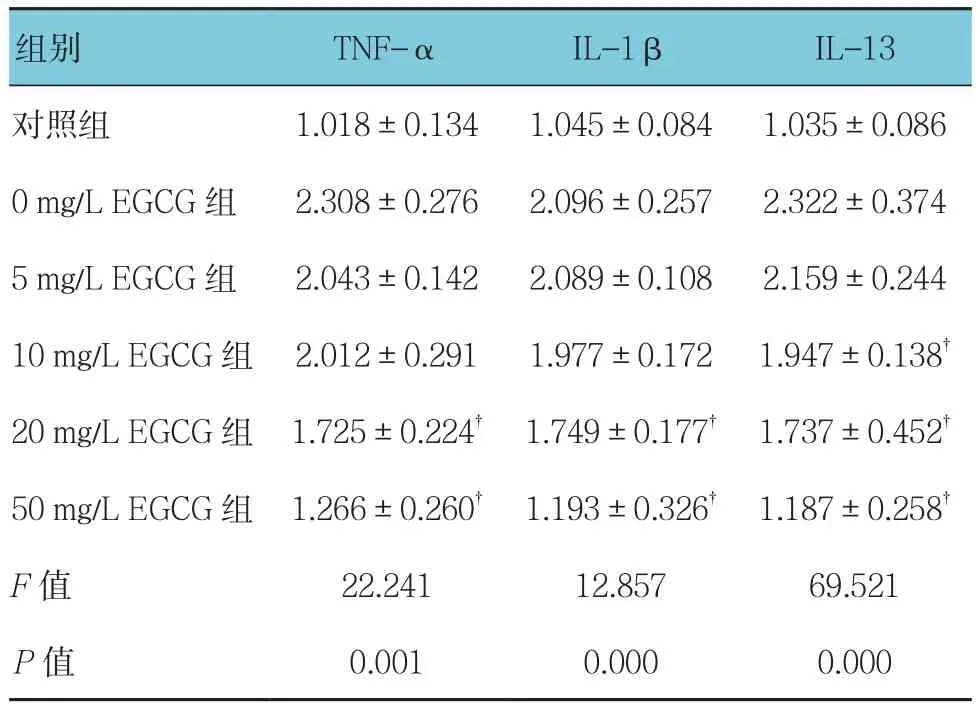
表2 各组炎症因子水平的变化 (ng/ml,±s)
注:†与0 mg/L EGCG组比较,P <0.05
组别 TNF-α IL-1β IL-13对照组 1.018±0.134 1.045±0.084 1.035±0.086 0 mg/L EGCG 组 2.308±0.276 2.096±0.257 2.322±0.374 5 mg/L EGCG 组 2.043±0.142 2.089±0.108 2.159±0.244 10 mg/L EGCG 组 2.012±0.291 1.977±0.172 1.947±0.138†20 mg/L EGCG组 1.725±0.224† 1.749±0.177† 1.737±0.452†50 mg/L EGCG组 1.266±0.260† 1.193±0.326† 1.187±0.258†F值 22.241 12.857 69.521 P值 0.001 0.000 0.000
2.6.3 IL-13 对照组,以及0、5、10、20和50 mg/L EGCG组IL-13水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与0 mg/L EGCG组相比,10、20和50 mg/L EGCG组IL-13水平降低(P<0.05);0 mg/L EGCG组与 5 mg/L EGCG组比较,差异无统计学意义(P>0.05)。见表2。
3 讨论
3.1 Ro52参与单核-巨噬细胞凋亡和破坏正常的炎症因子水平
本研究发现,过表达Ro52既可以促进THP-1细胞凋亡,又可以促进THP-1细胞TNF-α、IL-1β和IL-13的分泌。这说明,Ro52在单核-巨噬细胞的功能紊乱和炎症因子分泌中发挥调控作用。单核-巨噬细胞在SLE的起病过程中发挥重要作用,包括调节炎症反应,诱导免疫应答、清除凋亡细胞等[18],同时还发现巨噬细胞在免疫应答启动过程中是多种细胞因子的重要来源[19]。TABAS等[20]研究表明,SLE相关的并发症,如狼疮肾炎的早期和进展期均可出现大量巨噬细胞的异常凋亡,巨噬细胞本身负责清除凋亡细胞并调节自身生理性正常凋亡,而SLE患者体内的巨噬细胞吞噬功能异常,以及自身免疫疾病中巨噬细胞的自身凋亡调控功能同样显示异常,这暗示巨噬细胞自身异常凋亡可能与SLE密切相关。
董晓薇[9]等研究表明,SLE患者血清中靶抗原Ro52蛋白表达水平显著升高,这可能与SLE患者心血管疾病加剧并伴有单核-巨噬细胞异常凋亡增加,以及细胞炎症因子分泌增加有关。Ro52蛋白是SLE等多种自身免疫性疾病过程中的主要靶点[6-8],可能在调节凋亡和炎症反应过程中扮演重要角色[21]。对SLE心脏受累患者的研究中发现,抗Ro52抗体与胎儿凋亡的心肌细胞表面Ro52抗原结合后激活巨噬细胞[22]。同时发现,Ro52在细胞内免疫过程中发挥重要的凋亡调节作用[10]。BLAKE等[10]研究发现,石棉暴露导致的自身免疫疾病可促进巨噬细胞凋亡,并且凋亡的巨噬细胞表面Ro52表达上调。本研究明确Ro52可以调控单核-巨噬细胞的凋亡及炎症因子TNF-α、IL-1β、IL-13的分泌。结果表明,Ro52作为重要的前凋亡分子在自身免疫疾病的巨噬细胞凋亡和炎症反应过程中起促进作用,而且很有可能是SLE免疫调控的一个重要途径。
3.2 EGCG减缓Ro52对单核-巨噬细胞凋亡和炎症因子水平的调控
EGCG是一种绿茶多酚类分子[3,23],被称为自身免疫性疾病的潜在治疗武器,已经在治疗干燥综合症等疾病、增强免疫系统功能与抑制肿瘤发生等领域中有深入研究[24]。本研究发现,EGCG能够在20和50 mg/L 2个浓度显著减缓Ro52过表达质粒转染THP-1细胞导致的Ro52超高表达,并且可以阻止THP-1细胞被Ro52过表达后导致的细胞凋亡增加。与pCMV-Ro52组相比,细胞炎症因子TNF-α、IL-1β、IL-13水平被EGCG抑制。结果表明,EGCG是一种有效的抗凋亡和抗炎分子,可以减缓阻断Ro52的促细胞凋亡效应和促炎症因子效应。
以往研究同样发现,EGCG能够有效抑制巨噬细胞凋亡,减轻免疫细胞的炎症反应[11,13]。HASHIMOTO等[25]研究发现,抑制EGCG可明显诱导小鼠巨噬细胞样细胞的凋亡。研究发现EGCG对Ro52具有明显的抑制效应[14]。本研究结果发现,EGCG显著抑制Ro52诱发的THP-1细胞凋亡,与上述结果一致。HSU等[14]在研究正常人原发性表皮角质形成细胞与永生化人涎腺腺泡细胞功能时发现,EGCG能够显著抑制Ro52等多种自身抗原的表达。结果表明,Ro52可被EGCG负向调控,并且EGCG可通过抑制Ro52,介导人单核-巨噬细胞的凋亡与炎症反应。
综上所述,Ro52过表达可促进人单核-巨噬细胞THP-1的凋亡与炎症因子TNF-α、IL-1β、IL-13的分泌。EGCG可减弱Ro52介导的THP-1细胞凋亡,减少炎症因子TNF-α、IL-1β、IL-13的分泌。本实验为进一步研究SLE等自身免疫疾病中巨噬细胞的功能、SLE的预防与治疗,以及SLE的发病机制提供实验依据。

