氯沙坦通过AT1R/VEGF信号通路对肝癌血管生成的影响
武荣,张俊涛,李卫斌,王坤,刘志贞
(1.临汾职业技术学院 预防医学教研室,山西 临汾 041000;2.山西医科大学 生物化学与分子生物学教研室,山西 太原 030001;3.山西大医院 普外科,山西 太原 030032;4.山西省太原市第三人民医院 肝病二科,山西 太原 030012)
全世界范围内肝癌的发病率排第6位,死亡率排第3位[1-2]。微血管密度(microvessel density, MVD)被认为是肝癌和其他癌症预后的一个重要指标[3]。AngⅡ 1型受体(angiotensin Ⅱ receptor 1, AT1R)阻抑剂氯沙坦具有抗高血压的作用[4-5]。黑色素瘤[6]、胰腺癌[7]、肾癌[8]和膀胱癌[9]都表达AT1R。实验发现,AT1R拮抗剂可以抑制AT1R表达的肿瘤血管生成,但机制尚不清楚[10]。本实验检测癌细胞和大鼠肝癌组织中AT1R的表达,研究氯沙坦对血管生成的作用,从而证明AT1R为肝癌肿瘤血管生成的有效靶点。
1 材料与方法
1.1 主要试剂
AngⅡ、氯沙坦、Hoechst、蛋白提取试剂盒购自美国Sigma公司,胎牛血清、DMEM、MEM培养基购自美国Gibco公司,AT1R一抗、血管内皮生长因子(vascular endothelial growth factor, VEGF)一抗、CD34一抗购自美国Abcam公司,VEGF ELISA kit(美国Pepro Tech公司)。
1.2 细胞
肝癌细胞系HepG2、HuH-7和PLC/PRF/5,以及正常肝细胞LO2购自中国科学院上海细胞库。
1.3 实验动物
健康雄性SD大鼠24只,体重230~250 g,购自北京维通利华实验动物技术有限公司(合格证:C57B/L-B6D2F1/Crl,302),在动物实验中心无菌培养室内饲养。所做处理均符合郑州大学动物伦理中心制定的章程。
1.4 方法
1.4.1 细胞培养 HepG2和HuH-7培养于10%胎牛血清、1%双抗的DMEM培养液中,PLC/PRF/5和LO2培养于10%胎牛血清、1%双抗MEM培养液中。将其放置于在37℃、5%二氧化碳CO2,相对湿度95%的培养箱中培养。
1.4.2 大鼠肝癌模型的复制 将24只大鼠麻醉,腹腔注射10%水合氯醛,0.1 ml/只。大鼠取仰卧位,将其四肢固定于实验板上,用剪子小心剃去胸腹部毛后擦拭安尔碘消毒,沿腹白线逐层开腹,暴露腹腔,轻压胸腔后,肝脏暴露出腹腔,选取最接近体表的肝叶种植肿瘤。用注射针头斜行进针,刺入肝脏约1 cm,轻推注射器针芯,缓慢注入细胞悬液20μl,约1×106个HepG2细胞,缓慢退针,用无菌棉签轻压片刻后轻送肝脏进入腹腔,逐层关腹。继续饲养大鼠,待成瘤模型复制成功后(皮下结节直径<0.5 cm为成瘤标准),开始给大鼠(其中12只)喂药氯沙坦(5 mg/kg),持续给药2周,处死大鼠,取肝癌组织进行实验。
1.4.3 Western blot检测 将肝癌细胞系HepG2、HuH-7和PLC/PRF/5,以及正常肝细胞LO2培养于75 mm2培养瓶中,待细胞长大约90%时,用细胞刮刀刮下,冰上裂解提取蛋白。将HepG2细胞按1×106个/孔接种于6孔板,待细胞长到对数生长期时,分别添加0、1、10、100和1 000 nmol/L AngⅡ,100 nmol/L AngⅡ+0.1μmol/L氯沙坦,100 nmol/L AngⅡ+1.0μmol/L氯沙坦,1 000 nmol/L AngⅡ+10.0μmol/L氯沙坦,培养24 h。用细胞刮刀刮下细胞,冰上裂解提取蛋白,用二喹啉甲酸法测定每组蛋白质浓度,总蛋白上样量为35μg/孔,上完样后进行12%SDS-PAGE凝胶电泳分离后转膜(80 V,90 min),5%脱脂奶粉封闭2 h,TBST洗膜5 min/次,共5次。分别用一抗 AT1R(1 ∶ 500)、GAPDH(1 ∶ 1 000)4℃过夜,TBST洗膜5 min/次,共5次。用稀释比例为1∶1 000的羊抗兔二抗37℃摇床反应1 h,TBST洗膜5 min/次,共5次。采用ECL试剂盒进行显色,凝胶成像分析系统拍照后,用Lab Works 4.6软件进行灰度值分析。
1.4.4 酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA) 将 HepG2细胞按 1×106个 /孔接种于6孔板,细胞贴壁12 h后,用无血清的DMEM培养12 h,添加100 nmol/L AngⅡ、100 nmol/L AngⅡ+0.1μmol/L氯沙坦、100 nmol/L AngⅡ+1.0μmol/L氯沙坦、1 000nmol/L AngⅡ+10.0μmol/L氯沙坦,培养24 h。吸取培养液于离心管中,3 500 r/min离心10 min,取上清液。VEGF的检测按照VEGF ELISA kit试剂盒说明书进行操作。
1.4.5 免疫组织化学法 取大鼠肝癌组织制成切片,将切片固定于载玻片上干燥处理。将石蜡切片放入二甲苯Ⅰ、Ⅱ中进行脱蜡,然后逐级放置于100%纯酒精Ⅰ、Ⅱ,95%、80%和70%酒精,以及水中各5 min,进行水化。水化后的切片放于3%双氧水 H2O2中室温孵育10 min,PBS洗涤3次。将切片放入柠檬酸缓冲液(0.01 nmol/L,pH 6.0)中,加热至沸腾改中火(>92℃),室温下复温,PBS洗涤3次。吸干多余液体,滴加山羊血清封闭液,37℃孵育30 min。分别滴加AT1R(1 ∶ 300)、VEGF(1 ∶ 800)和 CD34(1 ∶ 600)一抗4℃过夜,取出后在37℃烤箱中复温30 min,PBST洗3次。滴加生物素抗兔二抗,37℃孵育1 min,PBST洗涤3次。用DAB试剂盒显色10 min,显色终止后清洗切片。滴加苏木精室温染液3 min,清水洗掉苏木精染液,盐酸酒精分化1 s,氨水返蓝5 min。将切片分别放入70%和80%酒精各1 min,90%酒精2 min,95%酒精3 min,100%酒精Ⅰ、Ⅱ各3 min。二甲苯Ⅰ、Ⅱ各15 min,取出晾干后用中性树胶封片。每个标本以只滴加PBS液作为阴性对照,在显微镜下观察各切片着色情况。
1.4.6 免疫荧光染色 将盖玻片放到6孔板中,肝癌细胞系HepG2、HuH-7和PLC/PRF/5,以及正常肝细胞LO2均按1×105个/ml接种于6孔板中,待细胞长至80%时,弃上清,PBS洗3次,10 min/次。4%多聚甲醛室温固定细胞20 min,PBS洗3次,添加0.1%Triton X-100细胞打孔,1%胎牛血清白蛋白封闭,加入AT1R(1∶500)抗体4℃过夜,PBS洗3次,加入FITC标记的羊抗鼠二抗和Hoechst,室温孵育1 h,将盖玻片放到载玻片上,荧光显微镜下观察拍照。
1.5 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 AT1R在各细胞系中的表达
荧光显微镜下观察AT1R在肝癌细胞系HepG2、HuH-7和PLC/PRF/5,以及正常肝细胞LO2中的表达,发现AT1R在正常肝细胞LO2中绿色荧光强度低,而在肝癌细胞系HepG2、HuH-7和PLC/PRF/5中绿色荧光强度高,在HepG2细胞中绿色荧光最强,即AT1R在HepG2细胞中表达最高。见图1。

图1 AT1R在各细胞系中的表达 (荧光显微镜×100)
2.2 AT1R蛋白在各细胞系中的表达
为进一步证明荧光显微镜的观察结果,采用Western blot检测AT1R在肝癌细胞系HepG2、HuH-7和PLC/PRF/5,以及正常肝细胞LO2中的表达,其相对表达量分别为(1.00±0.03)、(0.37±0.02)、(0.36±0.02)、(0.11±0.02),经单因素方差分析,差异有统计学意义(F=829.274,P=0.000)。进一步两两比较经LSD-t检验,AT1R在正常肝细胞LO2中低表达,在肝癌细胞系HepG2中高表达(t=1.874,P=0.008),在HuH-7和PLC/PRF/5中高表达(t=1.272和 1.568,P=0.032 和 0.019)。见图2。
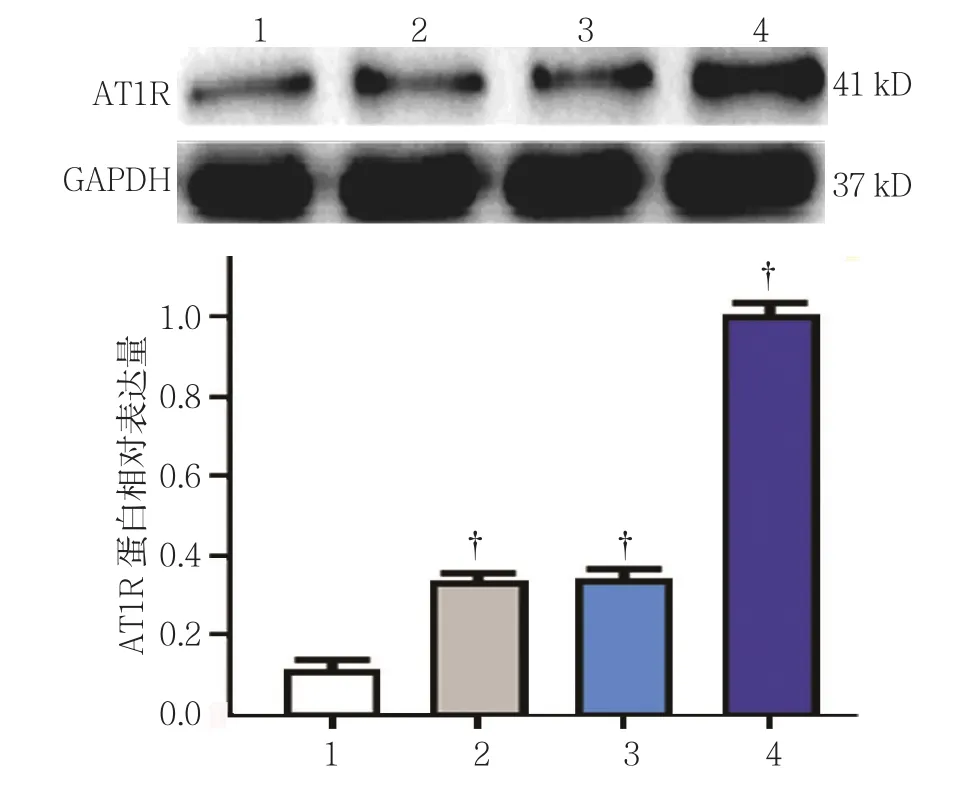
图2 AT1R蛋白在各细胞系中的表达 (±s)
2.3 氯沙坦对肝癌细胞系HepG2中AT1R蛋白表达的影响
上述实验表明AT1R在肝癌细胞系HepG2中表达最高,故进一步用Western blot检测氯沙坦对肝癌细胞系HepG2中AT1R表达的影响。0、1、10、100和1 000 nmol/L AngⅡ浓度组的AT1R蛋白相对表达量分别为(0.10±0.01)、(0.14±0.02)、(0.25±0.03)、(0.36±0.03)、(0.51±0.03),经单因素方差分析,差异有统计学意义(F=131.774,P=0.000)。进一步两两比较经LSD-t检验,0 nmol/L与1 nmol/L AngⅡ比较,差异无统计学意义(t=0.325,P=0.078);与0 nmol/L AngⅡ相比,从10 nmol/L AngⅡ开始,随着AngⅡ浓度增加,AT1R蛋白表达量逐渐升高(t=1.643、3.428和 2.953,P=0.014、0.000 和 0.000)。见图3。
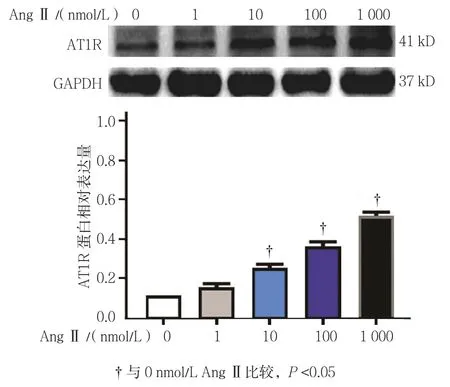
图3 不同浓度AngⅡ对肝癌细胞系HepG2中AT1R蛋白的表达的影响 (±s)
0 nmol/L AngⅡ+0.0μmol/L氯沙坦、100 nmol/L AngⅡ+0.0μmol/L氯沙坦、100 nmol/L AngⅡ+0.1μmol/L氯沙坦、100 nmol/L AngⅡ+1.0μmol/L氯沙坦、1 000 nmol/L AngⅡ+10.0μmol/L氯沙坦组的AT1R 相对表达量分别为(0.21±0.02)、(0.84±0.03)、(0.52±0.02)、(0.31±0.03)、(0.29±0.03),经单因素方差分析,差异有统计学意义(F=281.878,P=0.000)。进一步两两比较经LSD-t检验,与100 nmol/L AngⅡ+0.0μmol/L氯沙坦组相比,随着氯沙坦浓度增加,AT1R蛋白表达水平逐渐降低(t=2.953、4.058和3.194,均P=0.000)。见图4。
2.4 氯沙坦对肝癌细胞系HepG2中VEGF的影响
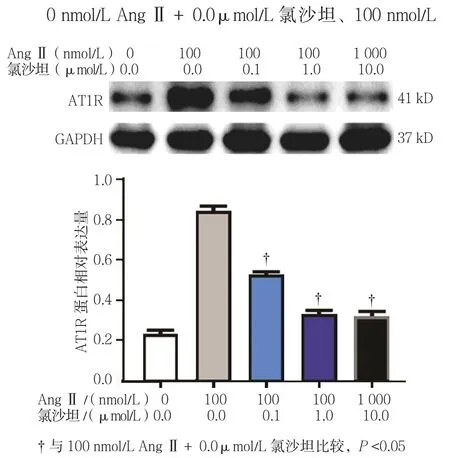
图4 不同浓度AngⅡ+氯沙坦对肝癌细胞系HepG2中AT1R蛋白表达的影响 (±s)
AngⅡ + 0.0μmol/L氯沙坦、100 nmol/L AngⅡ +0.1μmol/L氯沙坦、100 nmol/L AngⅡ+1.0μmol/L氯沙坦、1 000 nmol/L AngⅡ+10.0μmol/L氯沙坦组的VEGF表达量分别为(730.1±10.0)、(806.6±18.1)、(789.0±12.0)、(780.8±1.0)、(769.7±1.0),经单因素方差分析,差异有统计学意义(F=21.322,P=0.000)。进一步两两比较经LSD-t检验,100 nmol/L AngⅡ+0.0μmol/L氯沙坦组较0 nmol/L AngⅡ+0.0μmol/L氯沙坦组的VEGF表达量增加(t=1.215,P=0.041);与100 nmol/L AngⅡ+0.0μmol/L氯沙坦组比较,当氯沙坦的浓度为1.0μmol/L时,VEGF的表达量降低(t=1.383,P=0.030);当氯沙坦的浓度为10.0μmol/L时,VEGF的表达量进一步降低(t=1.407,P=0.028)。见图5。
2.5 氯沙坦对大鼠肝癌组织中AT1R、VEGF及CD34表达的影响
免疫组织化学法检测结果显示,氯沙坦对AT1R、VEGF及CD34的表达有较明显的影响(见图6)。对照组和氯沙坦组的AT1R阳性表达率分别为(62.07±3.86)%和(43.57±4.21)%,经t检验,差异有统计学意义(t=1.920,P=0.034),氯沙坦组较低(见图7)。对照组和氯沙坦组的VEGF阳性表达率分别为(57.38±6.16)%和(19.87±3.29)%,经t检验,差异有统计学意义(t=2.963,P=0.000),氯沙坦组较低(见图8)。对照组和氯沙坦组的AT1R阳性表达率分别为(56.83±5.17)%和(17.56±3.12)%,经t检验,差异有统计学意义(t=3.536,P=0.000),氯沙坦组较低(见图9)。
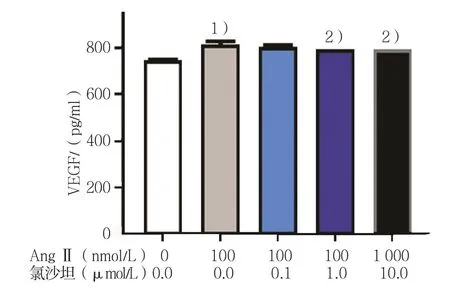
图5 氯沙坦对肝癌细胞系HepG2中VEGF的影响 (±s)
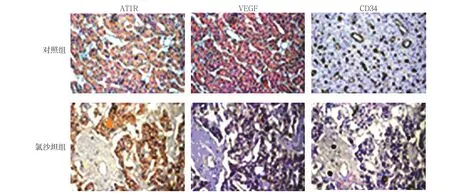
图6 大鼠肝癌组织中AT1R、VEGF及CD34的阳性表达 (免疫组织化学法×800)
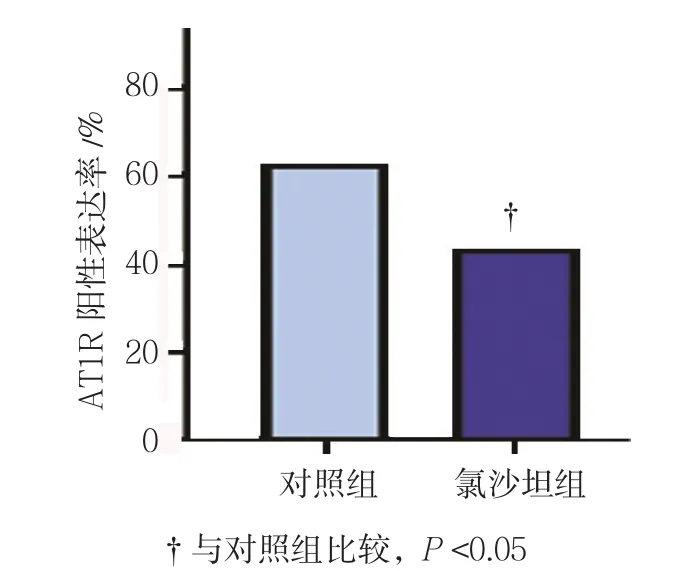
图7 氯沙坦对大鼠肝癌组织中AT1R表达的影响 (±s)
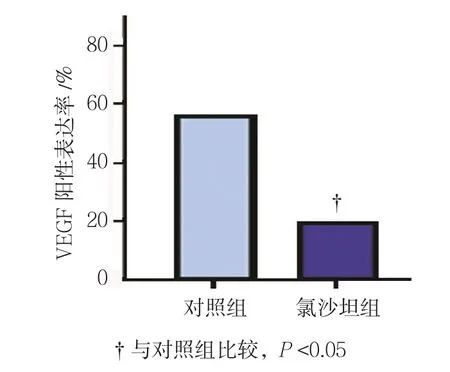
图8 氯沙坦对大鼠肝癌组织中VEGF表达的影响 (±s)
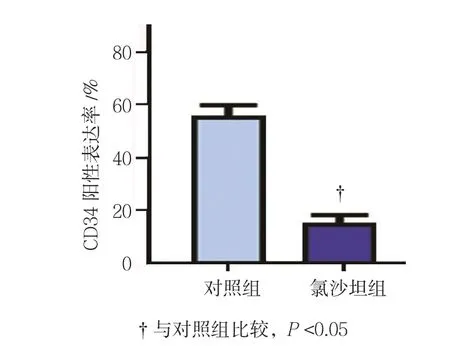
图9 氯沙坦对大鼠肝癌组织中CD34表达的影响 (±s)
3 讨论
AT1R在乳腺癌、胰腺癌、膀胱癌、肾癌等各种恶性肿瘤中表达[11]。有报道表明,AT1R参与多种动物模型中肿瘤的发生、发展[12]。但是在人肝癌细胞中,AT1R的表达报道甚少。FAN等[13]证明,AT1R在肝癌细胞系中高表达,其与肝癌的血管生成相关。本研究通过体内外实验证明AT1R阻断剂氯沙坦对肝癌血管生成的影响。免疫组织化学法结果表明,肝癌细胞中均有AT1R的表达,同时VEGF在肝癌细胞中的表达趋势与AT1R一致。VEGF是由肿瘤细胞分泌的、重要的血管生成刺激因子,同时VEGF的表达与肝癌预后有关。通过上调VEGF可以刺激血管的生成,AngⅡ通过与G蛋白偶联受体AT1R结合,介导很多细胞效应。因此,AngⅡ-AT1R-VEGF系统在控制肝癌细胞血管生成中有重要作用。
除了VEGF,肿瘤内的MVD也是评估恶性肿瘤患者预后的重要定量参数。CD31、CD34、vWF为鉴定MVD的上皮细胞特异性标志[14]。MVD与AT1R的表达呈正相关,约70%高MVD样本中,AT1R有高表达现象。MVD可以有效反映肿瘤血管的生成。并且MVD的增加与VEGF表达呈正相关[15]。笔者推测,AT1R对肝癌血管的生成具有重要作用,所以AT1R对调节VEGF-A具有重要作用。血管生成已成为药物治疗的一个重要的靶点,许多血管生成抑制药物已经用于临床。在本研究中,AngⅡ通过上调AT1R蛋白表达来促进肝癌细胞中VEGF的产生,同时氯沙坦可以抑制该现象。本研究同时证明,氯沙坦可以有效抑制肿瘤的生长和VEGF的表达。作为AT1R的抑制剂,氯沙坦可以抑制体内固体瘤的生长,这种抑制可能是通过抑制血管生成介导的。
AT1R参与癌细胞增殖。但是SUGANUMA等[16]实验表明,AngⅡ不能有效地促进卵巢癌细胞的增殖。同时在本实验中,AngⅡ可以增加VEGF的分泌,AT1R也许没有直接参与肝癌细胞的增殖,并且血管紧张素Ⅱ-AT1R体系在不同类型肿瘤细胞的发展过程中也起到不同的作用。
综上所述,本研究结果表明,AT1R表达于肝癌细胞中,并与肿瘤血管生成有关。AT1R的抑制剂可以抑制实验动物模型中肿瘤血管的生成。尽管如此,AT1R阻抑剂氯沙坦的实验结果表明,氯沙坦既无直接的毒性作用,也无抗增殖的作用。根据体内外实验结果,笔者将氯沙坦的抗肿瘤作用归结于抗血管的生成作用,而不是直接的毒性作用。AT1R不仅是一个很有潜力的预后指示因子,而且是肝癌治疗的一个重要靶点。

