氯硝柳胺联合顺铂抑制肾上腺皮质癌的实验研究*
王敏捷,王尉,朱沂,赵旭,胡卫列
(1.解放军第422医院 泌尿外科,广东 湛江 524009;2.广州军区广州总医院 泌尿外科,广东 广州 510010)
顺铂是肾上腺皮质癌常用的化疗药物之一[1-2],大剂量应用易诱发骨髓抑制、肾功能损害,并产生耐药性,降低疗效[3],所以降低其剂量,增强肾上腺皮质癌对其敏感性的研究有非常重要的临床应用价值。最新研究发现,氯硝柳胺有抗肿瘤活性,且能增强顺铂对三阴乳腺癌的毒性作用[4]。本实验联用氯硝柳胺和顺铂,研究其对肾上腺皮质癌的疗效及作用机制,为探索肾上腺皮质癌新的治疗方案提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞 人肾上腺皮质癌SW-l3细胞株(上海中国科学院细胞库)。
1.1.2 药物 氯硝柳胺、顺铂购自美国Sigma-Aldrich公司。
1.1.3 试剂 胎牛血清(fetal bovine serum, FBS)(美国MPBIO公司),胰酶、双抗购自美国Gibco公司,L-15培养基、磷酸盐缓冲溶液(phosphate buffer saline,PBS)购自上海Genom公司,兔抗人β-actin抗体、兔抗人Bcl-2抗体、Caspase-3抗体、Vimentin抗体、E-cadherin抗体购自美国Cell Signaling Technology公司,二喹啉甲酸(bicinchoninic acid, BCA)蛋白检测试剂盒、二甲亚砜(Dimethyl sulfoxide, DMSO)购自美国Sigma-Aldrich公司,结晶紫染液(上海碧云天生物技术公司),基质胶(美国Corning公司),CCK-8法细胞增殖检测试剂盒、吖啶橙/溴化乙锭(acridine orange/ethidium bromide AO/EB)细胞凋亡检测试剂盒、Annexin V/PI细胞凋亡检测试剂盒购自日本DOJINDO公司。
1.2 仪器与设备
8μl孔Transwell小室、流式细胞仪LSRII购自美国BD公司,培养瓶/皿、离心管购自美国Corning公司,倒置显微镜(日本Olympus公司),37℃无二氧化碳CO2恒温孵箱(美国Thermo公司)。
1.3 SW-13细胞培育
SW-13细胞接种于25 cm2培养瓶,培养液为L-15培养基(含10% FBS和1%双抗),37℃无CO2恒温孵箱常规培养,当细胞处于对数生长期时用于实验。
1.4 SW-13细胞增殖检测
将处于对数生长期的SW-13细胞按2×103个/孔,接种于96孔培养板,用不同浓度的氯硝柳胺(4.00、2.00、1.00、0.50和 0.25μmol/L)和顺铂(40、32、24、16、8和4 mg/L)处理细胞,每组设3个复孔。分别于药物处理24和48 h后加入10μl CCK-8,避光37℃恒温无CO2孵箱培养4 h,用酶标仪测定450 nm处吸光值(optical density, OD值)。然后,根据细胞对2种药物的反应,选取0.5和1.0μmol/L氯硝柳胺与不同浓度顺铂联合处理细胞48 h,CCK-8法检测OD值。实验重复3次。根据OD值计算细胞生存率、半抑制浓度(half maximal inhibitory concentration, IC50)并绘制细胞生存率曲线。细胞生存率(%)=(OD实验组-OD空白组)/(OD阴性组-OD空白组)×100%。
1.5 SW-13细胞凋亡检测
1.5.1 Annexin V/PI染色 将SW-13细胞接种于25 cm2培养瓶,设对照组、氯硝柳胺组(1μmol/L氯硝柳胺)、顺铂组(16 mg/L顺铂)、联合用药组(1μmol/L氯硝柳胺+16 mg/L顺铂),过夜培养后用药物处理。48 h后按Annexin V/PI凋亡检测试剂盒说明书进行操作,用流式细胞仪检测细胞凋亡。实验重复3次。
1.5.2 AO/EB染色 将SW-13细胞按5×105个/孔接种于6孔板。分组同1.5.1,过夜培养后进行药物处理。48 h后按照AO/EB凋亡染色试剂盒说明书进行染色,荧光显微镜下随机选取5个视野观察结果、拍照,并且计数正常、早期、晚期凋亡细胞数,取平均值,根据结果计算凋亡率。实验重复3次。
1.6 Transwell实验
将 SW-13细胞按 1×104个 /室接种于 8μl孔Transwell小室的上室,分组同1.5.1。下室加入500μl含30% FBS的L-15培养基,过夜培养后按分组药物处理,24 h后用0.1%结晶紫室温下染色5~10 min,显微镜下随机选取5个视野观察结果,并拍照、计数,计算细胞侵袭力。实验重复3次。
1.7 细胞划痕实验
将SW-13细胞接种于6孔板,密度掌握为过夜培育后板底无空隙,分组同1.5.1。过夜培养后用100μl枪头垂直于底壁,力量均匀划痕3~5道。用PBS洗去脱落细胞和细胞碎片,药物处理后24 h显微镜下拍照。实验重复3次。根据细胞间距计算迁移率,细胞迁移率=(1-愈合后间距/起始间距)×100%。
1.8 Western blot检测
将SW-13细胞接种于25 cm2培养瓶,分组同1.5.1。过夜培养后进行药物处理,48 h后按BCA蛋白检测试剂盒说明书进行操作,结果条带用Image-Pro软件分析灰度值,β-actin作为内参蛋白。实验重复3次。
1.9 统计学方法
数据分析采用SPSS 15.0统计软件和Graphpad Prism 5.0作图软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 氯硝柳胺和顺铂抑制SW-13细胞的增殖
2.1.1 氯硝柳胺 氯硝柳胺各浓度处理组24和48 h细胞存活率比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞存活率有差别(F=114.614,P=0.000);②各浓度处理组细胞生存率有差别(F=293.883,P=0.000),随药物浓度的升高对SW-13细胞增殖的抑制作用越强;③各浓度处理组的细胞生存率变化趋势有差别(F=4.841,P=0.02)。氯硝柳胺24和48 h的IC50为1.825和1.250μmol/L。见图1。
2.1.2 顺铂 顺铂各浓度处理组24和48 h细胞存活率比较,采用重复测量设计的方差分析,结果:①不同时间点的细胞存活率有差别(F=2135.204,P=0.000);②各浓度处理组细胞生存率有差别(F=137.885,P=0.000),随药物浓度的升高对SW-13细胞增殖的抑制作用越强;③各浓度处理组的细胞生存率变化趋势有差别(F=159.979,P=0.000)。顺铂24和48 h的IC50为43.94和25.97 mg/L见图2。
2.2 氯硝柳胺增强顺铂对SW-13细胞增殖的抑制作用
顺铂组、顺铂+0.5μmol/L氯硝柳胺组、顺铂+1.0μmol/L氯硝柳胺组在4、8、16、24、32和40 mg/L顺铂中48 h细胞存活率比较,采用重复测量设计的方差分析,结果:①不同浓度顺铂的细胞存活率有差别(F=1072.297,P=0.000),②各组细胞生存率有差别(F=201.336,P=0.000),③各组的细胞生存率变化趋势有差别(F=37.443,P=0.000)。氯硝柳胺可以增强顺铂对SW-13的毒性作用,且随着氯硝柳胺浓度的升高毒性作用越强。见图3。
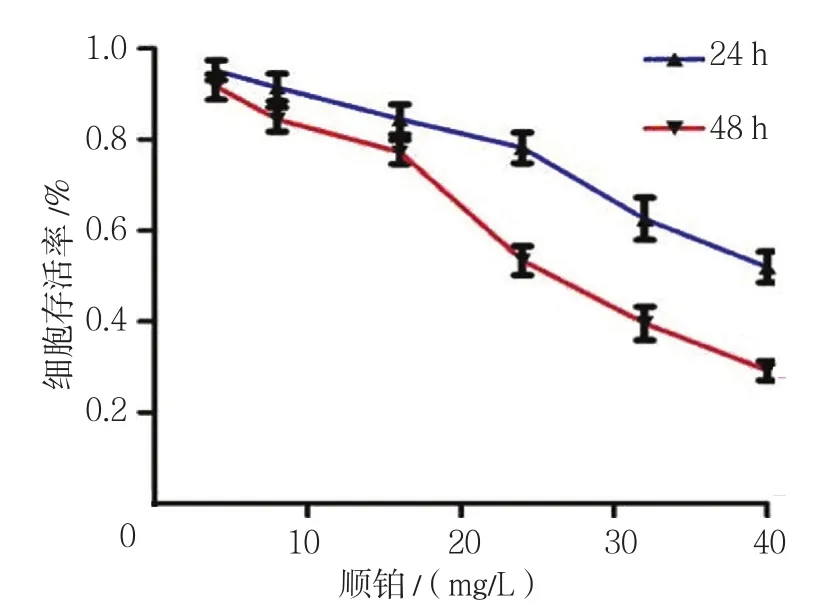
图2 不同剂量顺铂对SW-13细胞增殖的影响 (±s)

图3 氯硝柳胺增强顺铂对SW-13细胞增殖的抑制作用(±s)
2.3 氯硝柳胺联合低剂量顺铂促进SW13细胞凋亡
Annexin V/PI染色流式细胞仪检测早期凋亡细胞位于右下象限,晚期凋亡细胞位于右上象限(见图4)。48 h对照组、氯硝柳胺组、顺铂组、联合用药组细胞总凋亡率分别为(5.1±3.9)%、(28.5±6.01)%、(26.89±5.11)%和(50.53±9.87)%,经单因素方差分析,差异有统计学意义(F=12.354,P=0.007)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的细胞总凋亡率比较,差异有统计学意义(t=3.797和6.031,P=0.019和0.004),氯硝柳胺组、顺铂组较联合用药组低(见图5)。

图4 各组SW-13细胞的凋亡
2.4 各组SW-13细胞凋亡的形态学特征
AO/EB染色后荧光显微镜下正常SW-13细胞呈毛玻璃样,均匀染绿色;早期凋亡细胞胞质、胞核呈绿色,但胞核固缩呈圆珠状;晚期凋亡细胞呈桔红色,胞核固缩呈圆珠状(见图6)。48 h对照组、氯硝柳胺组、顺铂组、联合用药组的细胞总凋亡率分别为(5.8±4.2)%、(28.1±5.03)%、(27.1±4.98)%和(54.5±8.12)%,经单因素方差分析,差异有统计学意义(F=22.602,P=0.000)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的细胞总凋亡率比较,差异有统计学意义(t=5.525和6.180,P=0.001和0.000),氯硝柳胺组、顺铂组较联合用药组低(见图7)。
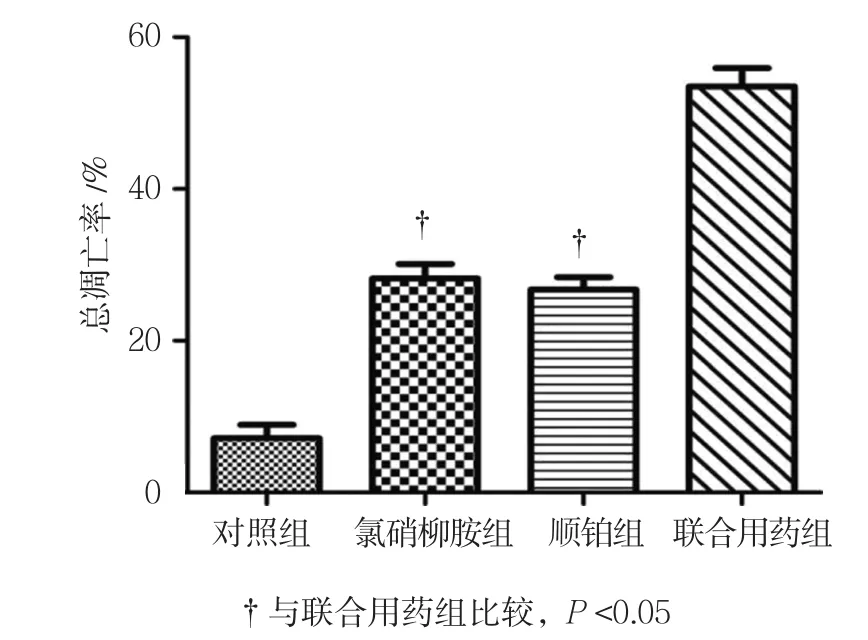
图5 各组SW-13细胞总凋亡率比较 (±s)

图6 各组SW-13细胞凋亡的形态学特征 (AO/EB染色×100)
2.5 氯硝柳胺联合低剂量顺铂降低SW-13细胞侵袭能力
Transwell实验结果显示,药物处理24 h后,对照组、氯硝柳胺组、顺铂组、联合用药组随机5个视野平均细胞数分别为(63.5±9.1)、(20.6±8.0)、(22.2±7.8)和(9.4±3.6)个,经单因素方差分析,差异有统计学意义(F=5.341,P=0.022)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的平均细胞数比较,差异有统计学意义(t=2.870和3.338,P=0.021和0.010),氯硝柳胺组、顺铂组较联合用药组高。见图8、9。

图7 各组SW-13细胞总凋亡率比较 (±s)
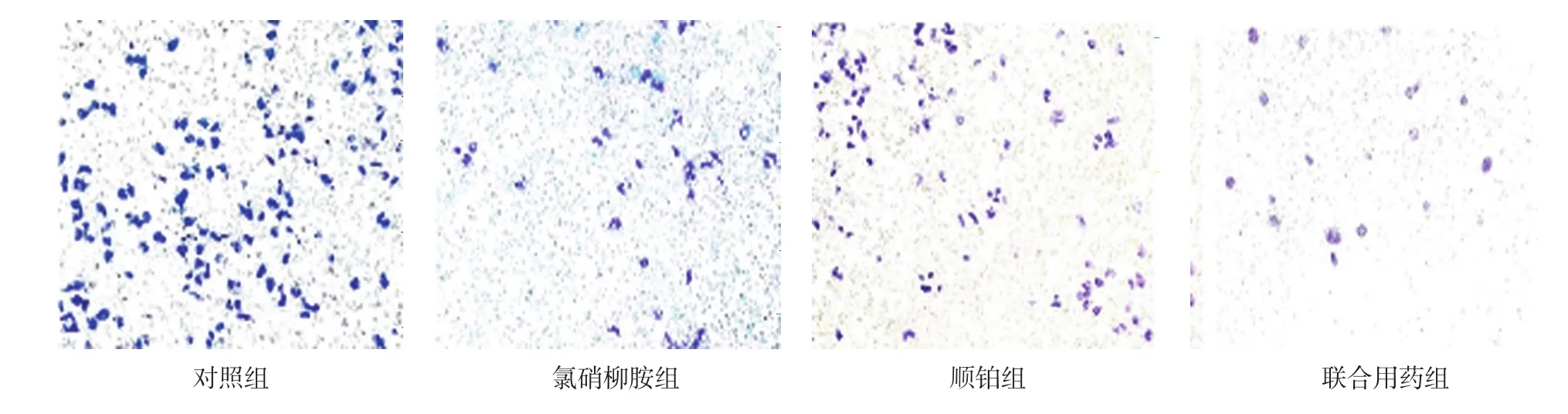
图8 各组药物作用24 h后SW-13细胞的侵袭能力 (结晶紫染色×100)
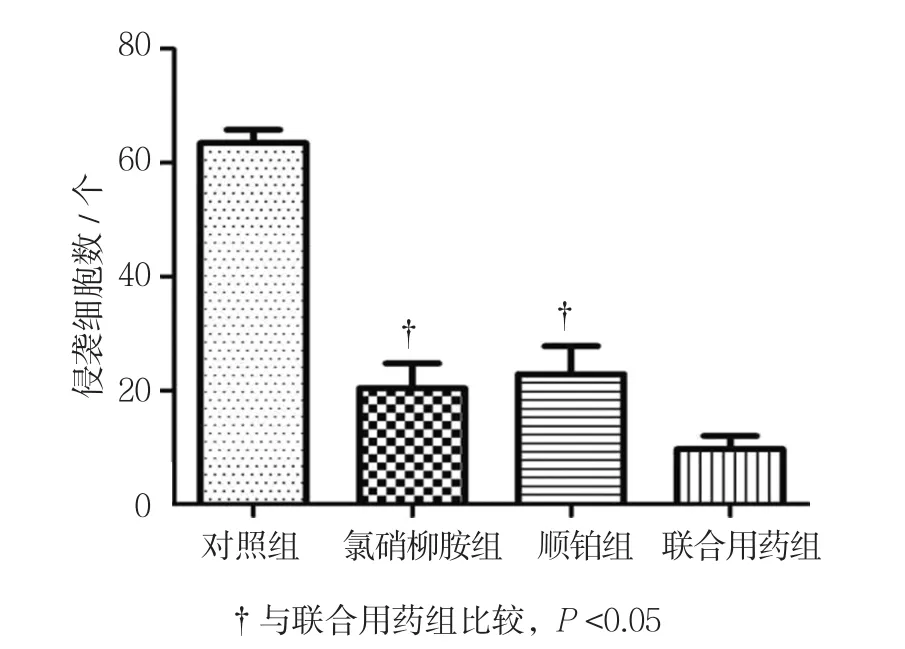
图9 各组药物作用24 h后SW-13侵袭细胞数比较 (±s)
2.6 氯硝柳胺联合低剂量顺铂降低SW-13细胞迁移能力
细胞划痕实验结果显示,药物处理24 h后,对照组、氯硝柳胺、顺铂组、联合用药组迁移率分别为(43.25±5.48)%、(16.65±3.26)%、(17.74±3.13)%和(8.81±1.25)%,经单因素方差分析,差异有统计学意义(F=9.715,P=0.013)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的迁移率比较,差异有统计学意义(t=3.226和4.589,P=0.031和0.010),氯硝柳胺组、顺铂组较联合用药组高。见图10、11。
2.7 氯硝柳胺联合低剂量顺铂抑制Bcl-2的表达,促进Caspase-3的表达
2.7.1 Bcl-2 Western blot检测结果显示,对照组、氯硝柳胺组、顺铂组、联合用药组的Bcl-2相对表达量分别为(87.91±8.89)、(75.98±9.26)、(71.73±6.77)和(24.82±9.13),经单因素方差分析,差异有统计学意义(F=33.716,P=0.001)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的Bcl-2相对表达量比较,差异有统计学意义(t=6.811和7.143,均P=0.002),氯硝柳胺组、顺铂组较联合用药组高。见图12、13。

图10 各组SW-13细胞的迁移能力 (×100)

图11 各组SW-13细胞迁移率比较 (±s)
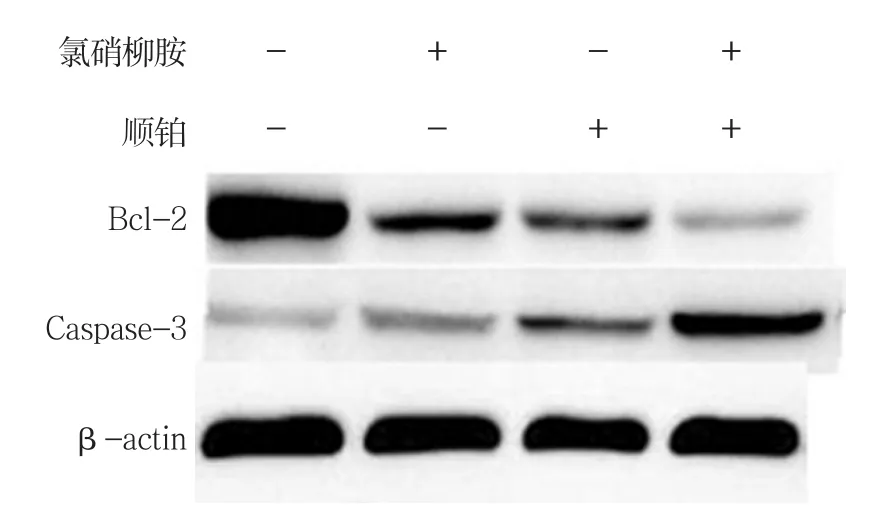
图12 各组Bcl-2、Caspase-3蛋白的表达
2.7.2 Caspase-3 Western blot检测结果显示,对照组、氯硝柳胺组、顺铂组、联合用药组的Caspase-3相对表达量分别为(15.48±5.14)、(27.52±3.26)、(35.74±5.08)和(64.52±5.09),经单因素方差分析,差异有统计学意义(F=54.406,P=0.000)。进一步两组、氯硝柳胺、顺铂组、联合用药组的E-cadherin相对表达量分别为(18.58±6.01)、(9.32±2.15)、(9.72±1.78)和(3.84±0.513),经单因素方差分析,差异有统计学意义(F=12.131,P=0.008)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的E-cadherin相对表达量比较,差异有统计学意义(t=4.846和5.387,P=0.008和0.006),氯硝两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的Caspase-3相对表达量比较,差异有统计学意义(t=10.593和6.929,P=0.000和0.002),氯硝柳胺组、顺铂组较联合用药组低。见图12、14。
2.8 氯硝柳胺联合低剂量顺铂促进E-cadherin的表达,抑制Vimentin的表达
2.8.1 E-cadherin Western blot检测结果显示,对照柳胺组、顺铂组较联合用药组高。见图15、16。
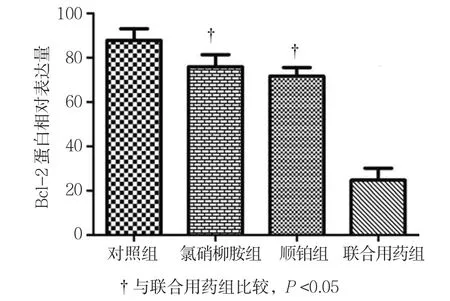
图13 各组Bcl-2蛋白表达水平比较 (±s)
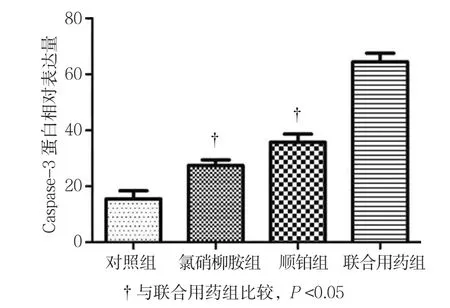
图14 各组Caspase-3蛋白表达水平比较 (±s)
2.8.2 Vimentin Western blot检测结果显示,对照组、氯硝柳胺、顺铂组、联合用药组的Vimentin相对表达量分别为(13.48±2.14)、(19.42±5.27)、(26.64±2.83)和(38.25±8.08),经单因素方差分析,差异有统计学意义(F=54.406,P=0.000)。进一步两两比较经Dunnett-t检验,氯硝柳胺组、顺铂组与联合用药组的Vimentin相对表达量比较,差异有统计学意义(t=5.514和4.304,P=0.005和0.013),氯硝柳胺组、顺铂组较联合用药组低。见图15、17。
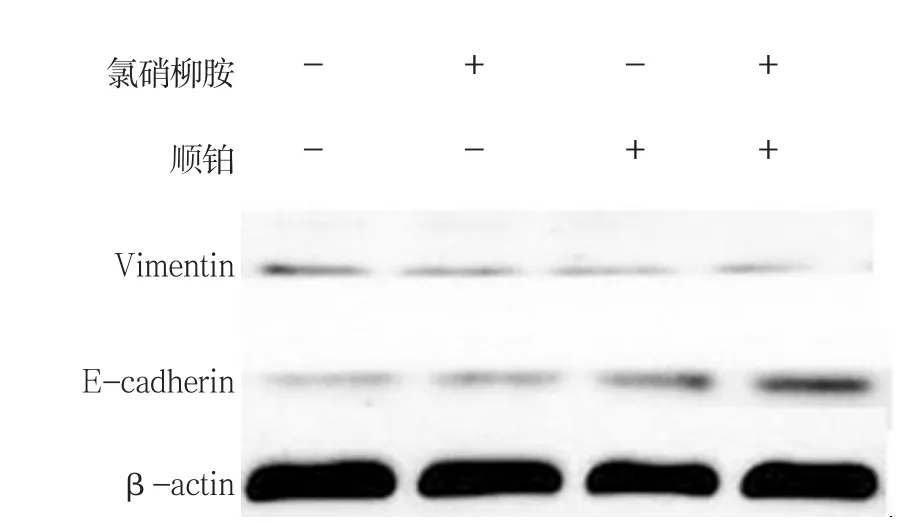
图15 各组E-cadherin、Vimentin蛋白的表达
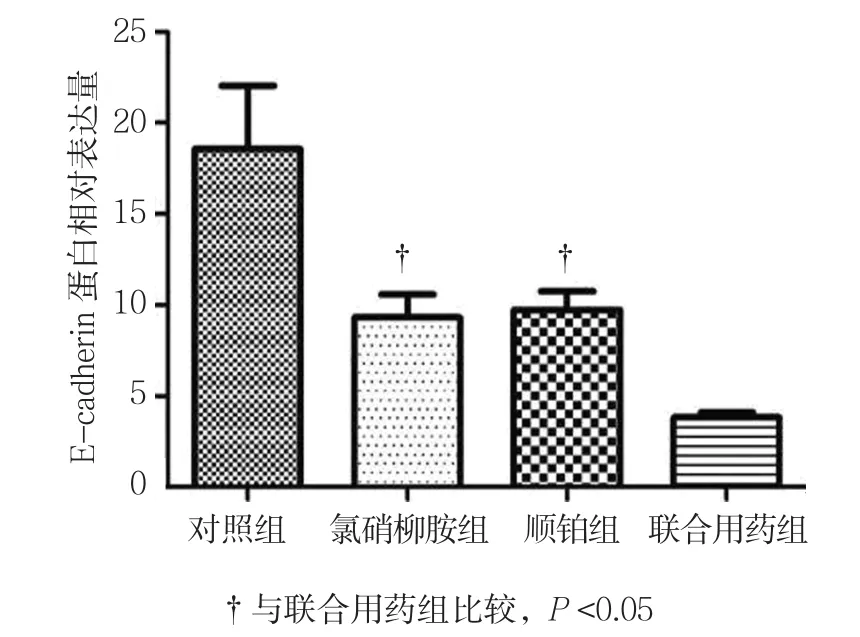
图16 各组E-cadherin蛋白表达水平比较 (±s)
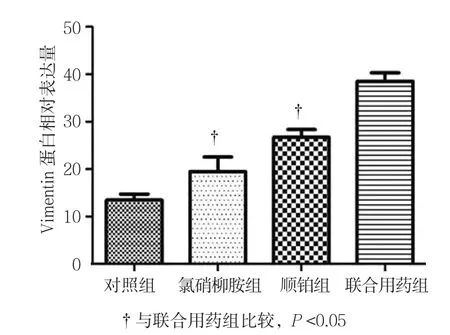
图17 各组Vimentin蛋白表达水平比较 (±s)
3 讨论
肾上腺皮质癌是一种起源于肾上腺皮质的恶性肿瘤,病程进展迅速。该病早期诊断困难,导致大多数患者确诊时已属晚期,治疗仍以根治手术为主[5]。由于缺乏有效的辅助治疗手段,使该病预后极差,病死率达40%[6]。因此,为有效提高肾上腺皮质癌患者的生存率,手术联合药物治疗是一项重要的研究课题。
顺铂是临床治疗肾上腺皮质癌依托泊甘+顺铂+表柔比星+米托坦方案的重要成分,但大剂量顺铂诱发的骨髓抑制、肾功能损害等副作用严重影响其临床应用,而且随着顺铂剂量的增大,能够明显增加其耐药率[7],所以降低顺铂的剂量,增强肾上腺皮质癌细胞对顺铂敏感性的研究有非常重要的临床应用价值。
在细胞增殖实验中发现,氯硝柳胺和不同浓度的顺铂联合作用于SW-13细胞后,可以提高顺铂对SW-13细胞的毒性作用,对低剂量顺铂的杀伤作用促进尤为明显。在凋亡实验中发现,氯硝柳胺增强低剂量顺铂抑制SW-13细胞的增殖作用与促进细胞凋亡相关,联合用药组细胞凋亡率达50.53%,较氯硝柳胺和顺铂组的28.5%和26.89%提高。AO/EB凋亡实验中不仅进一步证实该促凋亡作用,而且能直观地观察细胞凋亡的形态学变化。在细胞凋亡过程中,Bcl-2家族成员起至关重要的作用。Bcl-2是细胞凋亡的负调节因子,受到外界刺激时能保护细胞免于凋亡[8],而活化的Caspase-3是启动细胞凋亡的标志。Western blot检测结果显示,联合用药组的Bcl-2蛋白表达水平较氯硝柳胺组、顺铂组明显抑制,而Caspase-3表达较氯硝柳胺组、顺铂组升高。说明氯硝柳胺联合低剂量顺铂有可能是通过抑制抗凋亡蛋白Bcl-2的表达和促进凋亡启动蛋白Caspase-3的表达,来发挥促进细胞凋亡的作用,并通过促进凋亡,抑制SW-13细胞的增殖。通过Transwell实验和细胞划痕实验证实,氯硝柳胺和顺铂联合应用可以降低SW-13细胞的侵袭和迁移能力,联合用药组较氯硝柳胺组、顺铂组对SW-13细胞侵袭和迁移能力的抑制作用更明显。研究发现,上皮间质转化参与多种肿瘤的浸润、转移,是肿瘤侵袭、转移的一个重要分子机制[9]。肿瘤细胞E-cadherin的缺失是促进肿瘤转移的重要表现[10],随着E-cadherin表达减少,Vimentin蛋白表达增加,肿瘤恶性程度增加[11]。通过Western blot检测发现,联合用药组较氯硝柳胺组、顺铂组可以明显抑制Vimentin的表达,促进E-cadherin的表达,表明氯硝柳胺和低剂量顺铂联合应用有可能是通过对上皮间质转化相关蛋白表达的影响,降低SW-13细胞的侵袭和迁移能力。
细胞的增殖和凋亡都是多基因调控的复杂过程。研究发现,氯硝柳胺可以通过抑制Wnt/β-catenin、mTORC1、STAT3、NF-κB、Notch、HEDGEHOG 等信号通路,发挥抑制肿瘤细胞增殖和诱导凋亡的作用[12-14]。已知外在的死亡受体通路或内在的线粒体通路都可以促进顺铂诱导的细胞凋亡,在此过程中有多种蛋白质参与,如JNK信号通路蛋白、p53、抗凋亡蛋白及Bcl-2家族蛋白[15]。因此,氯硝柳胺与顺铂联用的抗肿瘤机制是相当复杂的过程,仍需进一步实验证明。
综上所述,本研究在体外联合氯硝柳胺和低剂量顺铂作用于SW-13细胞,通过对其细胞增殖、凋亡,以及细胞侵袭力和迁移能力的多角度观察,认为氯硝柳胺和低剂量顺铂联合应用可以抑制SW-13细胞增殖,促进细胞凋亡,降低其侵袭和迁移能力。并且这种抑制增殖和促进凋亡作用是通过抑制Bcl-2的表达,促进Caspase-3的表达实现的,同时氯硝柳胺和低剂量顺铂联合应用通过对Vimentin和E-cadherin的表达影响,降低SW-13细胞的侵袭和迁移能力。希望通过本研究可以对肾上腺皮质癌的治疗提供理论支持,在提高顺铂的抗肿瘤作用的同时,降低由于大剂量应用顺铂而造成的副作用和细胞耐药。

