小窝蛋白-3/RISK介导HBO-PC对心肌的保护作用研究*
袁利邦,殷亮,秦福恩,刘洪,查鹏,付海钰,巩固
(成都军区总医院 麻醉科,四川 成都 610083)
缺血再灌注(ischemia/reperfusion, I/R)损伤是多因素、多途径参与的病理生理过程。研究发现,高压氧预处理(hyperbaric oxygen preconditioning, HBOPC)可通过提高机体抗氧化损伤能力[1]、调控血管生长因子[2]和血红素氧化酶[3]的表达,减轻心肌I/R损伤。心肌的细胞膜小窝蛋白-3(Caveolin-3, Cav-3)[4]可通过影响下游再灌注损伤挽救激酶(reperfusion injury salvage kinase, RISK)通路,保护心肌[5]。但Cav-3/RISK是否介导HBO-PC的心肌保护作用尚无报道。本文复制H9c2心肌细胞缺氧复氧(hypoxia/reoxygenation, H/R)模型,旨在探讨HBO-PC保护心肌的具体作用机制。
1 材料与方法
1.1 主要材料与试剂
1.1.1 细胞及试剂 H9c2心肌细胞(中国科学院上海细胞库),DMEM培养基和胎牛血清(fetal calf serum,FBS)购自美国Hyclone公司,丙二醛(Malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒购自美国Sigma公司,一氧化氮NO测定试剂盒(上海恒远生物有限公司),Protein A/G Plus-Agarose、蛋白激酶C(protein kinase, PKC)抑制剂Chelerythrine(CHE)、RISK通路激酶抑制剂LY294002和PD98059购自美国Santa Cruz Biotechnology公司。
1.1.2 抗体 兔单抗Caspase-3(1∶1 000)、兔单抗Cleaved caspase-3(1∶500)、兔单抗胞外信号调节 激 酶(extracellular signal-regulated kinases, ERK)1/2(1∶ 1 000)、兔单抗 p-ERK1/2(1∶ 500)、兔单抗磷脂酰肌醇-3-羟激酶(phosphoinositide 3-kinase,PI3K)(1∶1 000)、兔多抗p-PI3K(1∶500)、兔单抗蛋白激酶B(protein kinase B, Akt)(1∶1 000)、兔单抗p-Akt(1∶1 000)、鼠单抗糖原合酶激酶(glycogen synthase kinase, GSK)3β(1∶ 1 000)、兔单抗p-GSK-3β(1∶500)购自美国Cell Signaling Technology公司,兔多抗Bcl-2(1∶500)、兔单抗PKCε(1∶1 000)及兔多抗Cav-3(1∶500)购自美国Abcam公司,辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG购自北京中山金桥生物技术有限公司。
1.1.3 仪器 倒置显微镜(日本Olympus公司),Sorvall Stratos型高速冷冻离心机、Heracell 150I型细胞培养箱购自美国Thermo Scientific公司,Synergy HT型酶标仪(美国BioTek公司),YLC0.5/1A型婴儿HBO舱(武汉中国船舶重工集团公司第701研究所),共聚焦显微镜(德国Leica公司)。
1.2 细胞培养及分组
37℃、5%二氧化碳CO2条件下,用DMEM完全培养液培养H9c2心肌细胞,选用对数生长期的细胞进行实验。实验设计主要分2部分:①探究HBO-PC对心肌I/R损伤的作用,将细胞分为正常培养的对照组、H/R组及HBO-PC+H/R组;②探讨HBO-PC对心肌I/R损伤的作用机制,将细胞分为正常培养的对照组、H/R组、HBO-PC+H/R组及HBO-PC+H/R+激酶抑制剂组。HBO-PC条件:纯氧洗舱10 min,0.28 MPa稳压1 h,加压和减压过程控制至5 min。HBO-PC后2 h开始复制H/R模型。CHE、LY294002及PD98059作用于心肌细胞的终浓度分别为1、40和25μmol/L。
1.3 H/R模型的复制
培养心肌细胞至融合度为80%~90%,将完全培养液换成无糖Tyrode’s溶液,持续通入含95%氮气N2和5% CO2的混合气体,形成密闭缺氧空间,以模拟缺血。4 h后换含糖Tyrode’s溶液,置于37℃、5%CO2培养箱中继续培养2 h,该过程为复氧,以模拟再灌注。复制H/R模型后换成DMEM完全培养液进行正常培养,或者加入激酶抑制剂作用心肌细胞,24 h后收集细胞或者培养液进行后续检测。
1.4 收集富含Cav-3的膜片段
按照文献[6]的方法,收集各组心肌细胞,加入2 ml 0.5 mol/L Na2CO3溶液(pH 11.0)重悬并匀浆。向匀浆液中加入2 ml 90%蔗糖溶液,一起转移至超速离心管中,加入4 ml 35%蔗糖溶液和4 ml 5%蔗糖溶液,10 000 r/min离心18~20 h,用样品管从上向下梯度收集液体,1 ml/管,共12管,其中4~6 ml部分为富含小窝蛋白的部分。2 000 r/min离心2 h收集该部分沉淀,加入蛋白裂解液,超声裂解后所得蛋白样品进行Western blot检测。
1.5 免疫共沉淀
各组心肌细胞裂解后离心取上清,进行蛋白定量。取500μg蛋白样品与2μg兔多抗Cav-3一抗混匀,4℃孵育2 h,加入20μl Protein A/G Plus-Agarose,4℃震荡过夜。离心收集沉淀,PBS洗涤4次,加入1×SDS样品缓冲液重悬,95℃变性5 min,Western blot检测PKCε的含量。
1.6 免疫荧光染色
心肌细胞经爬片、4%多聚甲醛固定和0.1%Triton X-100透化后,加入10%羊血清常温孵育30 min,PBS洗涤后加入一抗孵育,4℃过夜。PBS充分洗涤后加入带有荧光标记的二抗,避光常温孵育2 h,PBS充分洗涤后用95%甘油封片,共聚焦显微镜观察拍照。
1.7 SOD、MDA、LDH和NO的检测
收集细胞和培养液,将细胞裂解后离心取上清,按照SOD、MDA、LDH和NO检测试剂盒说明书进行操作,根据测定结果计算各组细胞内SOD和MDA、以及细胞培养液中LDH和NO的含量。
1.8 Western blot检测
由心肌细胞提取的蛋白经10% SDS-PAGE分离后,电转至硝酸纤维素膜上,用5%脱脂奶粉常温封闭1 h,加入兔单抗Caspase-3、Cleaved caspase-3、PKCε、ERK1/2、Akt、PI3K、p-ERK1/2、p-Akt、p-GSK-3β,鼠单抗GSK-3β,兔多抗p-PI3K、Bcl-2、Cav-3,4℃孵育过夜。PBST洗膜后加入HRP标记的兔抗大鼠IgG(1∶5 000),常温孵育2 h,PBST洗膜,进行ECL反应,分析蛋白条带。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 HBO-PC减轻心肌I/R损伤
2.1.1 3组SOD、MDA、LDH、No的含量变化 对H9c2细胞予以HBO-PC处理,复制H/R模型24 h后,对 照 组、H/R组、HBO-PC+H/R组 的SOD、MDA、LDH、NO含量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,H/R组与对照组的MDA、LDH、SOD和NO含量比较,差异有统计学意义(P<0.05),提示H/R升高MDA和LDH含量,降低SOD和NO含量;HBO-PC+H/R组与H/R组的MDA、LDH、SOD和NO含量比较,差异有统计学意义(P<0.05),提示HBO-PC+H/R组MDA和LDH含量低于H/R组,SOD和NO含量高于H/R组。见表1。
2.1.2 3组Caspase-3活性、Bax和Bcl-2蛋白相对表达量比较 对照组、H/R组、HBO-PC+H/R组H9c2细胞中Caspase-3活性、Bax和Bcl-2蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,H/R组与对照组的Caspase-3活性、Bax和Bcl-2蛋白相对表达量比较,差异有统计学意义(P<0.05),提示H/R可增强Caspase-3活性,增加Bax蛋白表达,减少Bcl-2蛋白表达;HBO-PC+H/R组与H/R组的Caspase-3活性、Bax和Bcl-2蛋白相对表达量比较,差异有统计学意义(P<0.05),提示HBO-PC减弱Caspase-3活性,减少Bax表达,增加Bcl-2表达。见表2和图1、2。
表1 3组SOD、MDA、LDH、NO含量比较 (±s)
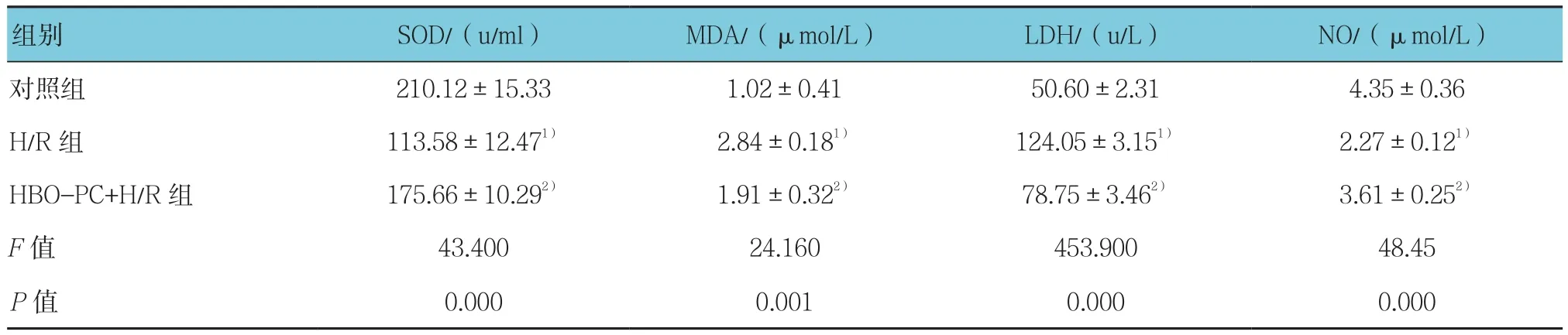
表1 3组SOD、MDA、LDH、NO含量比较 (±s)
注:1)与对照组比较,P <0.05;2)与H/R组比较,P <0.05
组别 SOD/(u/ml) MDA/(μmol/L) LDH/(u/L) NO/(μmol/L)对照组 210.12±15.33 1.02±0.41 50.60±2.31 4.35±0.36 H/R组 113.58±12.471) 2.84±0.181) 124.05±3.151) 2.27±0.121)HBO-PC+H/R组 175.66±10.292) 1.91±0.322) 78.75±3.462) 3.61±0.252)F值 43.400 24.160 453.900 48.45 P值 0.000 0.001 0.000 0.000
表2 3组Caspase-3活性、Bax和Bcl-2蛋白表达水平比较 (±s)
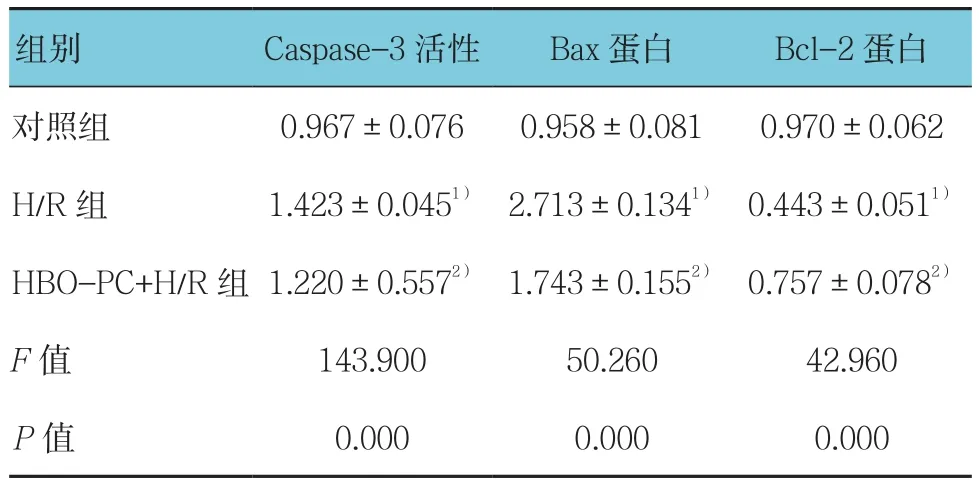
表2 3组Caspase-3活性、Bax和Bcl-2蛋白表达水平比较 (±s)
注:1)与对照组比较,P <0.05;2)与H/R组比较,P <0.05
组别 Caspase-3活性 Bax蛋白 Bcl-2蛋白对照组 0.967±0.076 0.958±0.081 0.970±0.062 H/R 组 1.423±0.0451) 2.713±0.1341) 0.443±0.0511)HBO-PC+H/R 组 1.220±0.5572) 1.743±0.1552) 0.757±0.0782)F值 143.900 50.260 42.960 P值 0.000 0.000 0.000
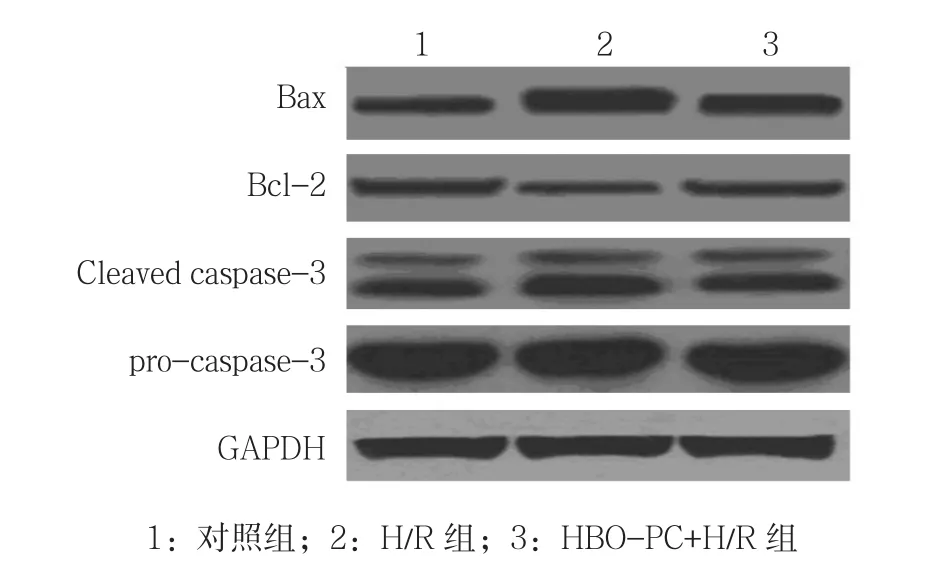
图1 3组Bax、Bcl-2、Cleaved caspase-3、procaspase-3蛋白的表达

图2 HBO-PC对H/R处理后H9c2细胞Caspase-3活性、Bax和Bcl-2蛋白表达的影响
2.2 HBO-PC促进PKCε与Cav-3结合
对照组、H/R组、HBO-PC+H/R组、HBO-PC+H/R+CHE组的PKCε相对表达量比较,经方差分析,差异无统计学意义(P>0.05)。4组Cav-3、PKCε与Cav-3结合的相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,H/R组与对照组的PKCε与Cav-3结合、Cav-3相对表达量比较,差异有统计学意义(P<0.05),提示H/R增加PKCε与Cav-3的结合,下调Cav-3的表达;HBO-PC+H/R组与H/R组的PKCε与Cav-3结合、Cav-3相对表达量比较,差异有统计学意义(P<0.05),提示HBO-PC进一步增加PKCε与Cav-3的结合,上调Cav-3的表达;HBO-PC+H/R+CHE组与HBOPC+H/R组的PKCε与Cav-3结合相对表达量比较,差异有统计学意义(P<0.05);HBO-PC+H/R+CHE组与HBO-PC+H/R组的Cav-3相对表达量比较,差异无统计学意义(P>0.05),提示CHE抑制PKCε与Cav-3的结合,不影响Cav-3的表达。见表3和图3~ 5。
2.3 HBO-PC激活RISK通路
对照组、H/R组、HBO-PC+H/R组、HBO-PC+H/R+CHE 组 的(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K及p-GSK3β/GSK3β比值比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,H/R组(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K 及 p-GSK3β/GSK3β 比值高于对照组(P<0.05);HBO-PC组(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K及p-GSK3β/GSK3β比值高于H/R组(P<0.05);HBO-PC+H/R+CHE 组(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K 及 p-GSK3β/GSK3β比值低于 HBO-PC+H/R组(P<0.05)。见表4和图6。
表3 4组PKCε、Cav-3及PKCε与Cav-3结合的表达水平比较 (±s)

表3 4组PKCε、Cav-3及PKCε与Cav-3结合的表达水平比较 (±s)
注:1)与对照组比较,P <0.05;2)与H/R组比较,P <0.05;3)与HBO-PC+H/R组比较,P <0.05
组别 PKCε Cav-3 PKCε与Cav-3结合对照组 0.970±0.044 0.973±0.041 0.957±0.060 H/R 组 0.960±0.046 0.563±0.0651) 1.137±0.0321)HBO-PC+H/R组 1.007±0.021 0.950±0.0622) 1.560±0.0752)HBO-PC+H/R+CHE 组 1.003±0.087 1.003±0.087 1.220±0.0563)F值 0.549 29.030 56.990 P值 0.663 0.000 0.000

图3 HBO-PC促进PKCε与Cav-3的结合 (免疫共沉淀)

图4 各组PKCε、Cav-3的表达比较 (Western blot检测)

图5 HBO-PC促进PKCε与Cav-3的结合 (免疫荧光染色×100)
表4 4组(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K及p-GSK3β/GSK3β比值比较 (±s)

表4 4组(p-ERK1/2)/(ERK1/2)、p-Akt/Akt、p-PI3K/PI3K及p-GSK3β/GSK3β比值比较 (±s)
注:1)与对照组比较,P <0.05;2)与H/R组比较,P <0.05;3)与HBO-PC+H/R组比较,P <0.05
组别 (p-ERK1/2)/(ERK1/2) p-Akt/Akt p-PI3K/PI3K p-GSK3β/GSK3β对照组 0.950±0.050 0.963±0.023 0.977±0.071 0.997±0.040 H/R组 1.083±0.0291) 1.097±0.0551) 1.133±0.0351) 1.117±0.0291)HBO-PC+H/R组 1.470±0.0662) 1.350±0.0462) 1.637±0.0652) 1.383±0.0312)HBO-PC+H/R+CHE 组 1.180±0.0463) 1.180±0.0263) 1.220±0.0503) 1.150±0.0503)F值 60.000 49.360 73.370 53.240 P值 0.000 0.000 0.000 0.000
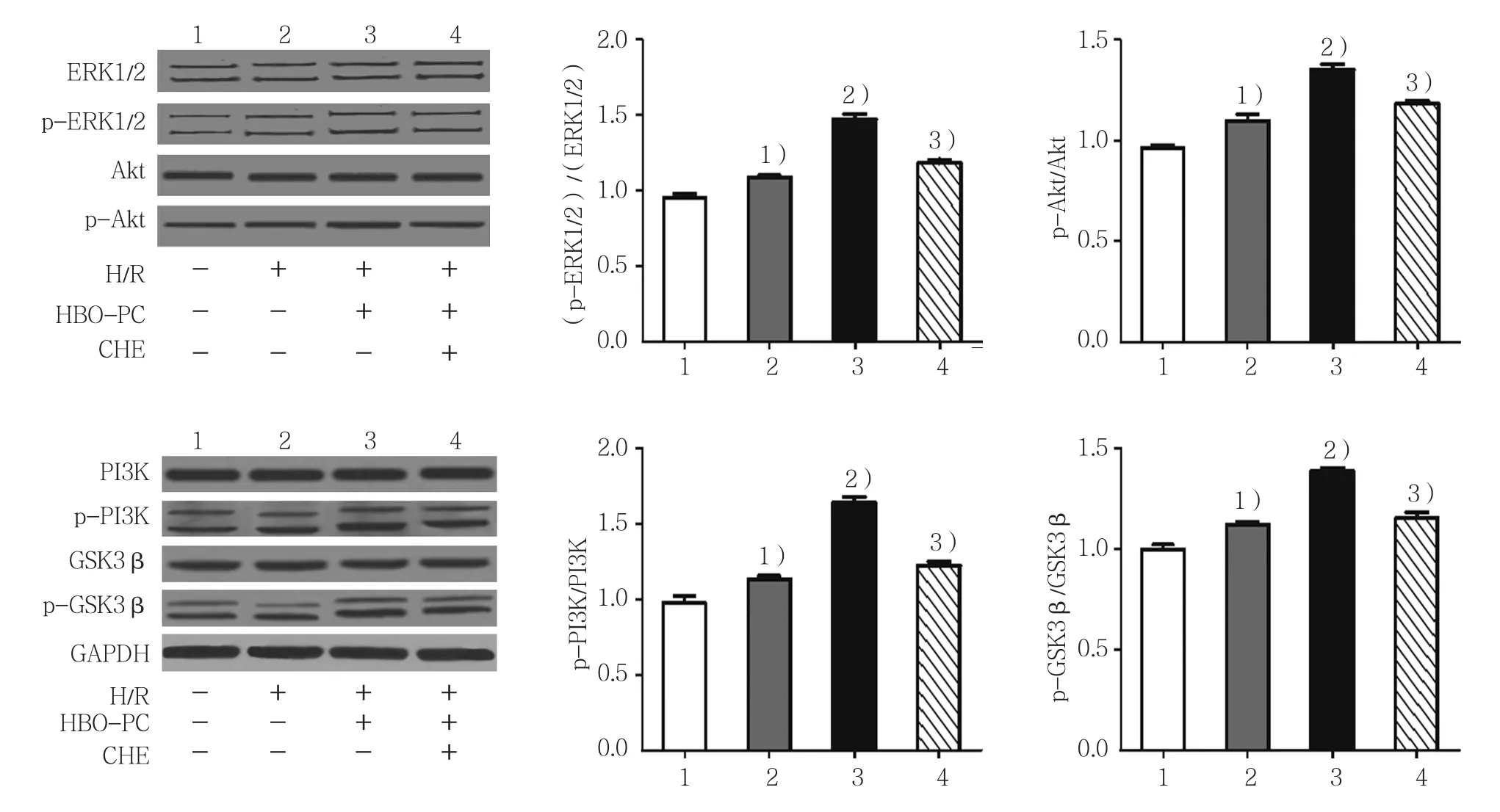
图6 HBO-PC对RISK通路的影响
2.4 RISK通路抑制剂减弱高压氧对心肌细胞I/R损伤的保护作用
对照组、H/R组、HBO-PC+H/R组、HBO-PC+H/R+LY294002组、HBO-PC+H/R+PD98059组的Caspase-3活性、Bax和Bcl-2蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,HBO-PC+H/R+LY294002组与HBO-PC+H/R组的Caspase-3活性、Bax和Bcl-2蛋白表达水平比较,差异有统计学意义(P<0.05),提示LY294002增强Caspase-3活性,增加Bax表达,减少Bcl-2表达;HBO-PC+H/R+PD98059组与HBO-PC+H/R组的Caspase-3活性、Bax和Bcl-2蛋白表达水平比较,差异有统计学意义(P<0.05),提示PD98059增强Caspase-3活性,上调Bax表达,下调Bcl-2表达。见表5和图7。
表5 5组Caspase-3活性、Bax和Bcl-2蛋白表达水平比较 (±s)
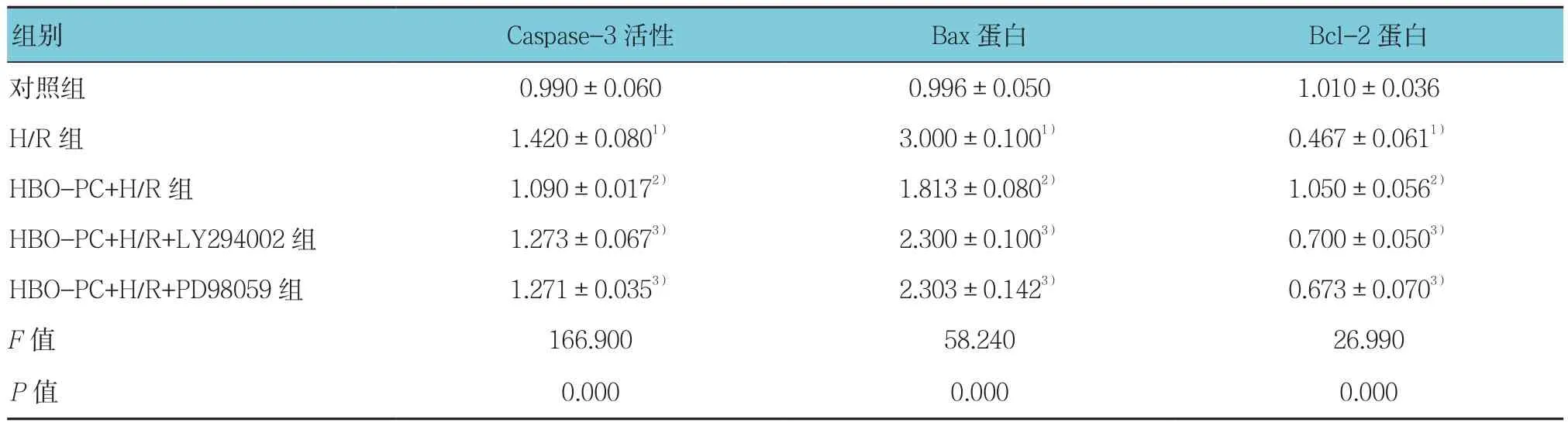
表5 5组Caspase-3活性、Bax和Bcl-2蛋白表达水平比较 (±s)
注:1)与对照组比较,P <0.05;2)与H/R组比较,P <0.05;3)与HBO-PC+H/R组比较,P <0.05
组别 Caspase-3活性 Bax蛋白 Bcl-2蛋白对照组 0.990±0.060 0.996±0.050 1.010±0.036 H/R组 1.420±0.0801) 3.000±0.1001) 0.467±0.0611)HBO-PC+H/R组 1.090±0.0172) 1.813±0.0802) 1.050±0.0562)HBO-PC+H/R+LY294002组 1.273±0.0673) 2.300±0.1003) 0.700±0.0503)HBO-PC+H/R+PD98059组 1.271±0.0353) 2.303±0.1423) 0.673±0.0703)F值 166.900 58.240 26.990 P值 0.000 0.000 0.000

图7 RISK通路抑制剂对H9c2细胞凋亡的影响
3 讨论
I/R诱发的心肌细胞功能异常和细胞死亡是心脏病患者发病率和死亡率增加的主要原因,发生机制主要与能量代谢障碍、钙超载、线粒体损伤、细胞自噬和炎症等有关[7]。药物和缺血的预处理与后处理是临床研究中比较重要的心肌保护策略。高压氧自身具有抗氧化功能,可以抑制氧化损伤,是一氧化碳中毒、减压病和动脉栓塞症的基础治疗方法,也是创伤愈合和缺血性损伤等疾病的辅助治疗手段[2]。最近研究发现,HBO-PC通过上调抗氧化酶SOD表达,下调神经炎症因子环氧合酶-2表达,抑制神经元细胞凋亡,从而减轻缺血性脑损伤;动物模型中,HBO-PC通过调控心肌PI3K/Akt/Nrf2通路,高压氧后处理通过降低Caspase-3活性和凋亡蛋白表达,抑制细胞凋亡通路,减轻心肌I/R损伤,从而发挥心肌保护作用[8]。但是有关HBO-PC保护心肌的具体机制尚未明确。本研究结果显示,HBO-PC能够减少H/R诱导的心肌损伤标志物LDH、MDA含量和Bax表达、减弱Caspase-3活性,增加抗氧化酶SOD、缺血预适应触发因子NO的含量和Bcl-2表达,说明HBO-PC可减少自由基、对抗脂质过氧化和抑制细胞凋亡,从而减轻H/R诱发的心肌细胞损伤。这与之前高压氧预/后处理在动物体内的研究保持一致[8]。
小窝是细胞膜上的微小结构,小窝蛋白参与多种细胞基本生命活动,如细胞内吞、胆固醇运输、细胞膜组装、信号传导等[9]。小窝蛋白有Cav-1、Cav-2和Cav-3 3种亚型,心肌特异性Cav-3过表达可模拟缺血预适应引起的内源性心肌保护作用[10],而Cav-3表达的缺失可阻断抗氧化系统加重I/R损伤程度[11]。另有研究发现,缺血损伤后,Cav-3敲除小鼠的存活率低于野生型小鼠,而Cav-3过表达小鼠则对心肌I/R损伤耐受[12]。活化的PKC亚型,如PKCα、PKCε、PKCδ能够靶向并结合心肌细胞小窝结构中的Cav-3蛋白,是活化信号向下游分子转导的关键环节。研究报道,缺氧预适应诱导PKC亚型选择性转位到小窝浆膜,结合Cav-3蛋白,可导致下游信号分子,如Akt、ERK等的激活[6]。PI3K和ERK信号通路合称RISK通路,缺血或者药物的预/后处理能够激活该通路,促使开放的线粒体通透性转换孔(mitochondria permeability transition pore, mPTP)关闭,促进Ca2+摄取和NO合成、释放,同时抑制细胞凋亡途径,进而拮抗I/R损伤的发生[13-14]。此外,GSK3β是RISK通路下游的效应激酶,其磷酸化水平升高预示酶活性降低[14]。心肌特异性Cav-3过表达的小鼠体内实验结果显示,Cav-3促进Akt磷酸化后能够激活GSK3β的磷酸化,使GSK3β处于失活状态,从而抑制mPTP的开放,发挥保护心肌的作用[10,12]。
本研究结果显示,HPO-PC促进PKCε活化转位于小窝并与Cav-3结合,增加Cav-3蛋白和RISK通路中激酶磷酸化水平的表达,减弱GSK3β活性,但是使用CHE能够抑制PKC活性,阻断PKCε与Cav-3结合,下调RISK通路中激酶磷酸化水平的表达,增强GSK3β活性,进而减弱HPO-PC的作用。上述结果表明,HPO-PC能够通过调控Cav-3蛋白表达及其与PKCε的结合,激活下游的RISK通路。此外,本实验还研究了PI3K抑制剂和ERK抑制剂对HBO-PC与H/R共同处理的心肌细胞凋亡的影响,结果发现2种抑制剂可升高Caspase-3活性和Bax表达,降低Bcl-2表达。说明RISK通路抑制剂能够阻断HBO-PC对心肌细胞凋亡的拮抗作用,减弱心肌保护作用,加重心肌I/R损伤。综上所述,HBO-PC可能通过影响PKCε/Cav-3/RISK通路,抑制心肌细胞凋亡,抵抗心肌I/R损伤,发挥心肌保护作用。

