雄激素受体在抗阻和耐力训练提高大鼠运动能力中的作用
林小晶 鲁林 王晓慧
上海体育学院运动科学学院(上海 200438)
雄激素睾酮与运动能力密切相关。不仅较高的血睾酮水平有助于运动能力的维持,而且运动所致骨骼肌质量的增加、运动能力的提高与睾酮水平的增加密切相关[1,2],过度运动造成的运动性低血睾酮是运动能力低下的重要因素之一。睾酮的生物学作用主要通过雄激素受体(androgen receptor,AR)的介导实现[3-6]。AR属于核受体超家族成员,除了在性器官及其相邻组织有高表达外,在骨骼肌、心肌、运动神经等也有程度不等的AR分布。骨骼肌中的AR分布在肌源性卫星细胞、成纤维细胞及肌管中。
运动能力主要由力量、速度、耐力、灵敏、柔韧和协调等素质决定,其中以力量和耐力最为重要。运动能力除了受神经系统、心肺功能等影响外,主要受骨骼肌的影响,包括肌肉质量、快慢肌纤维的比例和含量、肌球蛋白重链(myosin heavy chain,MHC)蛋白水平以及肌糖原含量等。肌肉质量是影响运动能力的最主要骨骼肌因素,质量大的肌肉收缩能力相对更强。骨骼肌分为快肌(如趾长伸肌,快肌纤维约占90%)、慢肌(如比目鱼肌,慢肌纤维约占90%)和介于两者中间的中间态肌(如腓肠肌,快慢肌纤维分别占70%和30%左右)。快肌收缩力量大、收缩速度快,但耐力差,而慢肌正相反。MHC是一种“马达”蛋白,可以水解ATP,为粗细肌丝间的滑动提供能量,所以有人认为MHC可反映骨骼肌的内在收缩能力。此外,肌糖原的储备也是影响运动能力的重要因素之一,高水平的肌糖原含量有利于向肌肉供能,提高肌肉收缩能力。
雄激素/AR对上述影响运动能力的骨骼肌因素均有作用。AR基因敲除(AR knockout,ARKO)小鼠的研究证实了AR对不训练的安静小鼠的骨骼肌有重要作用,包括促进骨骼肌发育和肌肉肥大[7],调控骨骼肌的快慢肌纤维含量和比例,增加骨骼肌MHC水平[8],以及增加骨骼肌肌糖原含量[9],从而对运动能力的提高起非常重要的作用。但AR在运动所致的肌肉肥大和运动能力增强的作用及机制,仍未完全阐明。尽管早有研究报道了运动在引起骨骼肌肥大之前或同时,出现血清睾酮和骨骼肌AR表达水平的增加,提示雄激素/AR在运动所致的肌肉肥大中可能起关键作用[10-13],但仍限于现象研究。
为确证AR在运动所致的肌肉肥大和运动能力增强中的作用及机制,ARKO小鼠无疑是很好的模型。但目前还没有商品化的AR基因敲除小鼠(现有的AR基因敲除小鼠都是实验室自己构建),且不同AR基因敲除小鼠的生物学行为不一致,更主要的是尚未见AR基因敲除小鼠运动训练的研究报道。因此,利用AR阻断剂研究AR的作用及机制,仍有一席之地。本课题用AR阻断剂氟他胺(flutamide)来证实AR在抗阻和耐力训练所致大鼠运动能力(最大力量、速度力量和耐力)增强中的作用及其机制(肌肉质量、快慢肌纤维含量、MHC蛋白水平和肌糖原含量)。
1 材料与方法
1.1 实验对象
48只6周龄的雄性SD大鼠,体重170~190 g,购于北京维通利华实验技术有限公司(合格证号:SCXK(京)2012-0001)。于上海体育学院动物实验室SPF级环境喂养,所有大鼠均自由饮水饮食。饲养环境温度控制在20~25℃,相对湿度为40%~70%,以及12h/12h的昼夜节律。
1.2 实验方法
1.2.1 实验分组
48只雄性SD大鼠随机分为6组(n=8):正常对照组(control,C)、氟他胺组(flutamide,F)、耐力训练组(endurance training,E)、耐力训练+氟他胺组(endur⁃ance training+flutamide,E+F)、抗阻训练组(resistance training,R)、抗阻训练+氟他胺组(resistance training+flutamide,R+F)。
1.2.2 氟他胺缓释片的包埋
正式运动干预前3 d,氟他胺包埋组(F组、E+F组和R+F组)大鼠在麻醉后,在其颈后部切一个0.5 cm的切口,将氟他胺缓释片(美国Innovative Rearch of Amer⁃ica,21天缓释片,50 mg/片)塞入颈部皮下(每只一片),缝合皮肤,完成氟他胺的皮下包埋[14]。C组、E组和R组做颈部切口后缝合,不包埋任何东西。
1.2.3 运动干预
C组和F组大鼠不进行任何运动干预,E组和E+F组大鼠进行耐力训练,R组和R+F组大鼠进行抗阻训练。耐力训练组大鼠采用中等强度的跑台运动(跑速20 m/min,每天1 h)。抗阻训练组的大鼠采用递增负荷的尾部负重爬梯训练,即大鼠被放置于爬梯(高1 m,每级阶梯间隔2 cm,倾斜85°放置)的底部,尾部负重进行爬梯训练,3组/d,4次/组,组间间隔20 s。以体重的40%作为起始负重,每2天递增10%体重的负荷,终负荷为体重的120%[15]。抗阻和耐力训练均是3周,每周训练6 d。
1.2.4 大鼠力量(最大力量、速度力量)和耐力的检测
于3周运动训练的最后1 d,进行力量的检测,包括反映最大力量的最大抓力、反映速度力量的启动时最大负重的检测。①最大抓力的检测:在大、小鼠的抓力检测仪(上海欣软信息科技有限公司)上,测试人员抓住大鼠的尾巴往后拉,大鼠会本能地抓住前方的抓杆。当测试人员的拉力超过大鼠最大的抓力时,大鼠松开抓杆,在松开即刻时仪器会自动记录并显示该最大抓力值,相对最大抓力(反映最大力量)=最大抓力/体重。②启动时最大负重的检测:大鼠尾巴上系一布条,布条后面连接重物,检测大鼠在地面上能够拖动重物(标准:拖动距离≥30 cm)的最大负重,启动时相对最大负重(反映速度力量)=启动时最大负重/体重。
力量检测1 d后,检测大鼠的一次力竭运动时间(跑台速度35 m/min),以反映其耐力。大鼠力竭的判断标准:连续对大鼠进行电刺激,大鼠不能继续跑,在暂停跑之后表现为呼吸非常急促、神情十分倦怠,大鼠在腹卧位状态下被捕捉时的逃避反应明显减弱。
1.2.5 血清睾酮水平和肌糖原含量的检测
运动干预后36 h,腹腔注射10%水合氯醛(3 ml/kg体重)麻醉大鼠,下腔静脉取血,离心收集血清,-80℃保存。大鼠取血后处死,取腓肠肌和比目鱼肌,置于-80℃保存。
血清睾酮水平的检测采用ELISA方法(试剂盒购于美国R&D公司),腓肠肌和比目鱼肌的肌糖原含量采用蒽酮法检测,均按试剂盒说明书进行操作。
1.2.6 腓肠肌和比目鱼肌的AR、MHC等蛋白水平检测
Western blot方法检测骨骼肌AR、MHC等蛋白水平。简要步骤为:取适量的腓肠肌和比目鱼肌剪碎,加入500 μl的含PMSF的RIPA裂解液(RIPA∶PMSF=100∶1,购于上海碧云天公司),机械匀浆后超声裂解组织,4℃14000 rpm离心20 min后取上清,用BCA试剂盒检测上清液中的蛋白浓度。将50 μg的待测样品进行聚丙烯酰胺凝胶电泳后,转移到PVDF膜上,5%脱脂奶粉封闭。之后,分别加入AR、MHC、慢肌钙蛋白(ss-TnT,1∶500,美国santa cruz公司)、快肌球蛋白(fs-myosin,1∶1000,美国abcam公司)和内参GAPDH(1∶1000,美国CST公司)的一抗4℃孵育过夜。TBST洗4次,加入相应的二抗(HRP标记,美国santa cruz公司),常温下孵育1 h,TBST洗4次后在Tanon 5200 Multi全自动化学发光/荧光图像分系统(上海天能科技有限公司)上显影。
1.3 统计学分析
实验数据用SPSS19.0软件包进行统计学分析处理,所得结果以均数±标准差(±s)表示。采用单因素方差分析比较C、F、R和R+F组,以及C、F、E和E+F组的各检测指标,用LSD-t检验进行事后的组间多重比较。P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 氟他胺对抗阻和耐力训练大鼠血清睾酮和骨骼肌AR蛋白水平的影响
2.1.1 氟他胺对抗阻和耐力训练大鼠血清睾酮水平的影响
如表1所示,与C组比较,R组、E组和F组大鼠的血清睾酮水平均升高(P<0.01)。R+F组与R组比较、E+F组与E组比较,大鼠的血清睾酮水平均无差异。
2.1.2 氟他胺对抗阻和耐力训练大鼠骨骼肌AARR蛋白水平的影响
如图1A显示,与C组比较,R组大鼠腓肠肌的AR蛋白水平增加(P<0.05),F组大鼠的则降低(P<0.05);与R组比较,R+F组大鼠腓肠肌的AR蛋白水平降低(P<0.01)。对于比目鱼肌,与C组比较,E组大鼠比目鱼肌的AR蛋白水平增加(P<0.05);与E组比较,E+F组大鼠比目鱼肌的AR蛋白水平降低(P<0.05)(图1B)。
2.2 氟他胺对抗阻和耐力训练大鼠运动能力的影响
2.2.1 氟他胺对抗阻和耐力训练大鼠力量(最大力量和速度力量)的影响
1980年2月24日,结束完一天的表演,夜深人静时,雨果撞向水池的墙壁,发出令人心惊的响声,“咚”“咚”“咚”,海洋馆的工作人员察觉到情况不对,以为雨果生病了,然而又想不出什么办法。之后几天,情况依旧,海洋馆的工作人员只好晚上派人观察水池里的情况。
如表2所示,与C组比较,R组大鼠的相对最大抓力(P<0.05)和启动时相对最大负重(P<0.05)均增加,但E组大鼠的上述两指标无变化,F组大鼠的相对最大抓力降低(P<0.05)。与R组比较,R+F组大鼠的相对最大抓力(P<0.05)和启动时相对最大负重(P<0.01)均降低。与E组比较,E+F组大鼠的相对最大抓力和启动时相对最大负重均无显著性差异。

表1 氟他胺对抗阻和耐力训练大鼠血清睾酮水平的影响

图1 氟他胺对抗阻训练大鼠腓肠肌(A)、耐力训练大鼠比目鱼肌(B)的AR蛋白水平的影响

表2 氟他胺对抗阻和耐力训练大鼠的相对最大抓力、启动时相对最大负重、一次力竭运动时间的影响
2.2.2 氟他胺对抗阻和耐力训练大鼠耐力的影响
如表2所示,与C组比较,E组大鼠的耐力(一次力竭运动时间)增加(P<0.01),但R组和F组大鼠的无改变。与E组比较,E+F组大鼠的耐力没有降低,甚至有增强的趋势,但无统计学差异(P=0.06)。
2.3 氟他胺影响抗阻和耐力训练大鼠运动能力的机制
2.3.1 氟他胺对抗阻和耐力训练大鼠体重的影响
实验前各组大鼠体重无显著性差异。3周运动干预后,与C组比较,E组(P<0.05)和F组(P<0.01)大鼠的体重降低,但R组大鼠的体重无变化。与R组比较,R+F组大鼠的体重降低(P<0.05)。与E组比较,E+F组大鼠的体重无变化(表3)。
2.3.2 氟他胺对抗阻和耐力训练大鼠腓肠肌和比目鱼肌相对质量的影响
2.3.3 氟他胺对抗阻训练大鼠腓肠肌、耐力训练大鼠比目鱼肌的快慢肌纤维含量的影响
如图3A所示,与C组比较,R组大鼠腓肠肌fs-my⁃osin的含量增加(P<0.05),而ss-TnT的含量无显著性差异;与R组比较,R+F组大鼠腓肠肌的fs-myosin含量减少(P<0.01)。对于比目鱼肌,与C组比较,E组大鼠比目鱼肌ss-TnT的含量增加(P<0.01)、而fs-myosin的含量无显著性差异;与E组比较,E+F组大鼠比目鱼肌的ss-TnT含量无变化(图3B)。

表3 氟他胺对抗阻训练和耐力训练大鼠体重的影响
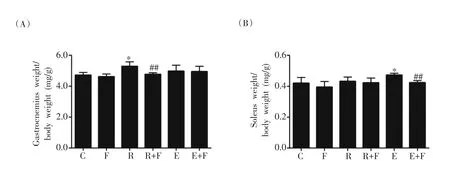
图2 氟他胺剂对抗阻和耐力训练大鼠腓肠肌(A)和比目鱼肌(B)相对质量的影响

图3 氟他胺对抗阻训练大鼠腓肠肌(A)和耐力训练大鼠比目鱼肌(B)的快慢肌纤维含量的影响
2.3.4 氟他胺对抗阻训练大鼠腓肠肌、耐力训练大鼠比目鱼肌MMHHCC蛋白水平的影响
如图4A所示,与C组比较,R组大鼠腓肠肌的MHC蛋白水平增加(P<0.01);与R组比较,R+F组大鼠腓肠肌的MHC蛋白水平降低(P<0.01)。对于比目鱼肌,与C组比较,E组大鼠的比目鱼肌MHC蛋白水平增加(P<0.01);与E组比较,E+F组大鼠比目鱼肌MHC的蛋白水平降低(P<0.01)(图4B)。

图4 氟他胺对抗阻训练大鼠腓肠肌(A)和耐力训练大鼠比目鱼肌(B)MHC蛋白水平的影响
2.3.5 氟他胺对抗阻训练大鼠腓肠肌、耐力训练大鼠比目鱼肌肌糖原含量的影响
如表4所示,与C组比较,R组大鼠腓肠肌(P<0.01)、E组大鼠比目鱼肌(P<0.01)的肌糖原含量均增加。与R组比较,R+F组大鼠腓肠肌的肌糖原含量降低(P<0.05)。与E组比较,E+F组大鼠比目鱼肌的肌糖原含量降低(P<0.01)。

表4 氟他胺对抗阻训练大鼠腓肠肌和耐力训练大鼠比目鱼肌肌糖原含量的影响
3 分析与讨论
3.1 氟他胺对训练大鼠雄激素和AR的作用
氟他胺是常用的AR阻断剂,主要通过其代谢产物2-羟基氟他胺(主要活性形式)在靶组织内与AR结合来阻断睾酮、双氢睾酮与AR结合,从而抑制AR活性[16]。本研究证实氟他胺逆转了抗阻训练所致腓肠肌、耐力训练所致比目鱼肌的AR蛋白水平的增加,但对抗阻和耐力训练大鼠血清睾酮水平的增加无显著影响,提示氟他胺除了文献报道的阻断AR与睾酮结合外,还能通过降低训练大鼠骨骼肌的AR蛋白水平,而非改变血清睾酮水平,来抑制AR信号发挥作用。此外,本研究还发现对于不训练的对照大鼠,氟他胺能显著增加其血清睾酮水平,这与早已报道的氟他胺增加前列腺癌等患者的血清睾酮水平类似[17]。
3.2 AR在抗阻训练增强力量、耐力训练增强耐力中的作用及机制
3.2.1 AR介导抗阻训练所致力量的增加,但不介导耐力训练所致耐力的增加
外源补充雄激素可以促进骨骼肌蛋白质合成,增加骨骼肌质量、增强肌肉力量[14,15],但外源补充雄激素的副作用限制了其广泛使用。近年来AR调节剂,特别是副作用少的组织特异性的新型非甾体类选择性AR调节剂已成为研究热点。已证实上调AR的调节剂能增加老年女性肌肉减少症患者的瘦体重(去脂体重)、肌肉质量和肌肉力量,提高身体机能[18];以及增加肌营养不良小鼠的体重、瘦体重和抓力[19]。
运动也是增加骨骼肌AR蛋白水平的一种上调剂[11,12]。本研究也发现运动训练选择性地增加骨骼肌AR蛋白水平(抗阻运动增加腓肠肌、耐力运动增加比目鱼肌的AR蛋白水平),且氟他胺逆转了抗阻训练所致最大力量和速度力量的增加,证实了抗阻训练增加大鼠力量的作用是通过AR介导的。但耐力训练增加大鼠的耐力很可能与AR无关,或至少AR不是主要因素(氟他胺不仅不降低耐力训练大鼠的一次力竭运动时间,还有延长的趋势,P=0.06,无统计学差异)。AR对力量和耐力作用的不同,在ARKO小鼠的研究中也得以证实。如某种全敲的ARKO小鼠的快肌如趾长伸肌质量降低、收缩力下降,而慢肌比目鱼肌尽管质量降低,收缩力却增强,而耐力有较小幅度的增加[13,20,21];再如某种骨骼肌特异性的ARKO(muscle-specific ARKO,mARKO)小鼠尽管四肢肌肉质量没有改变,但耐力增加(表现为力竭运动时间的延长,增加了109%)[22];以及另两种mARKO小鼠尽管肌肉质量下降,但趾长伸肌[6]或比目鱼肌的耐力却没有改变[5]。表明AR对力量的大小是关键因素,但对耐力无显著影响。
3.2.2 AR介导训练所致运动能力提高的机制
3.2.2.1 肌肉质量的增加
肌肉质量是影响运动能力的最主要骨骼肌因素,所以,文献常将肌肉收缩能力(如力量、耐力等)与肌肉质量放在一起讨论和报道。AR在肌肉质量、力量和耐力中的作用在不训练的安静ARKO小鼠上也得以证实。全敲的ARKO雄性小鼠出现了体重和瘦体重的减轻[23],且多个四肢骨骼肌如趾长伸肌、胫骨前肌、腓肠肌和比目鱼肌的质量均显著降低了15%~22%[20,21]。不仅肌肉质量下降,全敲的ARKO小鼠的快肌如趾长伸肌和中间态肌如腓肠肌的收缩力量也下降[13,20,21]。
但目前尚未见运动训练对ARKO小鼠运动能力和肌肉质量等影响的研究报道。本研究用AR阻断剂氟他胺证实了抗阻训练所致腓肠肌、耐力训练所致比目鱼肌的质量增加都是通过AR介导的。鉴于肌肉质量是影响肌肉收缩力的主要因素,以及AR在抗阻训练增加腓肠肌质量、大鼠最大力量和速度力量中的重要作用,推测抗阻训练所致腓肠肌质量的增加是大鼠力量增加的机制之一。然而,对于耐力,尽管AR介导了耐力所致慢肌比目鱼肌的质量增加,但氟他胺阻断AR后并不影响耐力(甚至有增加的趋势),该结果与全敲的ARKO小鼠的比目鱼肌尽管质量降低,但收缩力增强,耐力也有较小幅度的增加[13,20,21]相类似,表明慢肌的肌肉质量不是影响大鼠耐力的主要因素。
3.2.2.2 其他机制:快慢肌纤维含量的改变、MHC蛋白水平和肌糖原含量的增加
与全敲的ARKO小鼠不同,mARKO小鼠中很少出现肌肉质量下降,常表现为肌肉力量下降。如肌卫星细胞特异性的ARKO(satellite cell-specific ARKO,satAR⁃KO)小鼠,四肢肌肉的肌肉质量没有变化,但小鼠在生长过程中的多个时间点上(12周、16周、20周、32周和52周)后肢握力显著降低[13];再如mARKO小鼠,四肢肌肉质量也不改变,但其后肢握力也下降,且后肢握力始终保持低水平(尽管肌肉质量在青春期有增加),丧失了握力在青春期随年龄增加而增加、到24周时最大的特性[5]。进一步研究发现,20周大的该mARKO小鼠后肢握力的下降是由于快肌(如趾长伸肌)和中间态骨骼肌(如腓肠肌和胫骨前肌)的最大强直张力下降20%~25%所致,而慢肌(如比目鱼肌)的最大强直张力却没有改变[5]。以上研究表明,除肌肉质量这个主要影响因素之外,还有其他骨骼肌因素能影响运动能力。这包括快慢肌纤维的比例和含量、MHC蛋白水平以及肌糖原含量等,由于抗阻训练仅引起腓肠肌、耐力训练仅引起比目鱼肌的相对质量增加,因此,本研究仅检测了抗阻训练大鼠腓肠肌、耐力训练大鼠比目鱼肌的上述指标。
AR影响骨骼肌的快慢肌纤维的比例。无论是全敲的ARKO小鼠[21],还是组织特异性的ARKO小鼠[6,13]均出现快肌减少、慢肌增多,以及快/慢肌纤维比例的降低。目前最常用的检测快慢肌纤维含量和比例的方法是利用快慢肌纤维特异性荧光抗体的免疫组化。在mARKO的雄性小鼠中,免疫荧光显微镜证实了I型(相当于慢肌)肌纤维的增加和IIa型(相当于快肌)肌纤维的减少,其改变幅度都在10%左右[13]。此外,也有实验室利用Western Blot方法,用快慢肌纤维特异性抗体来检测快慢肌纤维的含量。Altuwaijri等人就是最早用此方法来证实全敲的ARKO雄性小鼠股四头肌的快肌纤维减少、慢肌纤维增多和快/慢肌纤维比例的降低[24]。我们的研究用fs-myosin和ssTnT的特异抗体分别来检测骨骼肌快慢肌纤维的含量,证实了氟他胺使抗阻训练大鼠腓肠肌的快肌纤维减少,但对耐力训练大鼠比目鱼肌的快慢肌纤维含量无显著影响(尽管有增加慢肌纤维的趋势,P=0.06,无统计学差异),表明抗阻训练增加大鼠腓肠肌的快肌纤维含量是通过AR介导的,但耐力训练增加比目鱼肌的慢肌纤维含量的作用不是通过AR介导,至少AR的介导不是主要因素。
有研究报道了AR阻断剂不仅显著降低安静大鼠趾长伸肌的MHC蛋白水平,也可逆转由跑台运动所致的趾长伸肌MHC水平的增加,说明AR介导了安静和运动引起的大鼠趾长伸肌收缩能力的增加[8]。我们的结果更进一步,证实了不同训练方式所致骨骼肌MHC蛋白水平的增加(抗阻训练增加腓肠肌、耐力训练增加比目鱼肌的MHC蛋白水平)都是通过AR介导的。
此外,睾酮能增加大鼠多种骨骼肌如趾长伸肌、比目鱼肌和腓肠肌的肌糖原含量,以及体外培养的骨骼肌细胞的肌糖原含量[25]。Ramamani A等人报道大鼠去势后咀嚼肌(咬肌),前臂肌肉(肱三头肌和肱二头肌),大腿肌肉(股外侧肌和股薄肌)和小腿肌肉(腓肠肌和比目鱼肌)的肌糖原含量均显著减少;且补充睾酮后,该大鼠的上述骨骼肌的肌糖原含量均显著增加[26]。ARKO小鼠的腓肠肌也出现肌糖原含量减少[9]。以上结果表明,雄激素及AR对保持和增加不训练的安静大、小鼠的多种骨骼肌肌糖原含量起重要作用。我们的研究证实了AR不仅增加不训练骨骼肌肌糖原含量,还能增加运动训练(抗阻训练增加腓肠肌、耐力训练增加比目鱼肌)大鼠的骨骼肌肌糖原含量。
4 结论
抗阻训练增强大鼠最大力量和速度力量的作用是通过AR介导的,其机制与腓肠肌相对质量、快肌纤维含量、内在收缩力和肌糖原含量的增加有关。但耐力训练增强大鼠耐力的作用可能与AR无关。耐力训练通过AR尽管介导了比目鱼肌相对质量、内在收缩力和肌糖原含量的增加,但不影响慢肌纤维的含量,这可能是氟他胺没有降低大鼠耐力的机制之一,但仍需进一步的研究证实。

