PI3K/Akt/mTOR信号通路在大鼠急性骨骼肌钝挫伤修复中的作用
张安宁 罗雪林 黄思琴 唐成林 赵丹丹罗翱 谭程方 代妮 于芒
1重庆医科大学中医药学院(重庆400016)
2重庆市南岸区龙门浩街道社区卫生服务中心(重庆 400064)
3斯坦福大学临床科学研究中心(美国加州 94305)
骨骼肌损伤是运动医学领域的常见损伤之一,其中急性骨骼肌钝挫伤较为常见[1],以股四头肌和腓肠肌的发病率最高[2],骨骼肌正常生理结构的破坏和运动功能障碍是其主要的预后及演变。骨骼肌损伤后,肌肉组织的修复和再生能力与诸多因素有关,如:生长发育的信号通路、调控基因、生长因子及细胞因子的活性改变等[3-4],以往关于骨骼肌钝挫伤模型的研究多集中在与骨骼肌损伤修复相关的生长因子及细胞因子等的时程变化趋势上[5-8],而关于磷酸肌醇三激酶(phos⁃phoinositide3-kinase,PI3K)/蛋白激酶 B (protein ki⁃nase B,Akt/PKB)/哺乳动物雷帕霉素靶蛋白(mammali⁃an target of rapamycin,mTOR)生长发育信号通路在骨骼肌损伤修复中的作用及机制研究的相关报道较少。本研究观察PI3K/Akt/mTOR蛋白合成途径在大鼠急性骨骼肌钝挫伤修复中的表达变化,及其对骨骼肌成肌分化抗原(myogenic differentiation antigen,MyoD)和肌细胞生成素(myogenin,MyoG)的调控作用,探索骨骼肌损伤的修复机制,以帮助临床医生及科研学者寻找最佳的治疗靶点和时间点,缩短疗程,从而减轻患者的痛苦及经济负担。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和分组
SPF(specific pathogen free)级健康成年雄性 SD(Sprague Dawley)大鼠36只,8~9周龄,体质量220~250 g,购于重庆医科大学实验动物中心,动物生产许可证号:SCXK(渝)2012-0001,实验过程中对动物的处置方法按照国家科学技术部2006年颁布的《关于善待实验动物的指导性意见》中的伦理标准实施[9]。分笼饲养于重庆医科大学SPF级动物房,每笼5只,室温22±2℃,相对湿度为55% ±5%,12 h昼夜交替,自由饮食。先将大鼠适应性喂养5 d,再按照方积乾《卫生统计学》(2012年,人民卫生出版社)[10]中随机数字表法分为正常组对照组和损伤后1 d、3 d、5 d、7 d、14 d组,每组6只。
1.1.2 主要试剂及仪器
PI3K(p85)一抗(北京博奥森生物技术有限公司),Akt一抗、P-AktSer473一抗、mTOR一抗、P-mTORS⁃er2448一抗(美国,Cell Signaling),免疫印迹相关试剂(上海碧云天生物技术有限公司),mmobilonTMWest⁃ern Chemiluminescent HRP Substrate发光液(美国,MILLIPORE公司),Trizol总RNA提取液、RR037A逆转录试剂盒、SYBR Premix Ex TaqTMⅡ、引物合成(日本,TAKARA公司)。电泳仪及电转仪(美国,BIO RAD公司,041BR121545),凝胶图像扫描及分析系统(北京赛智科技公司),AL204型电子天平(瑞士,METTLER TOLEDO公司),低温高速离心机(日本,SIGMA 公司),ThermoND2000超微量核酸蛋白测定仪(上海,GENE公司),T100™ PCR仪和CFX ConnectTM荧光定量PCR检测系统(美国,BIO RAD 公司),拍摄装置(日本,OLYMPUS公司,DP73),自制钝挫伤模型重物打击装置。
1.2 实验方法
1.2.1 造模方法
参考Markert[11]的方法,自行设计钝挫伤模型重物打击装置。打击参数:重物220 g,自由下落高度为110 cm,重力为2.16 N,打击头面积约为1 cm2,打击动能为2.37 J。先用10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,备皮,俯卧位,将右后肢伸膝,踝背屈90°,稍外展位固定,将造模器打击头紧贴腓肠肌肌腹中央偏外侧处,助手将实心钢球自由下落击中腓肠肌中段,红色记号笔标记损伤中心部位(每天加强标记)。造模成功后无皮肤破损和胫腓骨骨折,损伤处先可见局部凹陷,随后淤肿明显,且均在腓肠肌的中段。
1.2.2 取材方法
各组在相应时间点分别随机抓取6只大鼠,先用10%水合氯醛(3 ml/kg)腹腔注射麻醉大鼠,右腿保持造模时的姿势,在损伤处的上方做新标记(以便准确取到损伤组织),沿着新标记下方,用锋利的一次性刀片迅速取出损伤处腓肠肌组织,0.9%氯化钠溶液冲洗。各组的3只大鼠损伤处腓肠肌组织迅速置于液氮罐中1 h后移入-80℃冰箱储存,进行免疫印迹(Western blot,WB)及逆转录实时定量聚合酶链反应( reverse transcription real-time quantitative polymerase chain reaction,RT-qPCR)检测;余下的3只大鼠损伤处腓肠肌组织放入4%多聚甲醛中固定48~72 h,石蜡包埋切片,行HE染色。
1.2.3 HE染色方法
腓肠肌组织经4%多聚甲醛固定后,常规乙醇梯度脱水,二甲苯透明,石蜡包埋,横切4 μm;二甲苯脱蜡后水化,苏木精染色,盐酸酒精分化,伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片。以上过程均由重庆医科大学基础医学院组织切片室完成。在400倍光学显微镜下观察组织形态结构变化并采集图片。
1.2.4 免疫印迹法
分别取各个标本约30~50 mg,剪碎,加入适量蛋白裂解液、蛋白酶抑制剂和磷酸酶抑制剂后匀浆,配平、4 ℃、12000 r/min、离心15 min,取上清液,得到总蛋白;蛋白定量,取上清液配平后95℃煮沸10 min,使蛋白变性;用BIO RAD标准电泳装置SDS-PAGE电泳,转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,TBST洗膜后分别放入PI3K(p85)(1︰500)、Akt(1︰1000)、P-AktSer473(1︰1000)、mTOR(1︰1000)、P-mTORSer244(1︰1000)和GAPDH(1︰5000)一抗稀释液中孵育,4℃摇床,过夜;TBST洗膜,加入5%脱脂奶粉稀释的二抗中,摇床,室温反应1 h;TBST洗膜,加入发光液显色,凝胶成像系统成像。Image J对图像进行定量分析,以GAPDH作为内参。用目的条带光密度值与内参条带光密度值的比值作为目的蛋白的相对表达量。
1.2.5 逆转录实时定量聚合酶链反应
分别取各个标本约50 mg,剪碎,加Trizol 1 ml充分匀浆后提取总RNA;检测总RNA浓度及纯度后按逆转录试剂盒操作步骤配制10 μl反应体系,置于T100™PCR仪中进行逆转录反应;按照SYBR Green法配制Mix及反应体系后上机进行RT-PCR反应;通过CFX manager 3.1软件读取Ct值。以 Folds=2-ΔΔCt表示其余5组与正常对照组中目的基因表达的倍比关系,公式:ΔΔCt=[C(ttarget gene)-Ct(GAPDH)]损伤后1d/3d/5d/7d/14d组-[Ct(target gene)-Ct(GAPDH)]正常对照组,计算平均值。上下游引物序列见表1。

表1 待测基因引物序列
1.2.6 统计学方法
采用SPSS 21.0软件对各组数据进行统计学分析,各组数据结果用均数±标准差(±s)表示,组间采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验进行显著性分析,P<0.05表明差异有统计学意义。
2 结果
2.1 HE染色
由图1可见:正常对照组腓肠肌肌纤维横切面呈多边形,大小一致,排列整齐,分布均匀,胞浆嗜酸性(红色),细胞核嗜碱性(蓝色),分布于肌细胞边缘(图1A);损伤后1 d可见肌细胞变性坏死及明显的炎性细胞浸润(图1B);损伤后3 d可见新生的成肌细胞和肌管(图1C);损伤后5 d可见单核和多核肌管以及大量纤维结缔组织的形成(图1D);损伤后7 d和14 d可见新生肌细胞,间质中大量胶原纤维形成(图1E,F)。
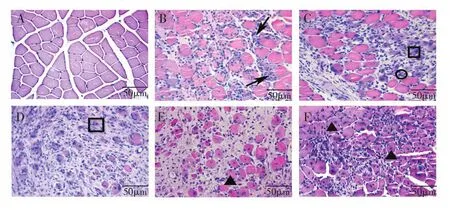
图1 各组大鼠腓肠肌HE染色结果(×400,标尺=50µm)
2.2 蛋白印迹检测结果
由图2、图3、表2、表3可见:损伤后各时间点中,PI3K、Akt、P-AktSer473、mTOR、P-mTORSer2448的表达量呈现逐渐升高后降低的趋势,在损伤后5 d达到峰值。与正常对照组比较,损伤后1 d、3 d、14 d组各蛋白表达量升高,但差异无统计学意义(P>0.05);损伤后5 d组PI3K、Akt、P-AktSer473表达量显著升高(P<0.01),mTOR、P-mTORSer2448表达量显著升高(P<0.05);损伤后 7 d组 PI3K、P-AktSer473、mTOR、P-mTORSer2448表达量显著升高(P<0.05),Akt表达量显著升高(P<0.01)。
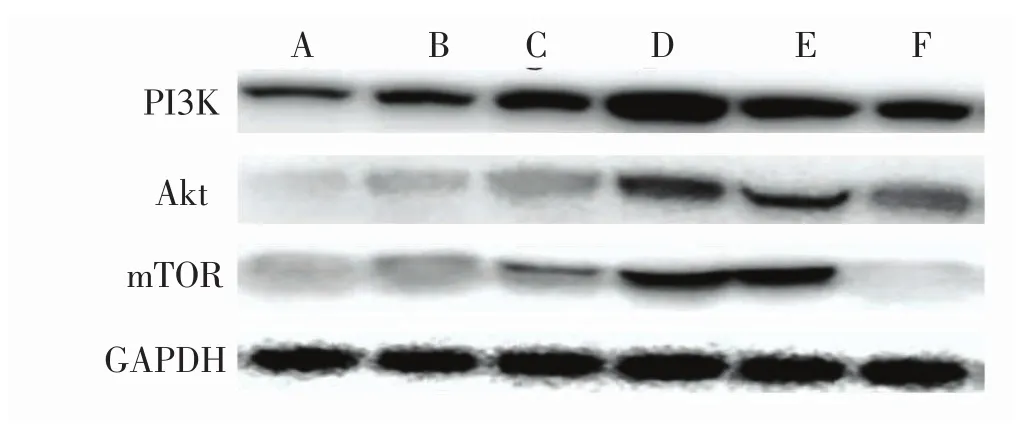
图2 各组大鼠腓肠肌PI3K、Akt和mTOR的免疫印迹图

表2 各组大鼠腓肠肌PI3K、Akt和mTOR表达水平比较(n=3)
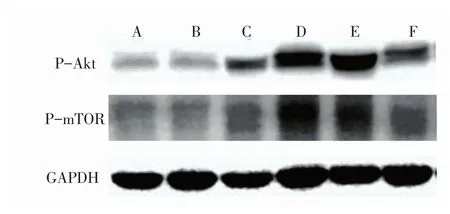
图3 各组大鼠腓肠肌p-Akt和p-mTOR的免疫印迹图
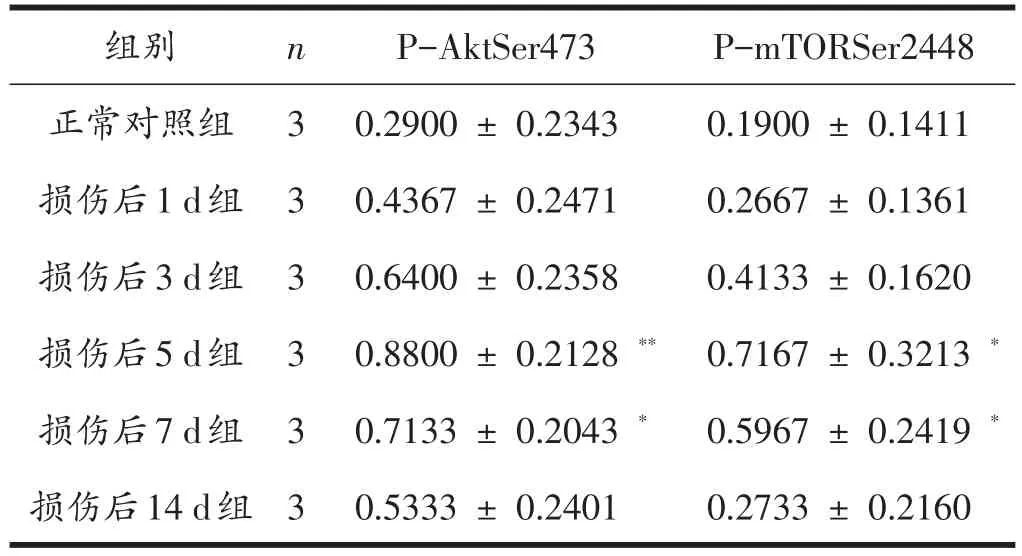
表3 各组大鼠腓肠肌p-AktSer473和p-mTORSer2448表达水平比较(n=3)
2.3 RT-qPCR结果
表4可见:损伤后各时间点中,MyoD1和MyoG的mRNA表达水平呈现逐渐升高后降低的趋势,损伤后3 d达到峰值。与正常对照组比较,损伤后1 d组MyoD1和MyoG的mRNA表达量显著升高(P<0.05,P<0.01);损伤后3 d、5 d、7 d组MyoD1和MyoG的mRNA表达量显著升高(P<0.01);损伤后14 d组myoG的mRNA表达量显著升高(P<0.05),myoD1 的mRNA表达量升高,但无统计学意义(P>0.05)。
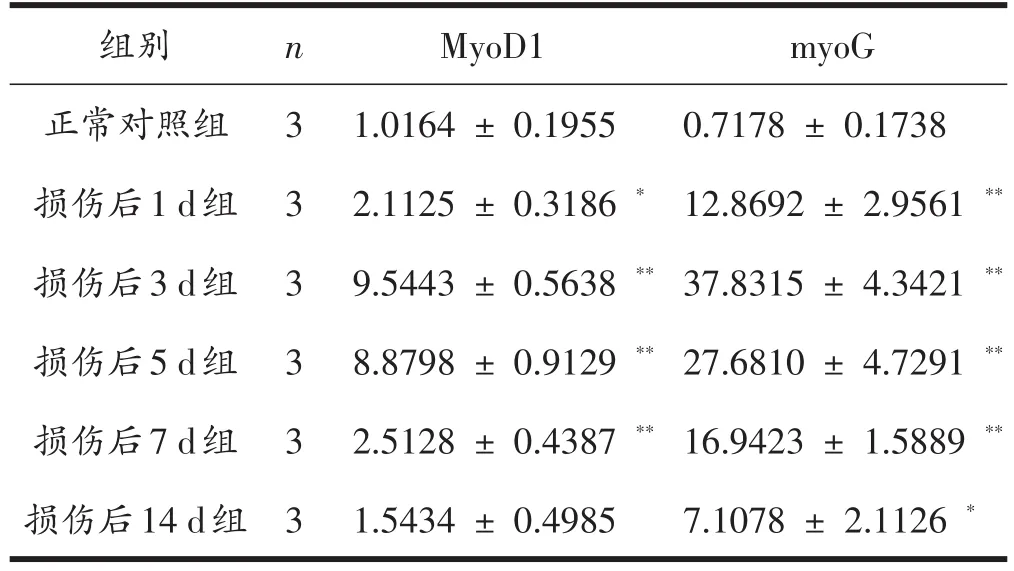
表4 各组大鼠腓肠肌MyoD1和MyoG的mRNA表达水平比较(n=3)
3 讨论
急性骨骼肌钝挫伤是体育运动中十分常见的接触性、非侵入性的损伤[12],本实验模拟此类骨骼肌损伤,以2.37 J的动能打击大鼠腓肠肌中段后使局部立刻凹陷,而后淤肿明显,皮温升高,患肢跛行。HE染色结果显示:骨骼肌损伤后1 d,肌细胞变性坏死,炎性细胞润;损伤后3、5 d可见成肌细胞和新生肌管;损伤后7、14 d可见新生的肌细胞和纤维结缔组织。该结果与相关文献报道具有一致性[5,6],充分表现了骨骼肌损伤的3个病理进程,即急性损伤炎症期、修复期和组织塑形期[13-14],表明模型的建立是成功的。骨骼肌损伤修复的病理进程离不开相应的基因、蛋白、生长因子及细胞因子等的调控[15],同时它们的启动和传导又需要信号通路的激活,其中PI3K/Akt/mTOR信号通路作为受体信号向细胞内传导的重要途径之一,具有调节细胞增殖、分化及蛋白合成等的功能。
PI3K属于磷脂酰肌醇激酶[16],同时具有磷脂酰肌醇激酶及丝/苏氨酸激酶的活性,是细胞内重要的信号传导物质。生理条件下,PI3K在细胞内表达较少,当细胞受到损伤时,生长因子、细胞因子、激素等细胞外信号分子激活[17-18],使PI3K表达迅速升高,在细胞膜上促进3,4-二磷酸磷脂酰肌醇(PIP2)转变为信使蛋白-3,4,5-三磷酸磷脂酰肌醇(PIP3),从而调控下游信号分子。蛋白激酶 B(Akt/PKB)是 PI3K的主要下游信号分子,属于丝/苏氨酸蛋白激酶,处于PI3K/Akt/mTOR信号通道的核心地位。PI3K激活后在细胞膜上产生了作为第二信使的PIP3,招募含有PH结构域的Akt信号蛋白和磷酸肌醇依耐性蛋白激酶1(PDK1),由PDK1磷酸化Akt的Thr308位点,再通过PDK2二次磷酸化Akt的Ser473位点,从而完全活化Akt[19-20],激活后的Akt再次转移至细胞质或细胞核内,继续调控其下游的靶分子。mTOR是哺乳动物雷帕霉素靶蛋白,属于磷脂酰肌醇激酶相关激酶(PIKK)家族,是多条信号通路的汇聚点,激活后的Akt可磷酸化mTOR的 Ser2448位点,直接活化mTOR,或通过抑制结节性硬化复合物1/2(TSC1/TSC2)而间接激活mTOR,再调控下游的靶蛋白[21],从而发挥广泛的生物学效应。目前,大部分关于骨骼肌与PI3K/Akt/mTOR信号通路的研究多集中在参与骨骼肌萎缩的代偿过程,在骨骼肌损伤修复中的作用及具体效应时间方面鲜有报道[22-23]。本研究发现PI3K/Akt/mTOR信号通路活性变化与骨骼肌钝挫伤的自我修复之间存在时间相关性,各目的蛋白表达量呈现先升高后降低的趋势,在损伤后5 d达到峰值(P<0.01,P<0.05)。从损伤后1 d开始该通路被激活,表达高于正常对照组,但差异无统计学意义(P>0.05),提示骨骼肌细胞接受损伤刺激信号后,在相关的生长因子、细胞因子以及炎症刺激的作用下,PI3K/Akt/mTOR信号通路已开始被激活;损伤后的第5 d和7 d,此时模型组PI3K蛋白表达显著高于正常对照组(P<0.05),并且模型组Akt和mTOR的总蛋白含量均显著高于正常对照组(P<0.05),尤其是能代表该通路激活状态的模型组P-AktSer473和P-mTORSer2448也均显著增加(P<0.05),虽然本实验未对P-AktThr308进行检测,但是只有完全活化的Akt才可激活mTOR的活性,提示PI3K/Akt/mTOR信号通路在骨骼肌损伤修复的关键时期处于完全激活状态,并且HE染色可见大量新生肌管和肌细胞的出现,因此该信号通路参与骨骼肌损伤后相关蛋白的合成及自我修复过程;损伤后14 d,该通路活性表达降低,接近正常生理状态,组织形态可见再生的骨骼肌细胞逐渐成熟,瘢痕组织形成,提示骨骼肌损伤修复进入组织塑形期,该信号通路的作用效应降低。
肌卫星细胞是一群具有自我更新能力的肌肉前体细胞,在骨骼肌损伤后肌肉组织的修复中发挥了重要作用[24-25]。在这一过程中,生肌调节因子(MRFs)扮演了重要的角色,MRFs家族包括了4种肌肉特异性转录因子:Myf5、MyoD、MyoG、和MRF4,其共同调控肌细胞的增殖和分化。作为初级分化因子的MyoD(基因名称为MyoD1)主要调控成肌细胞的增殖及分化[26];作为次级分化因子的MyoG调控新生肌管的终末分化[27],使新生肌细胞最终转化为表达MyHC的成熟肌管,发挥骨骼肌纤维的生物学功能,因此MyoD和MyoG在骨骼肌组织成肌分化中发挥了重要作用。本研究结果显示MyoD1和MyoG的mRNA表达也呈现先升高后降低的趋势,均在损伤后3 d达到峰值,与正常对照组比较,差异有统计学意义(P<0.01),这一过程表明PI3K/Akt/mTOR信号通路的表达变化与MyoD1和MyoG的mRNA的趋势大体一致,提示该通路的激活还可调节肌卫星细胞的增殖与分化,这一点对我们研究骨骼肌损伤修复进程具有重要意义。有学者发现,雷帕霉素(rapamycin)抑制 mTORC1信号通路,最终可以抑制成肌细胞的分化[28];在骨骼肌卫星细胞中特异性敲除mTOR会抑制Pax7和成肌因子的转录和翻译,从而抑制肌卫星细胞的增殖及分化[29];并且阻断PI3K/Akt通路后,成肌分化标志基因 MyoD1、MyoG 和 MyHC的表达可降低,抑制骨骼肌细胞的分化[30]。 本研究的结果与他人研究基本相符,该信号通路可正向调控骨骼肌损伤后的成肌分化。
4 结论
PI3K/Akt/mTOR信号通路在各种细胞中广泛存在,对细胞的生长、增殖、分化等过程的调节具有十分重要的价值。本研究中该通路在骨骼肌损伤后的激活及时程变化趋势为科学研究提供了一个新思路,即通过干预PI3K/Akt/mTOR信号通路的时程变化趋势,调控成肌分化标志因子的表达,从而研究加快骨骼肌损伤后修复的可能生物学机制。

