耐力运动对营养性肥胖大鼠Galectin-3表达的影响
李志刚 林文弢
1百色学院(广西百色 533000)
2广州体育学院(广东广州 510500)
能量摄入过多和运动不足导致的肥胖在全球范围内呈高发态势,肥胖可引起胰岛素抵抗(insulin re⁃sistance,IR),而IR是代谢综合征的核心特征和共同危险因素[1]。然而,有关肥胖引起的IR的机制尚不明晰。IR的免疫学机制研究提示,Cd11c+巨噬细胞诱发的慢性炎症可直接导致IR,来自肥胖小鼠Cd11c+巨噬细胞含大量的半乳糖凝集素3(Galectin-3,Gal-3)[2]。新近研究发现[3],高脂饮食喂养的肥胖小鼠血液中Gal-3的含量异常升高。Gal-3直接作用于胰岛素的三大靶器官,抑制肌肉和脂肪组织中胰岛素介导的葡萄糖摄取,诱发肝脏葡萄糖的生成。究其机制,Gal-3通过C端的碳水化合物识别区域与糖基化的胰岛素受体结合,降低其酪氨酸磷酸化,从而干扰胰岛素信号通路,最终导致IR。靶向Gal-3的研究发现,敲除Gal-3基因和Gal-3抑制剂都能明显改善肥胖小鼠的IR。肥胖病人血液中Gal-3水平显著增加,同时Gal-3能诱发人类肌细胞IR。但前期亦有研究发现Gal-3敲除肥胖小鼠体重、内脏脂肪含量、快速血糖和胰岛素水平以及胰岛素抵抗指数等指标均高于普通肥胖小鼠[4]。因此,肥胖机体中Gal-3水平升高或降低结论并未完全一致。体力活动尤其是耐力运动能够较好地改善肥胖机体的IR,但运动干预Gal-3表达的研究鲜见报告,运动能否通过改善肥胖机体的炎症反应,影响Gal-3的表达,从而改善肥胖机体的IR尤未可知。因此,本研究以营养性肥胖大鼠为实验对象,探寻肥胖对机体Gal-3的影响态势,探讨耐力运动对肥胖大鼠Gal-3表达水平的影响,为明确肥胖机体IR的发生机制提供一定的实验基础,丰富体育科学领域运动改善IR的理论。
1 研究对象和方法
1.1 实验对象
6周龄雄性SD大鼠30只,SPF级,体重172.36±10.25 g,购自南方医科大学动物实验中心,许可证号:SCXX(粤)2011-0015。大鼠分笼饲养,4只/笼,环境温度22~26℃,相对湿度45%~55%,自然光照。每天定时喂食喂水,自由饮食、饮水。记录每天的摄食量,每周1次定时称重。
1.2 动物分组及干预方案
将大鼠随机分为普通饲料喂养组(N组,n=8)和高脂饲料喂养组(HFD组,n=22)。N组喂养基础饲料,HFD组给予高脂饲料喂养。饲料均购于广东省医学实验动物中心,高脂饲料热量比为:蛋白质17.5%,脂肪37%,碳水化合物45.5%,热量为4.5 kcal/g。高脂喂养8周后,以超过N组大鼠平均体重20%为标准[7],HFD组满足条件的大鼠为16只,从中随机选取8只及N组大鼠,测量体重、体长,计算Lee’s指数(计算公式:体重(g)1/3/体长(cm)×103);眼眶取颞浅静脉血,京都血糖试纸测量血糖浓度;分离血清后,半自动生化分析仪测量血脂四项。将所得数据进行统计学分析,验证营养性肥胖大鼠建模是否成功[5]。营养性肥胖大鼠建模成功后,随机分成2组,安静对照组(C组,n=8)和耐力运动组(E组,n=8),两组大鼠体重无统计学差异(P>0.05),继续高脂喂养。E组大鼠进行8周的中等强度耐力运动,具体方案:坡度为0°,20 m/min,40 min/d,5 d/w,正式运动前先进行1周的适应性训练,N组和C组不进行运动。运动干预过程中,每周定时进行体重、体长的测量,并记录每日摄食量,测算摄食热量。
1.3 动物取材及检测
8周干预结束后,3组大鼠禁食12 h后,测量体重、体长,并计算、Lee’s指数,腹腔注射10%水合氯醛(按照0.3 ml/100 g体重计算注射量),腹主动脉取血,测量血糖,采血管室温静置30 min后,3000r/min,4℃离心15 min后,取上清液。采集大鼠的内脏脂肪(肾周脂肪、附睾脂肪和肠系膜脂肪),计算内脏脂肪百分比。ELISA法检测各组大鼠血清Gal-3、Leptin和Insulin浓度,Gal-3ELISA试剂盒购自Thermo公司,Leptin和In⁃sulin的ELISA试剂盒够自Millipore公司。GPO-PAP法测定甘油三酯,COD-PAP法测定总胆固醇,磷钨酸镁沉淀法测定高密度脂蛋白胆固醇,聚乙烯硫酸沉淀法测定低密度脂蛋白胆固醇,胰岛素抵抗指数(HOMAIR)=空腹血糖( mIU/L) ×血清胰岛素(mmol/L)/22.5。
1.4 统计学方法
采用SPSS22.0和Graphpad prism5进行统计分析。实验数据用平均数±标准差(±s)表示,两组比较采用独立样本t检验;三组比较采用单因素方差分析,方差齐性条件下,事后两两比较采用LSD检验,三组大鼠摄入热量的差异采用的是重复测量方差分析;相关性检验采用Pearson直线相关,P<0.05表示有统计学意义。
2 实验结果
2.1 营养性肥胖模型的建立
2.1.1 高脂膳食和普通饲料喂养大鼠体重和LLeeee’ ss指数比较
8周高脂饲料喂养后,HFD组大鼠体重显著高于N组(P<0.05);HFD组体长大于N组,但差异不显著(P>0.05);HFD组Lee’s指数显著高于N组(P<0.05)(表1)。

表1 两组体重和Lee’s比较
2.1.2 高脂膳食和普通饲料喂养大鼠血糖和血脂四项比较
8周高脂饲料喂养后,HFD组大鼠空腹血糖水平显著高于N组(P<0.05);HFD组血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇浓度较N组显著升高(P<0.05),高密度脂蛋白胆固醇浓度显著降低(P<0.05)(表2)。

表2 两组血糖和血脂四项比较(单位:mmol/L)
2.2 8周干预后各组大鼠血脂代谢和胰岛素抵抗情况
2.2.1 8周干预后各组大鼠体重、Lee’ s指数、内脏脂肪百分比、摄食热量比较
如图1所示,8周干预后,C组和E组大鼠体重显著高于N组大鼠(P<0.05),C组大鼠体重大于E组,但无统计学意义(P>0.05)。3组大鼠Lee’s指数比较结果为C组>E组>N组,但差异无统计学意义(P>0.05)。C组大鼠内脏脂肪百分比显著高于N组和E组(P<0.05),E组高于N组但无统计学意义(P>0.05)。干预开始阶段3组大鼠的平均摄入能量差别不大,随后,E组大鼠的能量摄入水平出现下降趋势,3周后日均摄入总热量E组大鼠显著小于N组和C组(P<0.05),5周后N组和E组大鼠的日均摄入热量显著低于C组(P<0.05),干预第8周的日均摄入热量C组>E组>N组(P<0.05)。
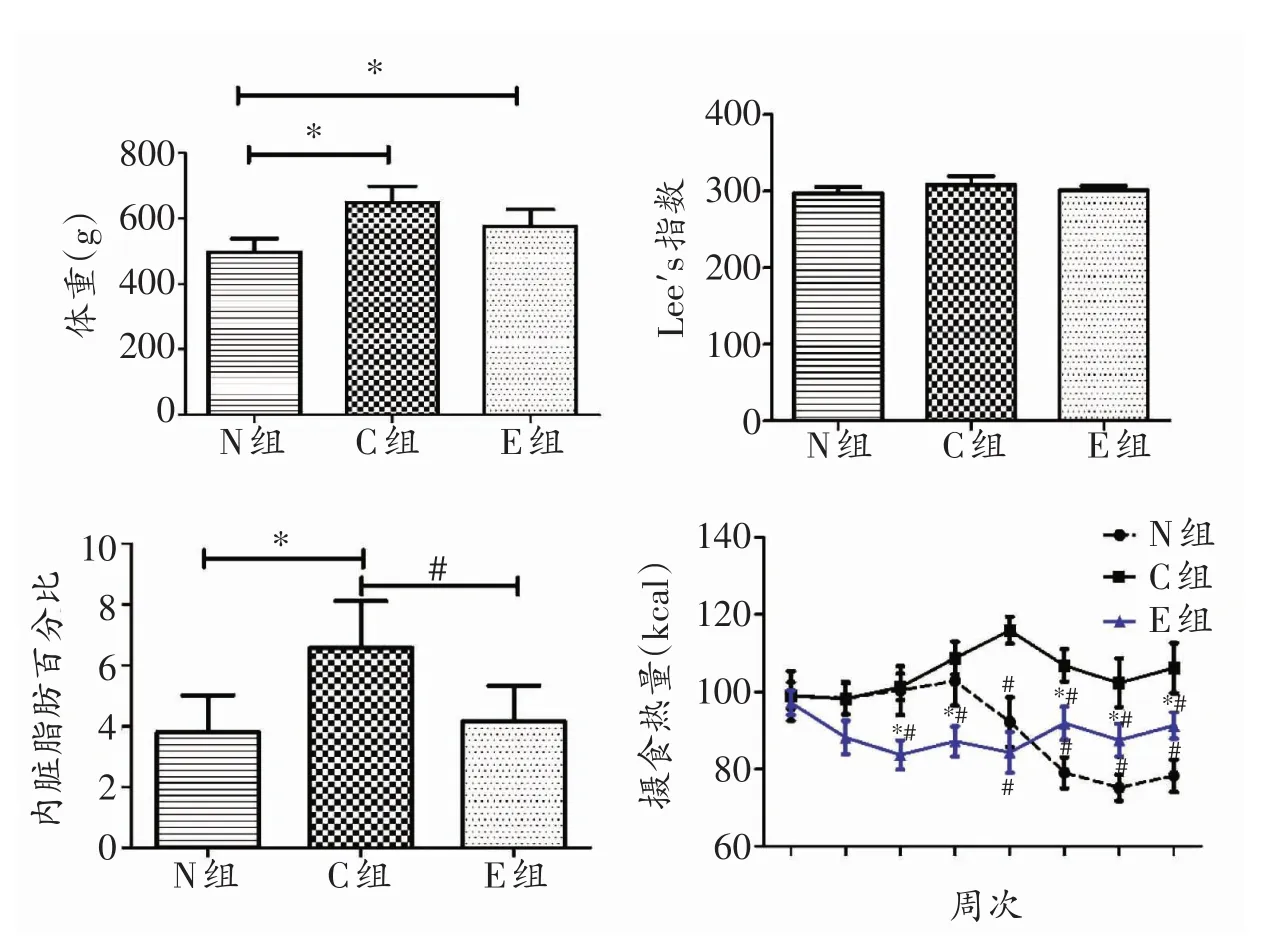
图1 8周干预后各组体重、Lee’s指数、内脏脂肪百分比、摄食热量比较
2.2.2 8周干预后大鼠血液Gal-3、Leptin浓度、IR和血脂四项比较
如图2所示,8周干预后,C组大鼠血清Gal-3浓度显著高于N组和E组(P<0.05);C组大鼠血清Leptin浓度显著高于N组和E组(P<0.05);HOMA-IR水平C组>N组>E组,其中C组与E组比较差异有统计学意义(P<0.05)。

图2 各组大鼠血清Gal-3、Leptin浓度和HOMA-IR比较
如图3所示,8周干预后,C组和E组大鼠甘油三酯水平显著高于N组(P<0.05),E组显著低于C组(P<0.05);C组大鼠总胆固醇水平显著高于N组(P<0.05),E组与N组无显著性差异,E组显著低于C组(P<0.05);C组大鼠低密度脂蛋白胆固醇水平显著高于N组和E组;C组高密度脂蛋白胆固醇水平最低,E组显著高于其它两组(P<0.05)。

图3 各组大鼠血脂四项比较
2.2.3 Gal-3与体重、Leptin浓度和HOMA-IR相关性检验
表3显示,8周干预后,Gal-3浓度与体重、Leptin浓度和HOMA-IR都存在显著正相关(P<0.05),其中与HOMA-IR的相关系数最高,为0.74;体重与Leptin浓度和HOMA-IR呈显著正相关(P<0.05),与HOMA-IR的相关系数最高,为0.75;Leptin浓度与HOMA-IR有一定相关,但无统计学意义(P>0.05)。

表3 Gal-3与体重、Leptin浓度和HOMA-IR相关系数
3 讨论
3.1 营养性肥胖大鼠模型成功建立
肥胖是由遗传和环境共同引起的一种体内能量代谢失衡的状态,主要表现为内脏脂肪的增多。过多的白色脂肪堆积,一方面使脂肪组织细胞缺氧死亡,呈现低度炎症状态,进而促使多种炎症因子的释放,导致IR的发生;另一方面,血液中游离脂肪酸的含量升高,使机体氧化应激增多引起IR[6]。IR是多种慢性疾病发生的高危因素,会增加糖尿病、高血压、动脉硬化以及多种癌症的发生率和死亡率。目前,大鼠肥胖模型主要有自发性肥胖模型、转基因动物模型、生命早期干预形成的肥胖动物模型和营养性肥胖动物模型,其中后者与人类肥胖的状态最为相似,可用于高热量食物摄入引起的肥胖症的研究。营养性肥胖大鼠模型的判断标准并未统一,通常以高脂饲料喂养组体重超过基础饲料喂养组体重20%为依据[7],Lee’s指数显著性升高,同时血液中甘油三酯、总胆固醇和低密度脂蛋白胆固醇显著升高,高密度脂蛋白胆固醇显著降低,合并血糖显著性升高。本实验中,经过8周的高脂饲料喂养,70%左右的HFD组大鼠体重高于N组大鼠体重20%,且Lee’s指数有显著性提高;另外,NFD组大鼠血糖、血清甘油三酯、总胆固醇和低密度脂蛋白胆固醇均显著高于N组大鼠,而高密度脂蛋白胆固醇显著低于N组大鼠与多项高脂饲料诱导的肥胖大鼠模型[8,9]结果相似,且表现出30%左右的肥胖抵抗[10],符合大鼠肥胖的规律,因此可以判定营养性肥胖大鼠模型建立成功,可进行进一步的干预实验。
3.2 高脂饮食对肥胖大鼠Gal-3表达的影响
Gal-3是半乳糖苷凝集素进化的保守家庭一员,可作为晚期糖基化终产物(advancedglycation end-prod⁃ucts,AGEs)的受体发挥作用,与血糖、胰岛素抵抗、糖尿病心血管并发症的发生、发展密切相关[11]。Kraut⁃bauer[12]等采用以高脂饲料喂养的肥胖小鼠为实验对象,发现Gal-3在小鼠肝脏、棕色脂肪、皮下和内脏脂肪中的含量升高。游离脂肪酸和IL-6增加了脂肪细胞中Gal-3的表达,由此可见,肥胖机体中的炎症状态是促进Gal-3表达升高的作用因素。Jin等[13]的研究结果表明,2型糖尿病合并血管疾病患者血浆中的Gal-3水平明显高于无并发症的糖尿病患者,Gal-3与糖化血红蛋白和糖尿病病程显著相关。糖尿病患者与正常人相比血浆中的Gal-3水平显著升高,并且Gal-3与空腹血糖、糖尿病病程有明显相关性[14]。Yilmaz等[15]的研究证明,Gal-3水平在糖尿病组最高,其是一个有效的诊断糖尿病和糖尿病前期的生物学指标。因此,Gal-3在糖尿病的发生、发展和诊断中作用明显,但其作用机理并未明晰。近期,Lipingping[2,3]团队证实,在肥胖机体低度炎症环境下,活化的巨噬细胞分泌Gal-3增加,Gal-3可以占用结合胰岛素受体,降低胰岛素的功效,进而引起IR,促进2型糖尿病的发生。而2型糖尿病高糖、高胰岛素微环境可能促进小鼠胰腺星状细胞活化、增殖、细胞外基质生成和Gal-3表达,在一定程度上可导致胰腺纤维化[16],加重了糖尿病的发生程度。然而,Pejnovic[4]等和Arsenijevic[17]等在研究中观察到Gal-3敲除肥胖小鼠体重、内脏脂肪含量、快速血糖和胰岛素水平以及胰岛素抵抗指数和系统炎症指标均高于普通肥胖小鼠,Gal-3敲除加剧了高脂饮食引起的肥胖和糖尿病。Ohkura等[18]发现糖尿病患者血清Gal-3与血清脂联素水平呈正相关,但是与高灵敏的C感应蛋白和IL-6、IL-10不相关,而血清中低Gal-3与2型糖尿病患者的胰岛素抵抗有关。其与Li团队的研究结果不符。由此推测,Gal-3在机体胰岛素抵抗的调节方面是否存在双向调节机制,仍需大样本的实验验证。本实验结果表明,16周高脂饲料喂养后,C组大鼠血清Gal-3、Leptin水平显著高于N组大鼠,HOMA-IR指数也高于N组大鼠,同时Gal-3水平与体重、Leptin浓度和HOMA-IR指数都存在显性相关。由此可知,本实验中营养性肥胖能够促使大鼠血清中Gal-3水平升高和IR的发生,与Li等研究成果相似,支持肥胖导致Gal-3升高并与IR发生相关的论断。
3.3 耐力运动对肥胖大鼠Gal-3的影响
耐力运动可抑制脂肪组织的堆积,降低炎症,稳定血糖,改善骨骼肌、脂肪组织的胰岛素敏感性,对代谢综合征症状具有明显的改善作用[19,20]。主要作用机制有:(1)有氧运动能够增加骨骼肌的血流量及增加GLUT4和IRS-1的表达量,增强葡萄糖的转运活性,改善糖耐量[21]。(2)耐力运动能够增加肌糖原的消耗和合成,激活PI3K和Ras的活性,增强胰岛素受体酪氨酸磷酸化,促进胞内糖代谢。(3)耐力运动使肌肉组织中脂蛋白酶的活性明显提高,促使低密度脂蛋白胆固醇降低,高密度脂蛋白胆固醇升高,促进脂肪分解,使血糖趋于正常[19]。(4)长期耐力运动可抑制骨骼肌中促炎因子的基因表达,同时,AMPK/SIRT1/NF-κB炎症信号通路的被抑制效应得到缓解,进而改善胰岛素抵抗[22]。本实验中,8周的耐力运动后,高脂喂养的E组大鼠的体重与C组比较,差异虽无统计学意义,但仍可见明显的下降,在Lee’s指数差别不大,内脏脂肪百分比明显下降的情况下,说明运动后的大鼠体型更加修长。另外,血脂四项中甘油三酯、总胆固醇和低密度脂蛋白胆固醇水平显著低于不运动的C组大鼠,而高密度脂蛋白胆固醇则显著升高。耐力运动增加肥胖大鼠能量输出的同时也抑制了能量的摄入水平,E组大鼠的平均热量摄入在运动期间一直低于C组。由此可见耐力运动对营养性肥胖大鼠降脂减肥作用显著。另外,E组大鼠的Leptin水平和HOMA-IR指数显著低于C组大鼠,说明本实验中8周的耐力运动改变大鼠肥胖状态的同时降低了Leptin抵抗和IR。同时,实验结果表明耐力运动降低了营养性肥胖大鼠血清中Gal-3的浓度,而Gal-3可作为判别IR的标志物之一,更说明了耐力运动改善肥胖机体IR状态的作用。Gal-3在肥胖状态下能够结合能量代谢旺盛细胞表面的胰岛素受体,阻碍胞内一系列相关的能量代谢信号通路,尤其是降低葡萄糖的摄取和利用[3]。另外,耐力运动能够促进机体能量消耗,降低脂肪的堆积,改善机体的炎症状态从而抑制Gal-3的生成和分泌。同时,运动能够增加骨骼肌细胞等胰岛素受体底物和GLUT4等表达量,进一步提高对葡萄糖的消耗,增加耐受性,改善IR。综上所述,耐力运动可能通过多种途径改善营养性肥胖大鼠的肥胖状况,降低Gal-3表达,并可能通过Gal-3途径改善肥胖大鼠的IR水平,丰富了耐力运动改善肥胖机体IR的作用途径,为相应的药物治疗和运动疗法提供理论依据。
4 结论
4.1 高脂饲料喂养的肥胖大鼠血清Gal-3水平高于普通食物喂养大鼠。
4.2 8周的中等强度耐力运动是引起血清Gal-3水平降低的可能因素,有助于改善营养性肥胖大鼠的IR。

