运动性免疫抑制及其干预措施研究进展
覃飞 赵杰修 王松涛 郝选明
1暨南大学体育学院(广州 510032)
2国家体育总局体育科学研究所(北京 100061)
3华南师范大学体育科学学院(广州 510006)
运动免疫学领域的研究已证实,不同强度的运动对机体免疫机能会产生不同的影响。如“J形曲线”所示[1],规律性的适中强度体育锻炼可以提升机体的免疫功能,增强对感染性疾病的抵抗能力。而一次性大负荷运动或长期大强度运动训练则对机体免疫功能产生非常强烈的抑制作用,导致各种感染性疾病的易感性增加,即发生运动性免疫抑制(exercise-induced immu⁃nosuppression,EIS),主要表现为上呼吸道感染、消化道感染、哮喘等感染性和过敏性疾病的发病率升高[2-5]。由于运动员在备战比赛或比赛期间出现EIS,会直接影响运动能力和比赛成绩,因此,近年来EIS对机体免疫功能的影响及其相关机制已成为运动免疫学的研究热点,同时EIS的各种调理手段也成为运动医学研究的重要问题。
1 运动性免疫抑制的流行病学研究
运动医务监督实践和运动员流行病学研究对运动员常见病的大量报道揭示,训练和比赛与感染性疾病的发生存在一定的联系。2016年里约热内卢夏季奥运会伤病调查指出:所有参与调查的运动员至少在一个月内有患病历史,其中上呼吸道感染最为常见[2]。2014年索契冬奥会的伤病调查发现:比赛期间9%的运动员患病,其中64%为呼吸系统疾病,58%为感染性疾病[3]。2013年巴塞罗那游泳世锦赛伤病报告指出:9%的在册运动员患病,其中最常见的是胃肠道感染性疾病[4]。2012年伦敦夏季奥运会伤病调查的结果显示:女性运动员患病人数高于男性,且上呼吸道感染患病率居于首位[5]。对随后举行的伦敦夏季残疾人奥运会伤病调查亦发现:比赛期间有10.9%运动员患病,其中上呼吸道感染(27.4%)、皮肤及皮下组织损伤(18.3%)、消化道疾病(14.5%)分列前三位[6]。2012年赫尔辛基欧洲田径锦标赛、2011年欧洲室内田径锦标赛(巴黎站)的运动员健康调查均发现,最常见的疾病为上呼吸道感染、消化道疾病和哮喘[7-8]。Robson-Ansley的调查发现:在2010年伦敦马拉松比赛的280名选手,赛后患上呼吸道感染的人数高达47%[9]。
上述流行病学调研结果说明,运动员免疫机能下降所诱导的感染性疾病,特别是上呼吸道和消化道感染性疾病是运动员长期大强度训练和重大比赛期间影响其运动能力和比赛成绩的最常见健康问题[10],提示这种情况可能与EIS存在紧密联系。
2 运动性免疫抑制的实验性研究
大量研究证实,EIS常发生在一次性大强度运动后3~72 h[1,11],或大强度长期训练前期(运动负荷不适应)及运动训练后期(运动性疲劳积累)[11,13],因此,运动员在训练或赛后更易发生EIS,导致感染性疾病发生率升高。大量研究数据表明EIS发生发展过程中与黏膜免疫功能[15-19]、免疫细胞及其亚群变化[26-32]、细胞因子变化密切相关[35-36],因此对近年来相关试验性研究进行分类综述。
2.1 大强度运动对黏膜免疫系统的影响
人体黏膜表面积约400 m2,分布于皮肤、呼吸道、消化道、泌尿道和一些外分泌腺等体表和与外界相通的管腔内,是机体第一道免疫防御屏障,共同组成一个相互联系的复杂的网络体系“共黏膜免疫系统”(com⁃mon mucosal immune system,CMIS)[11]。CMIS通过抗原递呈诱发的系列反应和与生俱来的非特异性防御系统,一同对病原体、过敏原和抗原进行防御,实现对机体的保护。CMIS主要包括:肠道相关淋巴组织(gut as⁃sociated lymphoid tissue,GALT)、支气管淋巴组织(bronchial associated lymphoid tissue,BALT)、唾液腺和鼻相关淋巴组织(nasal associated lymphoid tissue,NALT)、泌尿生殖道相关淋巴组织(urogenital associat⁃ed lymphoid tissue,UALT)、泪腺和哺乳期乳腺等[12]。其中分泌性免疫球蛋白A(secretory immunoglobulin A,sIgA)在黏膜免疫调控中起主要的效应作用,研究发现[13-14]高水平的唾液sIgA分泌量与上呼吸道感染的低发病率相关,而sIgA分泌水平下降,上呼吸道感染等相关疾病的易感性则上升。
黏膜免疫系统按照功能不同可分为:诱导部位(由扁桃体、肠黏膜集合淋巴小结等构成)和效应部位(固有层内淋巴细胞、上皮内淋巴细胞和一些相关的外分泌腺,如泪腺、唾液腺和乳腺等),两者通过淋巴细胞归巢发生联系。即,来源于中枢免疫器官骨髓和胸腺的初始淋巴细胞,通过血流进入黏膜免疫系统(MIS)诱导部的黏膜相关淋巴组织内,在此淋巴细胞可能接触递呈的外源抗原,从而活化进入效应状态,活化的效应淋巴细胞通过淋巴液离开诱导部流入肠道,最终汇集到胸导管,逐步分化成熟,在特异性归巢受体的介导下,由此进入血液循环并分布至抗原致敏部位及全身(见图1)[11]。
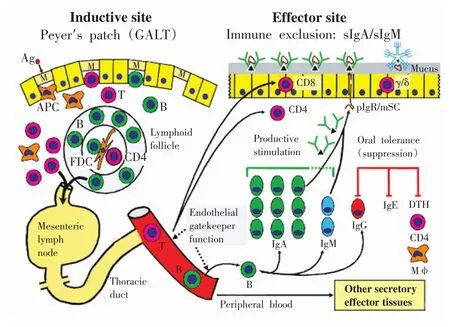
图1 淋巴细胞在黏膜的活化过程[15]
随着Tomasi等首次报道运动对黏膜免疫的影响(高水平滑冰运动员sIgA分泌水平显著低于业余滑冰运动员)[16],越来越多的学者意识到黏膜免疫作为机体的“第一道防线”在运动员免疫机能变化过程中的重要性。大强度运动导致的应激反应对黏膜表面造成的损伤或抗体分泌不足可直接影响黏膜免疫功能稳态,从而造成有害病原微生物进入机体,导致感染性疾病的发生率升高[17]。这说明运动员易患的上呼吸道感染和胃肠道感染均与黏膜免疫抑制有关[18]。高水平运动员的纵向研究和跟踪调查显示:随着运动量的增大,运动员sIgA分泌量降低[19-21]。也有一些研究表明:高水平运动员在长时间大强度训练过程中会出现明显的黏膜免疫抑制现象,但sIgA下降最低点存在时相差异。Mackinnon研究发现:大强度训练期间,运动员sI⁃gA下降最低点出现在最大训练强度训练周期的最后一周[22],研究者认为这可能与长期高强度运动的疲劳积累有关。而也有学者发现:大强度训练期间,sI⁃gA下降的最低点出现在训练后第4天[23],认为这可能与运动员难以适应突增的过大的运动强度有关。研究结果存在的这些差异,可能是不同研究所观察的运动训练方案以及运动员的机能状态有所不同造成的。而对于运动导致黏膜免疫抑制的机制,学者们也进行了探讨。Carpenter在研究中指出:高强度训练和慢性应激期间,sIgA分泌水平下降可能与下丘脑-垂体-肾上腺轴活动改变和IgA转运和/或合成受到抑制有关[24-25]。但总体而言,运动与黏膜免疫抑制的相关机制目前尚未完全明确,仍需进一步的研究进行探索。
综上所述,黏膜免疫作为机体的“第一道防线”,在运动员EIS的发生发展过程中的作用,以及其主要效应分子sIgA与呼吸道和消化道感染性疾病易感性的关系,将成为探索和揭示EIS机制和验证相关干预措施效果的重要内容。此外,急性和慢性运动均会对黏膜免疫功能产生影响,且sIgA下降的最低点存在时相差异,这些研究结果提示我们:急性大强度运动后、长期大强度运动初期和后期等时相点的黏膜免疫机能应得到重点监控。在这些时相点之前或在整个训练期内进行相关干预调控,是否可通过改善机体的第一道免疫屏障黏膜免疫来预防或延缓运动员EIS的发生,尚需要更多的实验性研究提供证据。
2.2 运动性免疫抑制的免疫细胞及其亚群变化
免疫细胞是免疫系统的功能单元,包括淋巴细胞、树突状细胞、单核/巨噬细胞、粒细胞、肥大细胞等。运动作为一种重要的外界刺激因素,使机体产生应激,尤其是长时间/大强度的运动,直接影响机体免疫细胞的数目、活性、功能和分布。大量研究表明:急性运动期间,免疫活性细胞被动员募集进入血液,淋巴细胞及其亚群数目、分布、活性均发生巨大改变,这可能是运动后EIS发生的机制之一。结合近年研究文献对Peders⁃en的总结表格[26]进行修正及补充,阐述一次性急性大强度运动对机体免疫细胞及其亚群的影响(见表1)。大强度运动期间,中性粒细胞和淋巴细胞亚群重新募集入血,运动结束后中性粒细胞数目继续上升,而淋巴细胞数目显著低于基值水平[27]。在此期间,淋巴细胞凋亡率上升,淋巴细胞增殖能力降低[28],机体处于“Open Window”状态,即产生免疫抑制。此时,病毒和细菌极易获得立足点,导致感染性症状发展的风险增加。亦有研究表明,在发生EIS时,NK细胞及K细胞数量也会减少,活性降低[29-30]。

表1 大强度运动对淋巴细胞及其细胞因子的影响
学者们在观察运动对各种免疫细胞数量和分布影响的基础上,重点分析了淋巴细胞亚群的变化及其相关机制。大量研究表明,发生EIS时循环血和多种组织或器官内CD4+T细胞下降,CD8+T细胞升高,CD4+/CD8+比值降低[31]。陈佩杰等的研究发现,EIS可诱导TH1/TH2淋巴细胞亚群失衡,转录因子失调[32],这可能是大强度运动导致的细胞免疫功能低下的重要机制之一。另一项研究表明:长期递增负荷训练可导致胸腺呈进行性萎缩,T细胞双阴性(DN)阶段T细胞(CD4-CD8-)发育受阻,T细胞发育失衡[33],这将直接影响T淋巴细胞活化的数量,可能是导致EIS发生后淋巴细胞数目减少的主要原因。由此可见,大强度运动不仅影响免疫细胞的数目和分布情况,其亚群的发育和转化过程也同样受到影响。因此,后者也成为近期探讨运动性免疫抑制机制问题的研究重点。
2.3 运动性免疫抑制的细胞因子变化
细胞因子(cytokine,CK)是由免疫原、丝裂原或其他刺激剂诱导多种细胞所产生的低分子量可溶性蛋白质,具有调节固有免疫和适应性免疫、细胞生长以及损伤组织修复等多种功能[34]。细胞因子的种类包括白细胞介素、干扰素、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等。众多细胞因子在体内通过多种分泌途径发挥作用,形成十分复杂的细胞因子调节网络,调控人体多种重要的生理功能[12]。
已有大量临床随访或动物实验均发现,机体进行反复大强度运动或长期高负荷训练后,处于“暂时性”或“累积性”的免疫抑制,此时,机体内促炎因子(TNF-α,IL-1α,IL-8,IL-6)和抗炎因子(IL-4,IL-10)均明显升高(见表1),存在亚临床和临床感染状态[35-36]。也有一些研究证实,运动过量可引起一些类似临床脓毒症的运动性疾病,导致组织破坏,产生过度的炎症反应[37]。结合“炎症-抗炎平衡”学说,我们推测,大强度训练初期机体应激所导致的“暂时性免疫抑制”使细菌和病原体等异物进入体内,这一刺激可激活机体的保护机制,通过释放炎症细胞因子激活机体免疫系统(固有免疫和获得性免疫)来抵抗和消灭入侵者。与此同时,机体的抗炎系统也被启动,释放抗炎细胞因子对炎症反应进行牵制和调节。使机体既能有效抵御致病因素的侵袭,又使炎症反应不至于过度强烈而损伤机体正常功能。而在大强度训练后期,疲劳严重积累导致的“累积性免疫抑制”,将不断促进炎症因子分泌,此时,抗炎因子会根据不同生理状态出现分泌不足或过量分泌,导致“炎症-抗炎平衡”失调,通常表现为抗炎介质不能对所产生的炎症提供足够的控制,或者过度抑制了疾病所引起的炎症反应和免疫应答,从而造成机体抗感染能力的下降,引起反复感染。这一假说应与EIS相关机制密切相关。
3 运动性免疫抑制发生的相关机制
引起运动性免疫抑制的原因非常复杂,以实验研究为基础,揭示的EIS机制主要涉及以下几个方面:
3.1 运动所导致的神经--内分泌功能改变
运动过程中,机体会产生以交感-肾上腺素系统被激活为代表的应急反应,以及以下丘脑-垂体-肾上腺皮质系统活动增强为特征的应激反应。导致体内的应激激素生成和分泌明显增加,其中最重要的有糖皮质激素(glucocorticoid,GC)、促肾上腺皮质激素(adre⁃nocor ticotropic hormore,ACTH )、生长抑素 (soma⁃tostatin,SS)和儿茶酚胺( catecholamine,CA)等。应激激素大多具有强烈的免疫抑制作用。体内和体外实验均证实,交感-肾上腺素系统兴奋对免疫功能会产生明显的抑制效应。因此,运动尤其是长时间和或大强度的运动训练对机体免疫系统会产生强烈的抑制[38]。
研究发现,由运动导致的神经-内分泌功能变化,可以通过多种途径和水平改变机体的免疫机能:如影响淋巴组织与器官血流调控;影响淋巴细胞的分化、发育、成熟、移行与再循环;影响细胞因子和其它免疫因子的生成与分泌;影响免疫应答的强弱及维持的时间等[39]。运动产生的免疫抑制效应可保护机体免受更严重的损伤,但另一方面也降低了机体对病原体的抵抗能力,容易引发感染的发生。
3.2 运动所导致的免疫细胞能源物质消耗
运动过程中,体内的糖、蛋白质和脂肪参与供能。对能源底物的选择和消耗水平取决于运动的强度和运动持续时间。长时间大或中强度的运动可导致体内的血糖和谷氨酰胺水平显著下降,血糖下降会直接影响淋巴细胞、巨噬细胞等免疫细胞的能源供应,继而影响免疫机能的发挥[11]。而谷氨酰胺是免疫系统的重要燃料,它是淋巴细胞分泌、增殖和功能维持的必需物质。谷氨酰胺可促进淋巴细胞、巨噬细胞的有丝分裂和分化增殖,增加细胞因子TNF、IL-1等的产生[41]。研究证实,提供外源性谷氨酰胺可明显增加危重病人的淋巴细胞总数、T淋巴细胞和循环血中CD4+/CD8+的比率,增强机体的免疫功能[42]。大量研究亦证实,运动前或运动后补充碳水化合物,对运动员急性运动后或长期大强度训练期间的免疫血象均可以产生良好的影响[43]。
此外,血糖浓度的变化亦可以通过影响内分泌系统而影响机体的免疫功能。位于脑和肝脏中的葡萄糖感受器可以调节下丘脑-垂体-肾上腺皮质(hypothala⁃mus pituitary adrenal cortical axis,HPA )系统的机能,若血糖浓度降低,会加强HPA轴的激活程度,促进糖皮质激素的分泌。运动导致的血糖降低可进一步诱发的糖皮质激素分泌加强,会形成更深的免疫抑制。
3.3 运动所导致的自由基生成对免疫细胞的损害
运动过程及运动结束后相当长一段时间,氧自由基会维持较高水平,会通过攻击细胞膜等途径,形成免疫损伤,造成免疫抑制。已有研究发现,大强度运动后,机体的自由基水平大幅度增加,且持续较长时间。运动后恢复期内所发生的较长时间的免疫抑制现象,可能与氧自由基的较高水平直接相关[44-46]。
3.4 运动导致的免疫细胞凋亡
一些研究表明,运动导致运动性免疫抑制由细胞凋亡导致,大量淋巴细胞非正常程序性死亡,直接影响抗体分泌量[40,56],加速胸腺组织萎缩[33]、淋巴细胞数量下降[37],免疫功能失衡[1]。覃飞等研究发现,6周递增负荷运动过程中,肠道粘膜免疫相关抗体分泌量下降,Bax与Bcl-2比值升高,提示淋巴细胞凋亡增多,运动应激性自由基生成可能是肠道淋巴结细胞凋亡的机制之一[56]。张馨蕾等研究表明:长期递增负荷运动导致大鼠胸腺萎缩,胸腺细胞凋亡率升高,主要是通过G1/S期的调控造成DNA复制障碍,阻滞胸腺细胞周期。细胞周期阻滞可能是胸腺细胞凋亡发生的原因之一[37]。因此,运动导致的淋巴细胞凋亡的相关机制较为复杂,需要大量研究进一步证实。
4 运动性免疫抑制的调理
4.1 营养调理
运动员营养状态是其维持良好机能状态的重要保障。大量流行病学调查表明:大强度训练和比赛期间,运动员易出现EIS相关症状,并常伴有食欲不振,消化道不适等问题。若运动员正常所需营养难以保证,会加剧机体免疫抑制,增加其患病风险,最终影响运动员的身体健康和运动能力及成绩。营养干预措施可通过日常饮食和训练间隙进行补充,方便易行。大量运动性免疫抑制的调理亦集中于营养补剂的研究和应用。
基于EIS的发生机制,科学研究者应用不同营养补剂对EIS进行调理。我们根据大量相关科学研究以及已经发表的系统综述和meta分析[48],并结合Gleeson总结的表格[47],补充归纳了EIS的营养调理应用、相关机制与实践效果(见表2)。目前所应用的营养补剂种类繁多,包括:维生素、支链氨基酸、益生菌、碳水化合物、不饱和脂肪酸等与代谢相关的各种营养物质。其中近三分之一的干预方法(碳水化合物、牛初乳、益生菌、槲皮素)已经过人群及动物实验,证实安全且效果良好,推荐使用。而一些补剂(维生素类)虽然效果显著,但存在剂量安全问题,如,运动员维生素C补充量比正常安全剂量高出1倍以上,摄入剂量过高可能引发DNA损伤、癌症发病率升高、肾结石形成等诸多不利问题。
此外,也有部分营养补剂难以获得理想效果,这可能与补充方法以及体内复杂的代谢过程有关,如谷氨酰胺、支链氨基酸、n-3多不饱和脂肪酸、β-葡聚糖等。因此,这些营养素和营养补剂是否可以安全地应用于运动机体(尤其是长时间大强度训练的专业运动员),以及是否可以有效调理运动员的EIS,仍然需要进一步的实验加以验证。因此,在制定运动员营养补剂方案时应根据运动员自身情况慎重选择,并做到及时跟踪监督和常年随访。
4.2 中药调理
除了各种营养补剂对EIS的干预,近年来中草药及其提取物也被一些学者推崇并进行实验研究。Barto⁃lomé证明水龙骨提取液可有效缓解高水平运动员感染性疾病的发生发展[76]。Megna研究表明:紫雏菊提取物、红景天、人参可提高运动员表现能力,有效调节运动员免疫系统,减少氧化应激产生的损伤[77]。Hall对32名受试者补充紫雏菊提取物,结果表明:补药组患病病程显著低于对照组,补充紫雏菊提取物可以降低大强度运动导致的黏膜免疫抑制,缩短患病病程[78]。万文君等利用补血、补气、补阳的中药组方对全国赛艇队运动员冬训期间进行免疫调理,结果显示运动员淋巴细胞数目、免疫球蛋白均升高,调理效果良好[79]。但是,中草药药性复杂,需要大量试验及专业知识,如紫雏菊根部可促进机体免疫功能,其叶子反而会造成免疫抑制,所以需要配备专人进行甄别、提取、纯化,经济成本较高。此外,由于中草药成分多样,以中草药作为调理手段存在误服兴奋剂的风险,可能造成运动员血检和尿检阳性,带来禁赛等不必要的麻烦,因此依然难于放心和广泛应用。
4.3 其他调理
目前,关于EIS干预的非营养、非药物疗法的相关研究较少,其中中医针灸及其衍生的疗法已有部分实验验证。Yuichi Matsubara等应用针灸疗法对一次性大强度运动后的黏膜免疫功能进行调理,研究发现:针灸治疗可以减轻高强度运动导致的sIgA分泌水平下降[80]。Lu对运动免疫抑制大鼠进行电针治疗(足三里、百会、关元,每个穴位20min),结果表明:针刺治疗可以有效提升外周血CD3+,CD4+和 NK细胞数量、胸腺指数、脾脏指数,有效改善大强度运动导致的运动性免疫抑制[81]。Li发现大强度训练后3小时,进行15分钟的穴位(肾腧,关元)艾灸治疗,可提高机体红细胞免疫功能,改善T细胞亚群比例[82]。郝选明等研究表明,小剂量低强度激光(1 mw,6.8 J/cm2)可明显改善6周递増负荷训练大鼠的鼻黏膜结构,以及黏膜的体液和细胞免疫功能,且在训练阶段的中后期效果显著[83]。
基于对上述研究的分析,我们发现运动性免疫抑制的营养调理,除了部分营养素或营养补剂得到实验研究和应用实践的证实外,仍有大部分营养素或营养补剂对EIS的调理作用不能确定。中药组方或提取物对运动性免疫抑制的调理虽然效果较好,但可能存在兴奋剂检测阳性的风险。针灸对EIS的调理有一定效果,但需要专业人员和一定的技术。
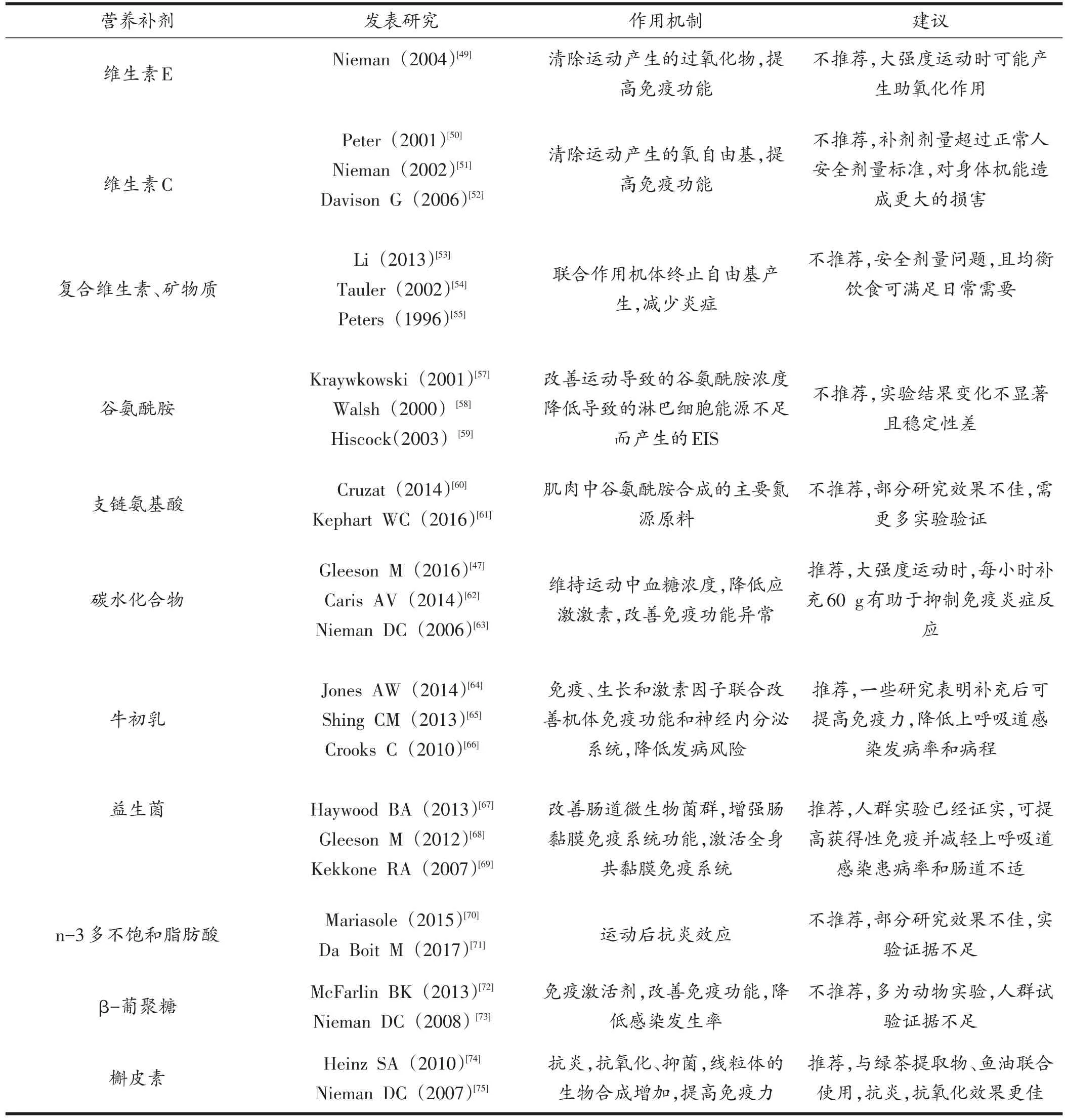
表2 营养补剂对运动性免疫抑制的干预相关研究汇总
5 小结
综上所述,上呼吸道和消化道感染性疾病为运动员赛前及比赛期间常见疾病,与EIS的发生发展存在紧密联系。黏膜免疫作为机体的“第一道防线”,其效应分子sIgA水平下降与呼吸道和消化道感染性疾病易感性升高高度相关,提示急性大强度运动后、长期大强度运动初期和后期等时相点的黏膜免疫机能应得到重点监控。此外我们发现,碳水化合物、牛初乳、益生菌、槲皮素等营养补剂已经过人群及动物实验,证实安全且效果良好,推荐使用。维生素类、中药等调理手段虽然效果显著,但存在剂量安全问题、兴奋剂风险与技术限制等因素,难以推广。也有部分营养补剂难以获得理想效果,这可能与补充方法以及体内复杂的代谢过程有关,如谷氨酰胺、支链氨基酸、n-3多不饱和脂肪酸、β-葡聚糖等。因此,这些营养素和营养补剂是否可以安全地应用于运动机体(尤其是长时间大强度训练的专业运动员),以及是否可以有效调理运动员的EIS,仍然需要进一步的实验性研究加以验证。因此,在制定运动员营养补剂方案时应根据运动员自身情况慎重选择,并做到及时跟踪监测和常年随访。同时如何找到一种经济、安全、有效、易行的手段改善运动性免疫抑制,已成为运动科学需要解决的重大问题和迫切任务之一。

