少孢节丛孢菌XJ-A1几丁质酶基因AO-190的克隆、表达及其酶活性的测定
贡莎莎,孟庆玲,乔 军 ,钟文强,黄运福,张国武,陈 英 ,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
几丁质酶广泛存在于细菌、病毒、真菌、植物、动物中,发挥着多种多样的功能[1-2]。大多数几丁质酶最主要的作用是分解几丁质。几丁质(Chitin)是由N-乙酞葡萄糖胺通过β-1,4糖苷键连接起来的链状高分子化合物。在自然界中,许多线虫的体壁及其虫卵外壳主要由蛋白质和几丁质组成[3],因此,利用几丁质酶催化几丁质β-1,4糖苷键水解从而降解线虫体壁及线虫卵为人们提供了更加有效地防治线虫的新思路。
少孢节丛孢菌(Arthrobotrysoligospora,AO)是一种代表性的捕食线虫性真菌,其以营养菌丝特化形成的捕食器官-黏性菌网具有极高的捕食线虫能力,是目前研究的最有潜力的一种生物防控候选菌种[4-5]。少孢节丛孢菌分泌的胞外水解酶(蛋白酶、几丁质酶和胶原酶等)对线虫角质层的降解是侵染线虫的关键环节[4,6-9]。然而,目前的研究多集中在胞外酶丝氨酸蛋白酶(PⅡ、VCP1、pSP-3、Aoz1、P186、Ver112、Mlx、PrC等)上[5,10-11],对少孢节丛孢菌几丁质酶的相关研究较少。Yang等[4]完成了少孢节丛孢菌全基因组测序,随后Yang等[9]进一步对在不同培养条件下的少孢节丛孢菌进行转录分析,发现16个几丁质酶在碳源缺乏、几丁质底物或植物病原真菌存在时表达量上调,尤其几丁质酶基因AO-190在碳和/或氮缺乏时转录显著上调,提示几丁质酶AO-190可能在少孢节丛孢菌侵染线虫的过程中发挥重要作用,然而该酶的结构和功能还不清楚。
本研究对少孢节丛孢菌新疆分离株几丁质酶基因AO-190进行了克隆,利用生物软件分析其分子特征,并进行表达、纯化和重组酶活性的检测,为重组几丁质酶AO-190生物防控制剂的研发奠定了基础。
1 材料和方法
1.1 菌株、试剂及培养基
少孢节丛孢菌新疆分离株XJ-A1、Escherichia.coliDH5α菌株、EscherichiacoliBL21(DE3)菌株由石河子大学动物科技学院寄生虫实验室保存。Biospin真菌基因组DNA提取试剂盒、PrimeScript RT reagent Kit with gDNA Eraser试剂盒、pMD19-T载体均购自TaKaRa公司,EZ Spin Column Fungal RNA Isolation Kits 试剂盒购自生工生物(上海)工程股份有限公司,鼠抗His抗体、HRP标记的羊抗鼠IgG购自北京全式金生物技术有限公司,几丁质酶ELISA试剂盒购自北京诚林生物科技有限公司,T4DNA 连接酶购自Promega公司。YPSSA培养基参考文献[12]制备。
1.2 几丁质酶AO-190基因的克隆
根据GenBank发表的少孢节丛孢菌标准株(ATCC 24927)全基因组,利用Primer 5.0设计特异性引物,上游引物:5′-CGGGATCCATGTCACCTCTCGGATTG-3′(下划线部分为BamHⅠ酶切位点),下游引物:5′-CCCTCGAGTCACTGTCTATGTCTGTGTCGTC-3′(下划线部分为XhoⅠ酶切位点)。将XJ-A1分离株接种于YPSSA培养基,于26 ℃霉菌培养箱中培养7 d后刮取菌丝,分别提取DNA以及总RNA,并利用反转录试剂盒将RNA反转录成cDNA;再分别以DNA、cDNA为模板,进行PCR扩增。反应体系如下:PCR Mixture 8 μL,上下游引物各0.5 μL,模板 2 μL,加ddHO2补足至20 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 40 s,62 ℃ 40 s,72 ℃ 120 s,共35个循环;72 ℃ 10 min。扩增产物电泳后进行回收,与pMD19-T连接,转化至E.coliDH5α感受态细胞,经氨苄青霉素抗性培养基筛选以及菌液PCR验证后,送往北京六合华大基因科技股份有限公司进行测序。
1.3 几丁质酶AO-190基因及其编码氨基酸序列生物信息学分析
利用生物在线软件ProParam、SignalP 、SMART(http://web.expasy.org/)对AO-190基因及其编码氨基酸序列进行生物信息学分析及功能预测;利用npsa-prabi和SWISS-MODEL预测二级、三级结构。采用DNAMAN与少孢节丛孢菌标准株的几丁质酶AO-190进行比对分析,并利用MEGA 6.0软件NJ法(Neighbor-joining method,Bootstrap为1 000)进行系统进化分析。
1.4 原核表达质粒pET32a-AO-190的构建
用BamH Ⅰ和XhoⅠ分别对pMD19-T-AO-190和pET32a质粒进行双酶切,回收pET32a载体片段和AO-190目的片段,在T4DNA 连接酶作用下4 ℃过夜连接后转化入E.coliDH5α感受态细胞中,在氨苄抗性培养基上37 ℃培养12~16 h,挑取单菌落,再经菌液PCR和双酶切方法筛选阳性克隆。
1.5 原核表达及SDS-PAGE和Western Blot分析鉴定
将构建的重组质粒pET32a-AO-190转化入E.coliBL21(DE3)感受态细胞中,挑取阳性克隆,接种于含氨苄青霉素抗性的5 mL液体LB培养基中,37 ℃,180 r/min过夜培养,再取菌液3 mL接种于200 mL液体LB培养基中,37 ℃,180 r/min培养至OD600nm值约为0.6~0.8,加入IPTG至终浓度1 mmol/L,分别诱导0,4,6 h后收集菌体,进行SDS-PAGE分析,并选择表达量最高时收集的菌体再次进行重组菌表达产物的Western Blot鉴定,一抗为鼠抗His标签蛋白,二抗为HRP标记的兔抗小鼠IgG。
1.6 重组几丁质酶AO-190的纯化及酶活性测定
诱导6 h后8 000 r/min 离心10 min收集菌体,加15 mL Lysis Buffer 裂解菌体,通过镍柱亲和层析法进行重组蛋白的纯化。在1.5 mL EP管中加入200 μL树脂悬液,依次用去离子水、1×charge Buffer、1×binding Buffer处理树脂悬液,加入菌体裂解液,用1×binding Buffer、1×wash Buffer以及1×Elute Buffer洗脱重组蛋白,然后装入透析袋分别在6,4,2,1 mol/L尿素以及去离子水中透析6~8 h进行复性,收集透析袋中蛋白。将重组几丁质酶稀释10倍后按照几丁质酶ELISA试剂盒检测重组酶AO-190活性,在450 nm波长测量各孔OD值,根据标准曲线计算重组几丁质酶AO-190活性浓度。
2 结果与分析
2.1 PCR扩增结果
以DNA为模板,通过PCR扩增,琼脂糖凝胶电泳分析,结果表明,少孢节丛孢菌XJ-A1几丁质酶基因AO-190约为1 574 bp,与GenBank中已公布的少孢节丛孢菌标准株(ATCC 24927)AO-190基因大小相近(图1)。以cDNA为模板,通过RT-PCR扩增,结果表明,扩增产物大小约为1 251 bp,与已公布的少孢节丛孢菌标准株(ATCC 24927)AO-190 cDNA大小一致(图2)。

M.DNA分子质量标准;1~3.PCR扩增产物。图2同。M.DL2000 DNA Marker; 1-3.PCR amplified product.The same as Fig.2.
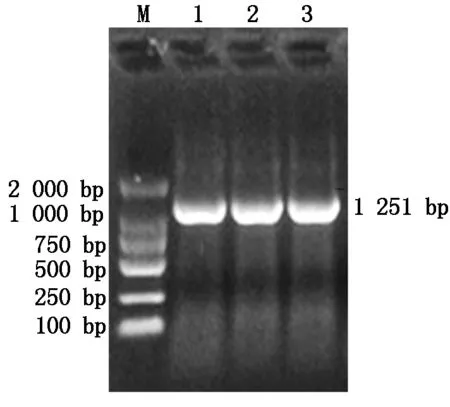
图2 AO-190基因RT-PCR扩增产物Fig.2 Amplification Products of AO-190 RT-PCR
2.2 少孢节丛孢菌XJ-A1几丁质酶AO-190基因及其编码氨基酸序列分析
经测序(图3),少孢节丛孢菌XJ-A1几丁质酶AO-190基因全长为1 574 bp,与已公布的少孢节丛孢菌标准株(ATCC 24927)的几丁质酶AO-190基因序列的同源性为93.33%;序列中有4个内含子序列,均以GT开头,AG结尾,分别位于140-209位,590-659位,851-950位,970-1 053位核苷酸,具有真菌内含子的共同特征;序列中包含1个1 251 bp的开放阅读框(ORF),编码416个氨基酸,与已公布的氨基酸序列同源性为92.55%,存在一定的差异;SignalP软件分析显示,AO-190氨基酸序列第1~28位为信号肽序列,是分泌蛋白;Protparam软件预测几丁质酶AO-190的分子量为45.7 ku,等电点为7.55。
在线软件分析发现(图4),AO-190含有糖苷水解酶18家族特征基序(35-344)、1个精氨酸富集区(388-415)、1个双向核定位信号(388-405)、1个N-糖基化位点(325-328)、4个PKC磷酸化位点(9-11、192-194、272-274、401-403)、6个N-酰基化位点(5-10、42-47、95-100、125-130、153-158、355-360)、8个酪蛋白激酶Ⅱ磷酸化位点(135-138、233-236、292-295、296-299、304-307、344-347、358-361、384-387)、1个酰胺化位点(116-119)、1个低复杂度区(398-415);AO-190存在2个几丁质酶保守的区域SLGG和VDGVDLDLE,属于糖苷水解酶18家族,主要催化活性区域位于35-277位,并且存在一个底物结合位点SLGG,位于123-126位,以及一个水解酶催化活性位点VDGVDLDLE,位于168-176位。此外,在几丁质酶AO-190氨基酸序列中存在47.1%的疏水性氨基酸。

图4 少孢节丛孢菌几丁质酶 AO-190基因编码的蛋白结构域模式图Fig.4 Domain pattern of chitinase AO-190 gene encoding protein of Arthrobotrysoligospora
将少孢节丛孢菌XJ-A1几丁质酶AO-190和已经公布的少孢节丛孢菌标准株(ATCC 24927)几丁质酶基因AO-190(AOL_s00075g190)、刀孢蜡蚧菌 MLecanicillium psalliotae(ABQ57240)、金龟子绿僵菌Metarhizium anisopliae(AAS55554)、粗糙脉孢菌 Neurospora crassa(NCU04883)、紫色拟青霉Purpureocilliumlilacinum(ABP37997)进行氨基酸序列比对分析,同源性分别为92.55%,13.79%,19.48%,14.60%,12.90%。5个几丁质酶氨基酸序列的同源性为26.15%,且均具有典型的几丁质酶催化区保守序列SXGG和DXXXDGXD。
2.3 AO-190二级及三级结构预测分析
在线软件预测结果显示,AO-190二级结构元件有无规则卷曲(Loop)、α螺旋(Alpha-helix)和β折叠(Beta-sheet)。SWISS-MODEL在线软件3D预测结果显示(图5),几丁质酶AO-190 3D具有典型的GH18几丁质酶TIM(Triosephosphate isomerase,丙糖磷酸异构酶)结构,即由8个α螺旋组成的外桶围绕着8个β折叠组成的内桶所构成的(α/β)8圆桶形结构。AO-190内外桶在空间结构上彼此贴近,形成特定的空间结构域,与酿酒酵母chitinase 1结构相似[13]。
2.4 不同来源几丁质酶的系统进化分析
采用MEGA 6.0软件对少孢节丛孢菌新疆分离株几丁质酶AO-190和其他37个不同来源的几丁质酶氨基酸序列进行系统进化分析结果显示(图6),植物、食线虫真菌、细菌、植物病原真菌、病毒、线虫、脊椎动物、昆虫的几丁质酶各自聚成一个分枝,食线虫真菌处于第2个分枝,与处于第1个分枝的植物几丁质酶亲缘关系最近,与昆虫及脊椎动物的几丁质酶存在显著的进化距离。AO-190与能产生短柄黏球的Dactylellinahaptotyla(EPS43772.1)几丁质酶以及能产生收缩环的Drechslerellastenobrocha(EWC46603.1)几丁质酶亲缘关系最接近(图6)。

图5 AO-190三级结构的预测Fig.5 The predicted tertiary structure of AO-190

图6 少孢节丛孢菌新疆分离株几丁质酶AO-190和其他几丁质酶系统进化分析Fig.6 Phylogenetic tree showing the relationship between AO-190 of Arothrobotrys oligospora XJ-A1 and other chitinases
2.5 重组质粒pET32a-AO-190的鉴定
重组质粒pET32a-AO-190经PCR和双酶切鉴定,都得到大小约为1.2 kb的插入片段(图7)。测序结果显示,插入片段大小为目的基因片段,且开放阅读框正确。

M.DNA分子质量标准;1.未双酶切的pET32a-AO-190重组质粒;2.pET32a-AO-190重组质粒的双酶切产物。M.DL2000 DNA Marker; 1.The recombinant vector of pET32a-AO-190;2.Product from recombinant pET32a-AO-190 digested with Bam H Ⅰ and XhoⅠ.
2.6 重组蛋白AO-190的诱导表达、纯化及SDS-PAGE和Western Blot分析
阳性菌落经1 mmol/L 的IPTG诱导6 h后提取蛋白,表达产物经SDS-PAGE分析后,在相对分子质量约63 ku处可见特异性反应条带,分子量与预期值相同(图8)。利用镍柱纯化技术纯化重组蛋白酶,Western Blot分析表明,表达的重组蛋白酶能与小鼠抗少孢节丛孢菌胞外分泌性蛋白多克隆抗体发生特异性血清学反应。

M.蛋白分子质量标准;1.pET32a空载体诱导6 h;2~3.pET32a-AO-190菌经IPTG诱导6 h表达产物;4.纯化的重组酶AO-190 Western Blot分析结果。M.Protein molecular weight Marker; 1.Empty vector of pET32a; 2-3.Protein of pET32a-AO-190 expression was induced by 6 hours with IPTG;4.Western Blot analysis of the purified recombinant protein AO-190.
2.7 重组AO-190酶活性测定结果
按照羊几丁质酶(CHIT)酶联免疫分析(ELISA)试剂盒检测重组酶活性浓度,空白对照孔调零,绘制标准曲线(图9),其R2= 0.997,根据标准曲线进行换算得出,重组AO-190酶活性浓度为222 IU/L。

图9 重组AO-190酶活性测定结果Fig.9 The activity of recombinant chitinase AO-190
3 讨论
长期以来,因大量使用化学药物防控绵羊寄生线虫病而随之产生的抗药性、药物残留、环境污染等问题日益严重,急需寻求更有效更安全防控线虫的方法。随着生物技术的快速发展,利用捕食线虫性真菌进行生物防控寄生性线虫显示出巨大的潜力。少孢节丛孢菌是捕食线虫性真菌的代表菌,其分泌的胞外水解酶可能在线虫角质层的降解中发挥了重要作用。目前,已经先后在致病性真菌中发现了多种具有功能的几丁质酶,如烟曲霉已报道14个几丁质酶,白色念珠菌中4个,丝状真菌构巢曲霉中18个,绿僵菌中发现了24个[14-16],然而,对少孢节丛孢菌几丁质酶的研究相对较少[12,17-18]。Yang等[9]对少孢节丛孢菌的几丁质酶进行了较为深入的研究,发现少孢节丛孢菌16个假定的几丁质酶在碳源缺乏、几丁质底物或植物病原真菌存在时表达量上调,尤其是几丁质酶基因AO-190在碳和/或氮缺乏时转录上调显著,虽然该酶的结构和功能还尚不清楚,提示几丁质酶AO-190可能在少孢节丛孢菌侵染线虫的过程中发挥重要作用。
本研究对少孢节丛孢菌新疆分离株XJ-A1的几丁质酶AO-190 基因进行了克隆及序列测定,氨基酸序列分析显示,几丁质酶AO-190含有信号肽(Signal peptide)、几丁质酶催化域(Catalytic domain)、几丁质结合域(Binding domain)等结构域,且几丁质酶催化区保守序列SLGG和VDGVDLDLE高度保守,这与前人报道的GH18家族几丁质酶结构相符[9,19]。AO-190具有的典型的GH18几丁质酶TIM桶结构,使得几丁质酶AO-190与几丁质底物能够更好地结合,从而进一步发挥降解作用。在几丁质酶AO-190氨基酸序列中有大量的疏水性氨基酸,推测更有利于维持(α/β)8圆桶形结构的稳定性,同时还存在一个N-糖基化位点,可能与保护几丁质酶免于蛋白水解相关[20]。在少孢节丛孢菌新疆分离株的几丁质酶中,笔者首次发现了核定位区和精氨酸富集区,对于该2个基序的结构和功能上并不清楚。
通过对少孢节丛孢菌几丁质酶AO-190和来源于其他生物的几丁质酶进行系统进化分析发现,不同来源的几丁质酶各自聚成一个分枝。捕食线虫性真菌属于子囊菌门,之前已有研究报道子囊菌门的真菌存在两类18家族水解酶几丁质酶,即与植物几丁质酶相似以及与细菌几丁质酶相似的几丁质酶[21]。在本研究中发现,食线虫真菌几丁质酶与植物及细菌几丁质酶相对较近的亲缘关系,同时发现,食线虫真菌几丁质酶与昆虫及脊椎动物的几丁质酶存在显著的进化距离。Liu、Yang等[22-23]通过对能产生6种捕食结构(黏性菌丝、黏性菌网、黏性分枝、黏性球、收缩环、非收缩环)的16种捕食性子囊菌的5个蛋白质编码基因片段进行分析,证明了初始捕食结构沿着2个谱系演化,一类是依赖黏性附着捕捉线虫的黏性捕食器官(黏性菌丝、黏性网、黏性球、黏性分枝和非收缩环),另一类捕食器官不具有黏性,它依靠机械力卡住线虫从而将其捕捉,即收缩环。在本研究中,少孢节丛孢菌新疆分离株几丁质酶AO-190与能产生短柄黏球的Dactylellinahaptotyla几丁质酶以及能产生收缩环的Drechslerellastenobrocha几丁质酶亲缘关系更为接近,与已经发现的进化规律相符。本研究首次对少孢节丛孢菌新疆分离株XJ-A1几丁质酶AO-190进行了表达、鉴定及重组酶活性测定,为进一步研发重组几丁质酶AO-190生物防控制剂奠定了理论基础。

