赤霉素浸种对玉米低温出苗率的影响
许高平,刘秀峰,袁文娅,王 璞,楼辰军,杨兆顺
(1. 天津市农业科学院 天津市农作物研究所,天津 300384;2.中国农业大学 农学与生物技术学院,北京 100094)
玉米是我国北方地区重要的粮食作物之一,由于种植区域纬度较高,播种后频繁遭受低温冷害[1]。近年来,受全球气候变化的影响,我国北方存在“暖干化”趋势[2],但低温对玉米生产的不利影响仍然存在[3],同时玉米苗期还遭受季节性干旱的威胁[4]。低温和干旱是造成我国玉米减产[5],阻碍我国春玉米产量进一步提升的主要原因[6-7]。此外,随着我国玉米种植带向更高纬度延伸[8],严重低温冷害、季节性干旱出现频率明显增加[9],高纬度地区玉米生产的抗灾减灾能力亟待进一步提升。
萌发阶段是决定玉米群体的规模与质量的重要生育时期,低温干旱并发对该时期玉米的危害远大于单一胁迫[10-11]。10 ℃条件下,土壤含水量的梯度变化会导致品种间发芽率的较大差异[12]。徐文强等[13]研究发现,温度和土壤含水量下降导致幼苗生长受抑制和贮藏物质转运率下降。赤霉素是一种重要的植物激素,通过增加细胞数目和促进细胞伸长参与植物的发芽和其他生育进程[14-15],关于赤霉素的抗逆研究多在单一胁迫下进行[16],关于低温干旱双重胁迫下玉米萌发性状及其对赤霉素浸种响应的研究则少见报道。
本试验通过设置低温和低温干旱双胁迫,采用2种玉米品种,研究比较不同浓度赤霉素浸种对萌发期玉米萌发性状及其对胁迫的缓解作用,探索非生物逆境下春玉米萌发的有效化控技术。
1 材料和方法
1.1 供试材料
供试品种为自选组合CB15098(昌7-2改良系×郑58改良系)和郑单958(昌7-2×郑58)。图表中分别用CB15098和ZD958表示。试验前选取籽粒中等,均匀一致的种子,用1%次氯酸钠溶液消毒玉米种子10 min,然后用蒸馏水冲洗干净,用吸水纸吸干。
1.2 沙培试验
砂床制备。本试验采用砂中(S)发芽床,砂床用无化学污染的细砂为材料,盐酸浸泡,清水洗涤,120~140 ℃高温烘干(2 h),使用前过筛(0.80 mm和0.05 mm孔径的土壤筛)。发芽采用标准发芽盒(19 cm×13 cm×12 cm),每盒50粒。
光照条件。播种后,将发芽盒放置在人工气候箱内,光周期14/10 h(光/暗)的活跃光环境中萌发。
1.3 试验设置
胁迫类型:试验设10 ℃低温处理,参照王玺[17]的方法设砂床饱和含水量的65%为正常水分,砂床饱和含水量的40%为干旱胁迫。砂床饱和含水量为26%,用称重法定时称重补水。3次重复。以胚芽露出沙面为标准,逐日统计种子的发芽数,至幼苗露出沙面1~2 cm时,将发芽盒取出置于25 ℃条件下生长,一叶一心期取样测定生理生化指标。
浸种处理:赤霉素浓度设置为10,50,100 mg/L(C1、C2、C3),对照为清水浸种,在常温下浸泡种子,每隔0.5 h用玻璃棒搅拌通气,浸泡处理24 h。每处理50粒,3次重复,置于10 ℃的培养箱中萌发,其他条件设置与上述试验保持一致。
1.4 测定指标
发芽势=开始发芽后3 d发芽种子数/供试种子数×100%;
发芽率=置于室温后的最终发芽数/供试种子数×100%;
形态性状。采用根扫描仪(EPSON EXPRESSION TM 1680和WINRHIZO分析软件)测定根系总长度、根系表面积、根体积和平均直径;用刻度尺测量地上部和根系长度。
干/鲜质量。一叶一心期取样,分样洗净后吸干水分,用电子天平称量地上部和根系鲜质量;于105 ℃鼓风干燥箱中杀青30 min,75 ℃烘干至恒重,用电子天平称量干质量。
可溶性碳水化合物含量测定采用蒽酮比色法,丙二醛含量测定采用硫代巴比妥酸(TBA)法。
1.5 数据处理与分析
采用Excel 2016进行数据整理,Sigma Plot 10.0与作图,SPSS 22.0进行统计分析。
2 结果与分析
2.1 低温干旱胁迫对玉米发芽势和发芽率的影响
不同浓度赤霉素浸种对发芽势和发芽率的影响如图1所示。
低温胁迫下,与对照相比,C1处理后CB15098发芽势极显著增加了34.0个百分点,C2、C3处理后显著增加了28.7和27.3个百分点。低温干旱双胁迫下,与对照相比,C1、C2和C3处理后CB15098发芽势分别显著增加了49.3,43.3和44.0个百分点。与对照相比,不同浓度赤霉素浸种提高了郑单958的发芽势但增幅未达显著水平。
低温干旱胁迫下,与对照相比,C3处理后郑单958和CB15098发芽率分别极显著降低了10.7和11.3个百分点,C2处理后CB15098发芽率显著降低了7.3个百分点。
低温胁迫和低温干旱双胁迫下,CB15098对照处理发芽势极显著低于郑单958对照处理发芽势38.7和50.0个百分点。低温胁迫下,C1、C2和C3处理CB15098发芽率分别极显著低于郑单958发芽率23.0,23.2和22.9个百分点;低温干旱胁迫下,C1、C2和C3处理CB15098发芽率分别极显著低于郑单958发芽率22.4,27.1和23.8个百分点。

不同小写或大写字母间表示与同一品种同种胁迫类型下与对照的
差异达显著(P<0.05)或极显著水平p<0.01)。图2-4同。
Different letters in lowercase usually represents a significant difference be-
tween marking treatment and control treatment(P<0.05),different cap-
ital letters represents a significant difference between marking treatment
and control treatment(P<0.05).The same as Fig.2-4.
图1 不同浓度赤霉素浸种对郑单958
和CB15098发芽势和发芽率的影响
Fig.1 Germinability and germination percentage
of ZD958 and CB15098 under chilling and drought
stress presoaked with different concentration of gibberellin
2.2 低温干旱胁迫对干鲜质量的影响
如表1所示,低温胁迫下,C2处理后郑单958和CB15098地上部鲜质量较对照分别显著增加了12.3%和105.4%,使CB15098地上部干质量显著增加了97.4%;C3处理后郑单958和CB15098地上部鲜质量较对照分别极显著增加了20.0%和118.9%,使两品种地上部干质量较对照分别显著增加了20.0%和100.0%。C2处理使CB15098全株鲜质量和全株干质量较对照分别显著增加119.4%和100.0%,C3处理使CB15098全株鲜质量和全株干质量较对照分别显著增加了93.5%和100.0%。
低温干旱胁迫下,C1处理显著或极显著降低了两品种地上部鲜质量和全株鲜质量,其中郑单958地上部鲜质量和全株鲜质量较对照分别降低45.1%和30.4%,CB15098地上部鲜质量和全株鲜质量较对照分别降低40.5%和21.1%;同时C1处理极显著增加了两品种根系鲜质量,郑单958和CB15098根系鲜质量较对照分别增加了6.1%和19.4%。
如表1所示,与对照相比,不同浓度浸种处理对低温胁迫和低温干旱胁迫下两品种地上部含水量的影响均未达显著水平。低温胁迫下,C1处理使CB15098根系含水量较对照显著降低13.1%。低温干旱胁迫下,随着浓度升高,C1、C2和C3处理分别使CB15098根系含水量显著降低了40.1%,26.2%和5.2%,其中C1处理使CB15098全株含水量极显著下降25.7%。低温胁迫下,随着浓度升高,C1和C2处理分别使ZD958全株含水量较对照显著降低了2.4%和0.8%,C3处理使ZD958全株含水量较对照极显著增加了13.7%,这可能是C1处理降低了ZD958地上部含水量并增加了根系含水量,C2处理增加了地上部含水量并降低了根系含水量,C3处理同时增加了地上部和根系含水量的结果。

表1 不同浓度赤霉素处理对胁迫下幼苗干鲜质量及含水量的影响Tab.1 Dry and fresh weight and moisture content of seedlings under chilling and drought stress with different types of chemicals
注:不同大写、小写字母表示同一品种同种胁迫下处理间差异达极显著、显著水平,同一字母标记表示差异不显著。表2同。
Note:Values followed by different capital letters or lowercase letters within each column indicated significant difference at 0.01 and 0.05 level in con-
trast with the control treatment of single maize variety under same stress,values with same followed letters indicated no significant difference at 0.05 level.
The same as Tab.2.
2.3 低温干旱胁迫对根冠协调性的影响
如图2所示,低温胁迫下,与对照相比,不同浓度赤霉素浸种抑制了郑单958主根伸长,促进其地上部伸长,C2和C3处理使郑单958主根长度分别显著降低了13.9%和13.2%,使地上部高度分别显著和极显著增加了14.2%和17.3%。不同浓度赤霉素浸种抑制了CB15098主根和地上部伸长,C1、C2和C3处理使CB15098主根长度较对照分别极显著降低了34.7%,33.3%和28.9%,C1、C2处理处理使CB15098地上部高度较对照分别极显著降低了19.5%和9.4%。
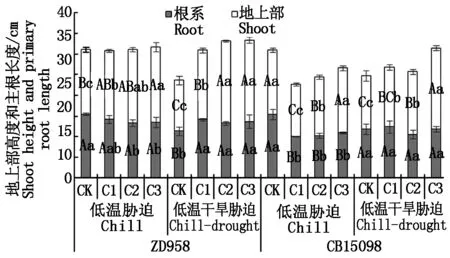
图2 不同浓度赤霉素处理对根冠长度/总长度的影响Fig.2 Ratio of length between root and shoot of seedlingsunder chilling and drought stress withdifferent concentration of gibberellin
低温干旱胁迫下,与对照相比,不同浓度赤霉素浸种促进了郑单958主根和地上部伸长,C1、C2和C3处理使ZD958主根长分别极显著增加了24.5%, 16.7%和20.4%,C1、C2和C3处理使郑单958地上部高度分别极显著增加了36.7%,62.3%和60.5%。与对照相比,C1处理使CB15098地上部长度显著增加了11.8%,C2和C3处理使地上部长度分别极显著增加了17.7%和52.5%。
如图3所示,低温胁迫下,与对照相比,不同浓度赤霉素浸种极显著降低了郑单958鲜质量根冠比和干质量根冠比,C1、C2、C3处理后鲜质量根冠比和干质量根冠比的降幅分别为17.4%,41.7%,38.5%和29.7%,33.9%,35.5%。C1处理使CB15098鲜质量根冠比极显著增加了52.2%,C2处理使CB15098鲜质量根冠比显著增加了19.7%。低温干旱胁迫下,与对照相比,C3处理使两品种鲜质量根冠比分别显著降低34.3%和23.3%,C1处理使CB15098鲜质量根冠比显著增加了23.4%。

图3 不同浓度赤霉素处理对鲜干质量根冠比的影响Fig.3 Ratio of fresh dry weight between root andshoot of seedlings under chilling and droughtstress with different concentration of gibberellin
2.4 低温干旱胁迫对幼苗根系形态的影响
低温胁迫下,CB15098根系形态对赤霉素浸种的响应较郑单958更加明显。如表2所示,C1处理使CB15098根系总体积较对照显著减少了15.4%,C2、C3处理使CB15098根系总体积较对照分别极显著减少了26.8%和57.5%,C2和C3处理使CB15098根系平均直径极显著降低了24.0%和63.0%,C3处理使CB15098根系总表面积极显著降低41.9%。C1处理使郑单958总根长显著增加了22.0%。
低温干旱胁迫下,郑单958根系形态对赤霉素浸种的响应更加明显。如表2所示,与对照相比,C1处理显著增加了郑单958根系平均直径,增幅148.9%,极显著增加了郑单958总根长,根系总表面积和根系总体积,增幅分别为192.4%,142.4%和101.1%,C2处理使郑单958总根长和根系总表面积分别增加了158.5%和98.8%,增幅分别达极显著和显著水平,C3处理使郑单958总根长极显著增加了141.2%。C1和C3处理使CB15098总根长较对照分别极显著增加65.3%和69.9%,使根系总表面积较对照分别显著增加19.8%和20.3%。
2.5 低温干旱胁迫对幼苗可溶性碳水化合物含量和丙二醛含量的影响
低温胁迫及低温干旱胁迫下,两品种可溶性碳水化合物含量对赤霉素浸种处理的响应幅度均要大于MDA的响应幅度。如图4所示,低温胁迫下,C1、C2、C3处理使郑单958和CB15098可溶性碳水化合物含量较对照分别极显著降低了24.6%,40.7%,39.1%和34.8%,52.6%,39.7%。C1和C3处理使CB15098的MDA含量分别极显著增加了10.9%和21.1%,C2处理使CB15098的MDA含量极显著下降了7.1%。
低温干旱胁迫下,C1、C2、C3处理使郑单958和CB15098可溶性碳水化合物含量较对照分别极显著降低了43.2%,21.7%,38.8%和51.5%,37.8%,58.1%;C2处理使郑单958的MDA含量较对照显著降低9.5%,C1处理使CB15098的MDA含量较对照显著降低23.3%。
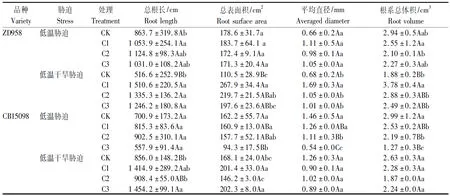
表2 不同浓度赤霉素处理对萌发期玉米籽粒根系形态性状的影响Tab.2 Root morphology of maize seedlings ith different concentration of gibberellin

图4 不同浓度赤霉素处理对幼苗可溶性碳水化合物和丙二醛含量的影响Fig.4 Water-soluble carbohydrate content andmalonaldehyde content of seedlings under chilling anddrought stress with different concentration of gibberellin
3 结论与讨论
赤霉素是一种高效植物生长调节剂,有助于打破种子休眠,提高发芽率[18]。本研究发现不同浓度赤霉素浸种均能提升低温或低温干旱胁迫下的发芽势,但赤霉素浸种对抗寒性较弱的CB15098的发芽势促进效果更显著,且抑制了室温下的两品种发芽率,说明赤霉素浸种可以作为低温地区的播前抗寒准备工作,低温胁迫下提高浸种的赤霉素溶液浓度,或低温干旱复合胁迫下降低赤霉素浸种浓度效果更佳。赤霉素最突出的生理效应是促进茎的伸长,在禾本科作物玉米[19]、水稻[20]和小麦[21]上均有研究显示赤霉素浸种或喷施有助于促进地上部伸长,本研究发现,赤霉素浸种在低温胁迫和低温干旱胁迫下均不同程度促进了幼苗地上部的伸长,表明逆境条件下增施外源赤霉素仍然具有促进茎伸长的效果。地上部长度对赤霉素浸种的响应差异一方面是品种间抗寒性的差异造成的,本研究中低温胁迫和低温干旱胁迫下对照处理的郑单958发芽势和发芽率均高于CB15098,郑单958表现出较强的抗寒耐寒能力;另一方面可能是品种间的赤霉素敏感度差异造成的,有研究发现陕单902和农大108之间的化控调节剂敏感性不同是造成其株高和茎粗对化控试剂的响应差异原因之一[22]。本研究中,无论地上部高度绝对值还是赤霉素浸种后地上部高度的增幅郑单958均大于CB15098,说明郑单958地上部高度的赤霉素敏感性更强。
低温胁迫会导致吸胀冷害,造成种子物理性损伤[23]和种子活力下降[24],降低出苗率,并抑制随后的苗期生长[25]。玉米籽粒萌苗期遭遇干旱胁迫会改变萌发环境的水分状况。有研究认为,籽粒萌发阶段,干旱胁迫发生时种子萌发环境的水分含量下降,种子的吸胀速率降低,延缓或减轻了低温胁迫引发的吸胀冷害。前人研究发现,5 ℃低温下吸胀期油菜种子通过适当降低土壤水势有利于种子萌发[26],本研究发现叠加干旱胁迫会进一步降低低温胁迫下的两品种的发芽势,这可能是由于玉米籽粒体积大,吸胀时间长,使得吸胀冷害的发生概率和强度大于油菜籽粒。也有研究显示,低温不影响蒸腾作用但会造成根系吸水困难,进而引发生理性干旱,低温干旱并发会加剧作物的干旱胁迫强度。有研究显示苗期干旱胁迫强度的增加导致株高的显著下降[27],低温胁迫也明显抑制了地上部生长[28]。本研究发现,对于不喷施赤霉素的对照处理,低温干旱双胁迫较单一低温胁迫极显著降低了地上部高度,表明苗期遭遇低温干旱双胁迫的危害要强于单一胁迫。本研究同时还发现双胁迫下可溶性碳水化合物含量下降,可溶性碳水化合物作为主要渗透调节物质,其含量降低导致细胞质浓度降低[29],使膜透性增加,破坏膜的稳定性[30],也证明干旱胁迫会加重低温对苗期玉米的胁迫程度。

