胃癌组织中胃癌相关成纤维细胞、胃正常成纤维细胞的分离鉴定及增殖情况观察
封兰兰,孙伟,朱吉海,刘珺,赵珺,刘燕
(青海大学医学院,西宁810016)
目前大多数肿瘤相关的研究是以单克隆细胞系和动物模型为对象进行信号通路及药理作用等方面的报道,而忽略了肿瘤微环境(TME)对癌细胞及人体的影响。研究认为上皮性肿瘤的发生发展与慢性炎症[1]、间质老化[2]、自噬[3]及癌相关成纤维细胞的激活[4]等TME改变密不可分。TME包括肿瘤间质细胞及细胞外基质,癌相关成纤维细胞(CAFs)是肿瘤间质细胞的重要组成部分,其可通过分泌生长因子、细胞因子及趋化因子等与肿瘤细胞产生交互作用,进而促进肿瘤的发展。CAFs是食管腺癌[5]、结直肠癌[6]预后差的重要标志。胃CAFs、胃NFs的原代培养及鉴定可为肿瘤微环境的深入研究提供实验基础。组织块分离法、胶原酶消化法是常用的细胞原代培养方法。免疫细胞化学染色法是临床常用的细胞鉴定方法。癌组织原代培养过程主要是癌细胞和成纤维细胞的生长。细胞角蛋白18(CK18)广泛表达于腺上皮细胞,而波形蛋白(Vimentin)在上皮细胞中不表达,在间质细胞内广泛分布。α-平滑肌肌动蛋白(α-SMA)是区别CAFs和NFs的重要蛋白标记物[7]。目前有关胃癌CAFs对胃癌细胞增殖、侵袭及转移的促进作用已有较多相关报道,但胃CAFs及胃NFs的原代培养、鉴定及二者生物学特性比较的相关研究较少。本研究我们分离纯化胃CAFs、胃NFs,并分析其细胞形态、细胞表型及增殖活性等方面的差异。
1 材料与方法
1.1 胃癌组织标本来源 选择于青海大学附属医院手术室进行胃癌切除术的3例患者,术前均未进行放化疗及其他相关治疗,胃癌组织离体后,用无菌剪刀分别剪取肿瘤组织(与正常黏膜交界区的质软肿瘤区域,避开坏死区)及肿瘤远端胃正常黏膜组织,置于盛有含10% 双抗的无菌F12/低糖DMEM培养基的离心管内,标记并密封后4 ℃保存备用。本研究获得青海大学附属医院伦理委员会的批准,所用标本征得患者家属的同意并签署知情同意书。
1.2 试剂 F12培养基,低糖DMEM培养基,胰蛋白酶,青霉素/链霉素双抗均购自Hyclone公司;胎牛血清、hEGF、L-谷氨酰胺均购自美国Gibco公司;Ⅱ型胶原酶及Ⅳ型胶原酶购自Biosharp公司;鼠抗CK18抗体及鼠抗Vimentin抗体均购自迈新公司,鼠抗α-SMA购自博士德公司,辣根过氧化物酶标记的抗鼠兔通用型二抗及二氨基联苯胺(DAB)购自DAKO公司。
1.3 胃CAFs、胃NFs的分离纯化
1.3.1 胃癌组织及胃正常黏膜组织处理 在超净台内用含10%双抗的无菌PBS冲洗组织块,用无菌眼科剪将组织块剪成1 mm左右的组织块,分成两份,备用。
1.3.2 胃CAFs、胃NFs分离方法 取两份组织,分别采用组织块贴壁法、胶原酶消化法培养胃癌CAFs、胃NFs。①组织块贴壁法 将组织块均匀平铺于无菌培养皿,加入少量含10%胎牛血清,1%双抗,1% hEGF及1% L-谷氨酰胺的F12/低糖DMEM培养基(F12/低糖DMEM比例为1∶1),使培养皿内的组织块保持湿润,将培养皿放入5% CO2、37 ℃细胞培养箱,4 h后加培养基至没过组织块,24 h后更换培养基,隔1 d换液一次。②胶原酶消化法:组织块用含0.2% Ⅳ型胶原酶和0.1% Ⅱ型胶原酶的F12/低糖DMEM培养基37 ℃消化3 h,200目的无菌滤器过滤后离心5 min(1 000 rpm/min),倒出上清,PBS重悬沉淀并离心两次,将沉淀用含10%胎牛血清的培养基重悬置于培养皿内,24 h后换培养基,隔1 d换一次培养基。
1.3.3 胃CAFs、胃NFs细胞传代及差速贴壁方法 培养皿内原代培养细胞长满后,弃掉培养基,PBS冲洗后加入1 mL胰蛋白酶,消化细胞2~3 min,倒置显微镜观察,待50%细胞变圆变亮后吸走胰蛋白酶,培养基吹打混匀细胞后置入新培养皿,细胞贴壁20 min后将培养基转入下一培养皿,原培养皿内加入培养基;重复上述操作1次。
1.4 胃CAFs、胃NFs的鉴定方法
1.4.1 细胞形态观察 分别取贴壁24 h、培养15 d、第4代传代细胞,采用显微镜观察培养的细胞形态。
1.4.2 细胞α-SMA、CK18、Vimentin检测方法 采用免疫细胞化学染色法。取第4代传代细胞,加入24孔板内培养两到三天后,弃掉培养基,PBS冲洗两遍,4%多聚甲醛固定细胞30 min,3 mL/L H2O2孵育10 min,5%脱脂奶粉封闭1 h;滴加鼠抗CK18抗体、鼠抗Vimentin抗体、鼠抗α-SMA抗体(1∶200),4 ℃孵育过夜;PBS洗涤4 5 min,二抗室温孵育30 min,DAB显色2 min,显微镜观察细胞α-SMA、CK18、Vimentin。CK18细胞质及细胞膜呈棕黄色为阳性表达、Vimentin、α-SMA细胞质呈棕黄色为阳性表达。
1.4.3 细胞增殖情况观测 采用MTT法。分别取3份组织(GC1、GC2、GC3)分离出来的三组细胞。细胞生长至对数期时,胰酶消化细胞制成细胞悬液,细胞计数后按每孔2 000个接种于96孔板,每组重复4孔,每板设2个空白对照孔;分别于细胞贴壁 1、2、3、4、5、6 d,10 μL/孔 MTT溶液(终浓度5 mg/mL)加入待测孔,培养箱内孵育4 h,200 μL/孔二甲基亚枫(DMSO)溶解结晶,并室温振摇15 min,490 nm处测光密度OD值,绘制细胞生长曲线。

2 结果
2.1 胃CAFs、胃NFs细胞形态 贴壁24 h时镜下以上皮样细胞为主,随培养时间推移,成纤维样细胞开始增多,上皮样细胞相对变少。培养第15天,镜下成纤维样细胞较多。传代第4代细胞,镜下未见明显上皮样细胞,胃CAFs形态多样化,大小不一,呈梭形或星状,细胞表面可见不规则突起,排列不规整,细胞重叠生长。胃NFs细胞生长速度较慢,大小、形状均匀一致,呈长梭形,排列规则。
2.2 细胞CK18、Vimentin、α-SMA表达情况 胃CAFs细胞存在α-SMA、Vimentin阳性表达,CK18阴性表达,胃NFs 细胞存在Vimentin阳性表达,α-SMA、CK18阴性表达。
2.3 胃CAFs、胃NFs细胞的OD值比较 不同培养时间胃CAFs、胃NFs细胞OD值比较见表1。第2~4天胃CAFs、胃NFs细胞生长速度快,处于细胞生长对数期,第5天以后胃CAFs、胃NFs细胞生长平缓,趋于稳定。
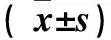
表1 不同培养时间胃CAFs、胃NFs细胞的OD值比较
注:与同来源时间NFs比较,*P<0.05。
3 讨论
CAFs作为肿瘤微环境的重要组成部分,其在肿瘤发生发展过程中的作用备受关注。研究[8]发现CAFs可通过血管抑制蛋白2(Vash2)上调EREG和IL11的表达促进胃癌的发生;通过刺激肿瘤微环境中血管的生成促进舌癌细胞的侵袭和转移[9];通过细胞之间的直接交互作用或分泌可溶性因子促进胰腺癌细胞增殖、存活及上皮间质转化(EMT)[10],且与肿瘤预后不良有关的许多标记分子均来自CAFs[11]。Hanley等[12]发现抑制NADPH氧化酶4(NOX4)后可阻止成纤维细胞内活性氧簇的产生,从而抑制其分化为CAFs。NOX4抑制剂具有抑制糖尿病肾病患者肾脏纤维化的作用,并且在Ⅱ期临床试验中取得成功,但其在胃癌等肿瘤中的临床应用还未见报道。胃癌CAFs的原代培养和分离纯化将为肿瘤微环境与胃癌细胞之间的作用机制研究及临床肿瘤药物的靶标研究提供良好的基础。
本课题拟通过对胃癌新鲜组织标本的培养获得原代胃癌CAFs和胃NFs,为后期研究提供可靠的细胞模型。原代培养过程中,组织块贴壁法和胶原酶消化法均能成功获得原代胃癌CAFs及胃NFs。经比较,我们发现组织块贴壁法经济简单,但是组织块贴壁后加液时间及加液量较难把控,掌控不好则可能导致组织脱离瓶底或细胞存活率低;胶原酶消化法成本较高,不适用于大量的原代细胞培养实验,但是可操作性强,细胞容易贴壁。
通过形态学观察,发现胃癌CAFs细胞形态多样,大小形状不一,呈梭形或星形,细胞表面可见不规则突起,排列不规则并呈重叠生长;胃NFs细胞均匀一致,呈长梭形,排列规整CAFs细胞形态的多样性可能与其起源有关。目前关于肿瘤内CAFs的起源说法不一,有研究[13]认为CAFs来自中胚层前体细胞,CAFs由纤维细胞、内皮细胞、骨髓间充质细胞及平滑肌细胞分化而成[14]。正常情况下,成纤维细胞在人体胃黏膜组织内处于静息状态,即为NFs,胃黏膜受损伤时(如胃溃疡等),成纤维细胞被激活并增生,而当肿瘤发生后,远距离的骨髓间充质细胞被激活为CAFs,并聚集在肿瘤周围[15]。还有学者[14]发现内皮细胞及平滑肌细胞均可被活化,转化为CAFs,这些起源细胞均属于间质细胞。为进一步鉴定CAFs及NFs均起源于间叶组织,而非上皮来源,本研究用抗Vimentin和抗CK18对CAFs及NFs进行免疫细胞化学染色,Vimentin主要存在于间质细胞中,广泛表达于间叶组织来源的细胞;CK18是分布于上皮细胞的中间丝蛋白,是显示上皮分化的有用指标。结果显示CAFs及NFs均表达Vimentin,不表达CK18,说明培养的细胞为间质细胞,不是上皮细胞。有研究发现活化的CAFs在胰腺癌中α-SMA呈阳性表达,并且胰腺癌CAFs主要由胰腺组织内星形细胞活化而来[16]。本研究结果显示α-SMA在胃CAFs细胞中呈阳性表达,胃NFs细胞中呈阴性表达,α-SMA是鉴别CAFs细胞和NFs细胞的重要标记物,此蛋白具有调节肌成纤维细胞收缩的功能,这一结果说明CAFs细胞可能比NFs细胞伸缩性强,并且Erdogan等[17]在胶原凝胶收缩实验中发现CAFs细胞的伸缩性高于NFs细胞。Chen等[18]发现过表达α-SMA的CAFs与鼻咽癌的预后差有关,α-SMA在胃CAFs细胞促进胃癌发展中的作用机制目前还不清楚,这有待于进一步研究。
在食管癌、宫颈癌、乳腺癌CAFs与NFs细胞生物学特征比较的研究[19]中,均发现CAFs细胞增殖速度明显高于NFs细胞,为了解胃CAFs与胃NFs之间细胞增殖速度是否存在差异,本研究采用MTT法检测胃CAFs与胃NFs细胞增殖情况,并绘制细胞生长曲线,发现胃CAFs细胞生长速度显著高于胃NFs细胞。这说明异常增殖是胃CAFs的生物学行为特征之一,因此胃CAFs可作为胃癌治疗的新的靶标。在乳腺癌CAFs的相关研究中发现,乳腺癌CAFs的异常增殖归因于氧化应激,而共济失调性毛细血管扩张症突变蛋白(ATM)作为重要的氧化还原传感器,氧化性ATM在CAFs异常增殖中起着重要作用,它可以参与DNA损伤应答及细胞稳态的调节[20]。而胃CAFs异常增殖的机制还需进一步深入研究。
综上所述, 成功分离胃CAFs、胃NFs。胃CAFs生长速度快,胃CAFs、胃NFs均存在Vimentin表达。胃CAFs细胞特异性表达α-SMA。胃CAFs增殖能力优于胃NFs。

