神经干细胞条件培养基对氧化应激损伤小鼠皮层神经元的作用
叶松庆,李永全
神经干细胞是一类具有自我更新和神经方向分化能力的干细胞,在成体中脑室下区和海马齿状回颗粒下层[1]大量存在,是生物替代损伤神经组织的干细胞池。其独特的神经修复能力使得神经干细胞移植成为多种神经性疾病的最具潜力的治疗手段,包括神经损伤性疾病,如颅脑损伤和脊髓损伤,以及神经退行性疾病,如帕金森氏病、阿尔滋海默症等[2],使用神经干细胞移植的方法在基础实验方面均取得了较好的治疗效果。然而,由于神经干细胞取材困难,且具有一定的伦理学问题,加上外源性细胞移植往往由于宿主免疫排斥反应以及损伤病理微环境本身对移植细胞生长的不利影响[3],使得神经干细胞移植的临床转化面临困境[4]。考虑到神经干细胞移植的修复机制除了替代原有神经组织,另外还存在其旁分泌产物产生的免疫调理和神经营养支持等作用[5]。有研究表明,神经干细胞条件培养基能够在体外增加巨噬细胞M2型表达,减少M1型的活化,同时抑制多种炎症因子释放[6]。同样,体内实验也表明,给予脊髓损伤大鼠注射神经干细胞条件培养基能够增加皮质脊髓束和中间神经元之间的桥接,减少神经元凋亡,促进运动功能恢复[7]。因此,使用神经干细胞包含其旁分泌产物的条件培养基替代原有细胞移植成为一种新的治疗策略,可以避免上述诸如伦理学、移植细胞存活以及细胞保存、运输等一系列问题,具有较强的临床应用价值。氧化应激损伤是多种神经系统疾病的共同病理过程[8],可以产生诸如:氧离子、过氧化物和含氧自由基等活性氧(reactive oxygen species,ROS),造成神经元的广泛坏死和凋亡,其中过氧化氢(hydrogen peroxide,H2O2)由于分子稳定性较高,常被用于构建体外的氧化应激损伤模型。研究发现多种干细胞在移植后均能够降低病理性氧化应激反应[9],而这一效果可能是通过其旁分泌机制实现的。本研究通过构建小鼠皮层神经元的氧化应激损伤模型,探讨神经干细胞条件培养基对其保护作用,为多种神经损伤和神经退变性疾病寻找新的细胞替代疗法,具有较强的临床应用价值。
1 材料和方法
1.1 材料 C57BL/6新生鼠(P0-P1)60只,雌雄不限,由北京市军事医学科学院四所提供。Neurobasal培养基(美国GibcoTM)、DMEM培养液(美国GibcoTM)、N2细胞培养添加剂、表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、B27、L-glutamines(L-G)、青 /链霉素(P/S)、胰蛋白酶、胎牛血清(FBS)、多聚赖氨酸、盖玻片、Tuj-1抗体(美国Sigma)、Nestin抗体(美国Sigma)、4’,6-二脒基-2-苯基吲哚(美国 Invitrogen)、Hoechst 33342(美国 Invitrogen)、ROS检测试剂盒(美国abcam)、Image J图像分析软件(美国NIH)。
1.2 细胞培养 神经干细胞原代培养:无菌条件下取新生鼠大脑浸泡于DMEM+2% P/S中,置于冰上;分离完整的海马组织,加入0.05%胰蛋白酶消化,10% FBS中止消化,用玻璃移液管吹打均匀;离心弃上清后2 mL神经干细胞培养基(Neurobasal+2% B27+1% N2+20 ng/mL EGF+20 ng/mL bFGF+1% P/S)重悬;每3天半量换液。神经干细胞鉴定:50 μg/mL多聚赖氨酸铺板,神经干细胞形成的细胞球种植6 h,4%多聚甲醛固定,封闭1 h,GFAP和Nestin一抗4 ℃过夜,PBST缓冲液清洗,加二抗及DAPI染色1 h,树脂封片,荧光显微镜下观察。小鼠皮层神经元培养:无菌条件下取新生鼠大脑浸泡于DMEM+2% P/S中,置于冰上;去除小脑、嗅球等,仔细剥离脑膜,加入0.05%胰蛋白酶消化,10% FBS中止消化,用玻璃移液管吹打均匀;种于多聚赖氨酸铺板的培养板上,使用神经元培养基(Neurobasal+2% B27+1%L-G+1% P/S)培养,每3天半换液。
1.3 分组 细胞共分为4组,随机分为4组:对照组(Control组)使用神经元培养基持续培养;单纯氧化应激实验组(H2O2组)加入1 mmol/L过氧化氢孵育1 h后更换神经元培养基;神经干细胞条件培养基干预组(H2O2+NSC-CM组)加入1 mmol/L过氧化氢孵育1 h后,更换半量神经干细胞条件培养基及半量神经元培养基;神经干细胞普通培养基干预组(H2O2+NSC-FM组)在加入H2O2孵育1 h后,更换半量未培养细胞的神经干细胞培养基及半量神经元培养基,去除B27、EGF等因子影响,各组实验24 h后进行观察和各项指标的测定。
1.4 检测指标
1.4.1 细胞活性检测 细胞活性检测采用CCK8法,在干预24 h后皮层神经元的96孔板中分别加入10 μL CCK溶液并培养箱内孵育2 h,使用酶标仪测定样品在波长450 nm处的OD值,各数值与对照组比较并按占对照组的百分比表示。
1.4.2 细胞凋亡检测 细胞在干预后24 h,4%多聚甲醛固定,加入5 μg/mL的Hoechest 33342孵育30 min,荧光显微镜观察细胞核形态变化,根据细胞核固缩情况评估细胞凋亡所占比例。
1.4.3 神经元形态分析 干预后小鼠皮层神经元4%多聚甲醛固定,封闭1 h,Tuj-1一抗4 ℃过夜,PBST缓冲液清洗,加二抗及DAPI染色1 h,树脂封片,荧光显微镜下观察。使用Image J软件计算最长神经突长度,并使用软件中Sholl模块对神经元距离胞体不同距离神经突数量进行分析。
1.4.4 活性氧检测 使用ROS试剂盒进行检测,在种植好皮层神经元的96孔板中分别加入100 μL红色ROS显色液并培养箱内孵育1 h,在H2O2及培养基干预后使用荧光分光光度计进行检测(Ex/Em=520/605 nm)。
1.5 统计学分析 数据以均数±标准差形式表示,使用GraphPad Prism 6进行统计分析,统计方法使用单因素方差分析(One-way ANOVA),事后使用Tukey法分析组间差异,P<0.05表示差异具有统计学意义。
2 结果
2.1 神经干细胞形态及鉴定 神经干细胞生长逐渐形成神经球,经过多次传代,可进行条件培养基的提取。使用多聚赖氨酸覆盖的盖玻片爬片后,固定及免疫荧光染色,如图1中A为光镜下神经干细胞形成的神经球,B可见神经球上神经干细胞特异性标记物Nestin阳性呈红色,C可见细胞核DAPI染色蓝色,D为Nestin和DAPI染色重合后的神经球形态。
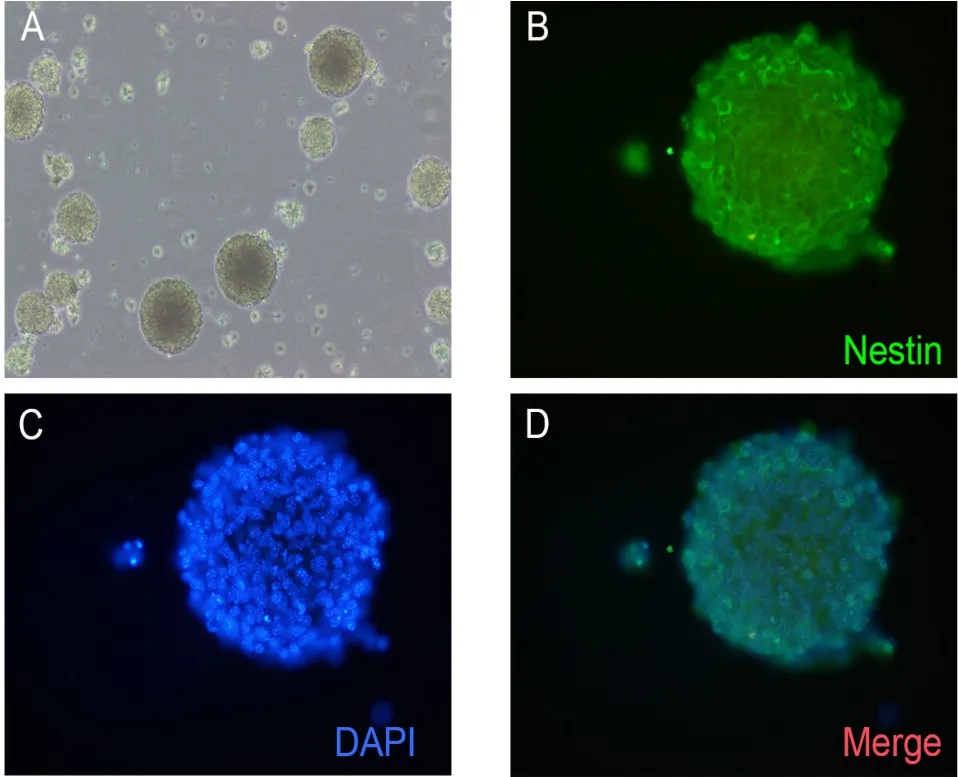
图1 小鼠神经干细胞形态及鉴定
2.2 小鼠皮层神经元存活情况分析 小鼠皮层神经元在经过H2O2氧化应激损伤后存活数量明显减少,使用CCK8对细胞存活情况进行量化分析发现,如图2所示,H2O2组(23.60±4.78)%和H2O2+NSC-FM组(25.00±5.92)%较Control组(100.00±1.41)%均明显减少(P<0.05),而使用神经干细胞普通培养基(NSC-FM)则与H2O2氧化应激损伤组无明显差异。H2O2+NSC-CM组(45.40±8.99)%则较H2O2组神经元存活比例有明显提升(P<0.05)。
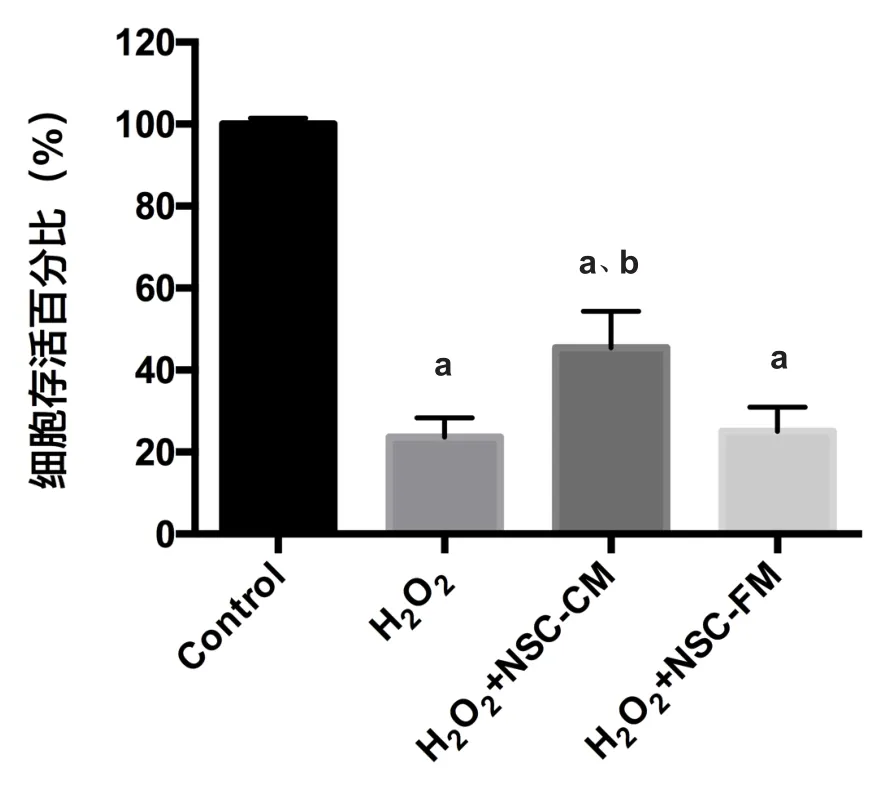
图2 小鼠皮层神经元存活情况分析
2.3 小鼠皮层神经元凋亡分析 使用Hoechest33342标记神经元细胞核后,如图3A中可见control组细胞核形态均匀,细胞核内荧光强度均一,加入H2O2出现核固缩现象,出现高密度荧光,细胞核形态不均一,加入神经干细胞条件培养基后核固缩现象减少,提示凋亡减少,加入神经干细胞普通培养基相较H2O2组无明显变化。通过计算各组出现凋亡细胞比例,如图3B所 示 H2O2组(69.00±5.43)% 和 H2O2+NSCFM组(62.20±9.31)%细胞凋亡比例较Control组(13.40±2.70)%均明显增加(P<0.05),而H2O2+NSC-CM组(38.40±9.61)%细胞凋亡比例较H2O2组则有明显减少(P<0.05),量化结果与荧光结果一致,即加入神经干细胞条件培养基能够一定程度上抑制H2O2导致的神经元凋亡。
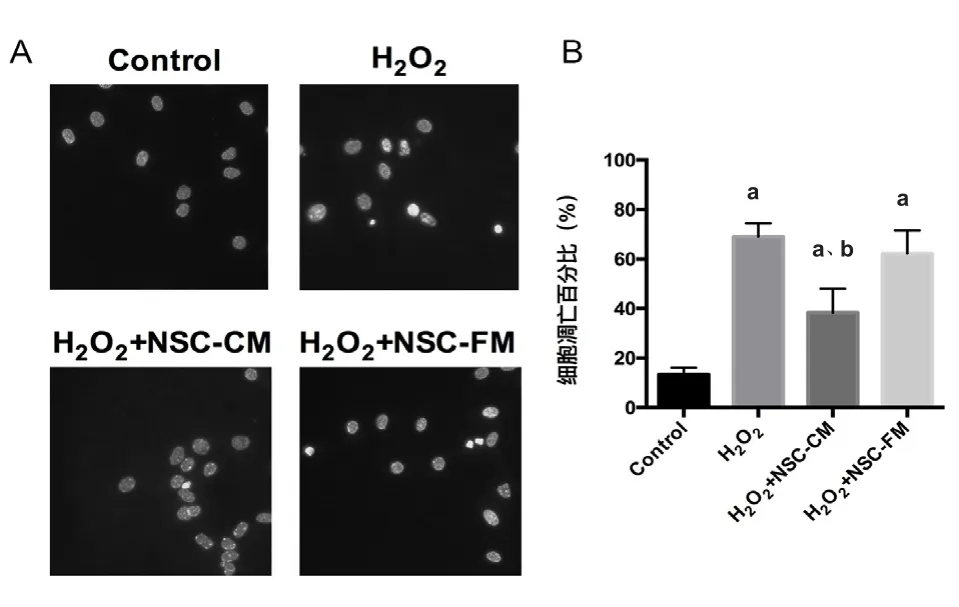
图3 小鼠神皮层神经元凋亡情况
2.4 小鼠皮层神经元形态分析 小鼠皮层神经元不同条件下免疫荧光染色,如图4A可见神经元特异性标志物Tuj-1阳性,神经元有较多突起;量化分析最长神经突长度,如图4B可见在H2O2组(28.15±4.16)μm和H2O2+NSC-FM组(27.05±4.67)μm 较 Control组(45.20±4.01)μm 明 显 缩 短(P<0.05), 而 H2O2+NSC-CM组(35.00±2.99)μm 较 H2O2组 则 有 明 显增加(P<0.05);使用sholl模块分析,结果如图4C所示,距离神经元胞体10、20、30、40、50 μm 范围H2O2组神经突数量(2.13±0.04、2.53±0.11、3.46±0.04、2.20±0.06、2.10±0.04)和 H2O2+NSC-FM 组(2.15±0.06、2.49±0.23、3.55±0.13、2.24±0.11、2.02±0.03)较 Control组(3.79±0.23、4.42±0.21、5.82±0.07、3.67±0.12、2.53±0.12) 均 减 少(P<0.05),H2O2+NSC-CM 组 神 经 突 数 量(2.54±0.10、3.26±0.06、4.21±0.06、3.08±0.02、2.47±0.18)较H2O2组则有一定增加(P<0.05)。
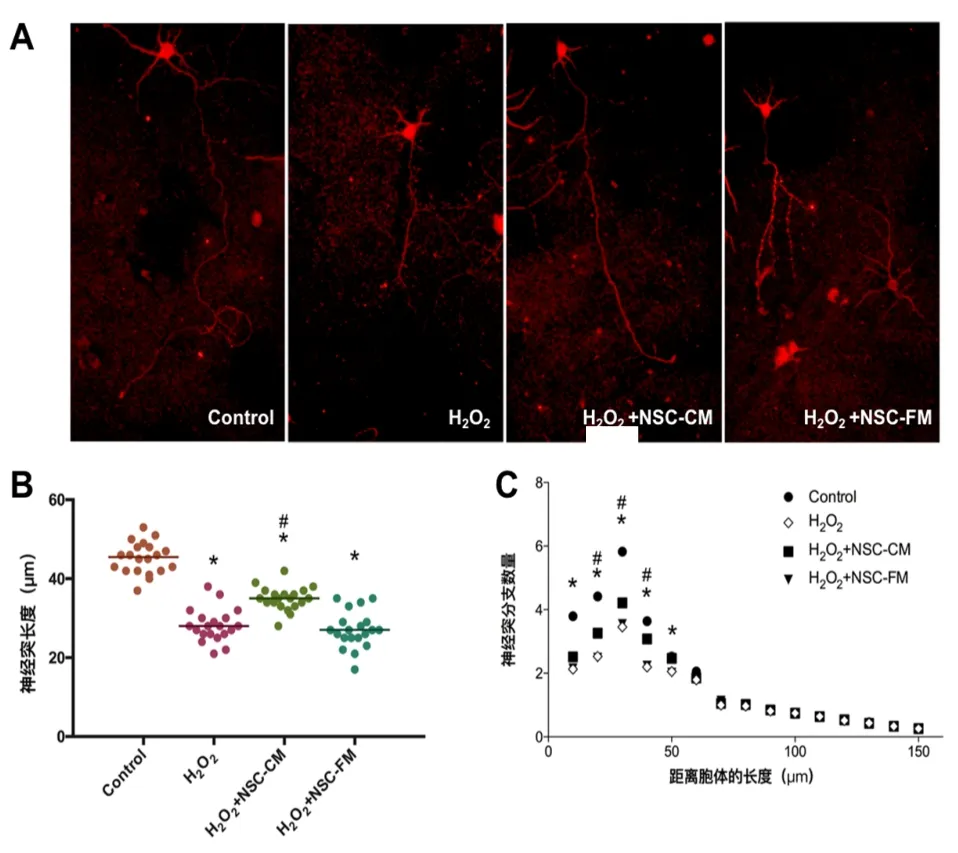
图4 小鼠神皮层神经元形态分析
2.5 小鼠皮层神经元活性氧测定 加入H2O2后神经元产生大量活性氧,使用ROS试剂盒检测,结果如图5所示发现H2O2组(69.00±5.43)%和H2O2+NSC-FM组(62.20±9.31)%细胞凋亡比例较Control组(13.40±2.70)%均明显增加(P<0.05),而 H2O2+NSC-CM 组(38.40±9.61)%活性氧生成较H2O2组则有明显减少(P<0.05)。
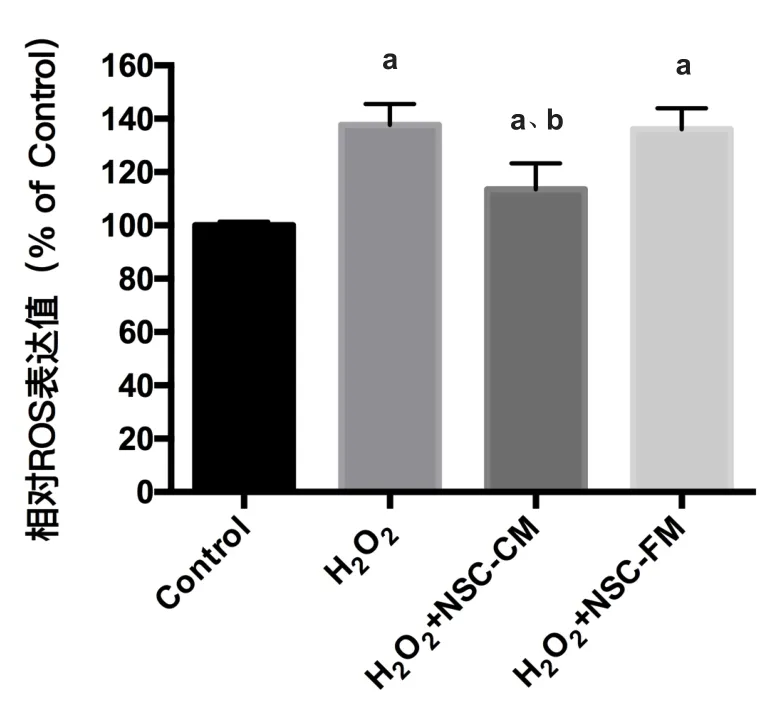
图5 小鼠皮层神经元活性氧测定
3 讨论
氧化应激损伤是神经系统常见的病理过程,在多种神经损伤性疾病和神经退行性疾病中引起严重的不良后果[10]。在病理状态下,机体产生的过多的氧离子、过氧化物和含氧自由基等活性氧可以造成神经细胞的坏死和凋亡。在诸多活性氧中,过氧化氢由于其相对稳定,被广泛用来构建细胞氧化应激的体外模型,进而帮助人们研究氧化应激的分子机制和探索有效的治疗策略。在本研究中,通过构建小鼠皮层神经元加入过氧化氢诱导的氧化应激模型,成功导致神经元存活减少,凋亡增加,活性氧产生增多等效果,为模拟脊髓损伤、脑损伤并寻找新的治疗方法提供了有效的体外研究模型。
神经干细胞是一类具有不断增殖、具有自我更新能力并且能够分化为神经元、星型胶质细胞和少突胶质细胞的干细胞,其在胚胎时期存在于多种神经系统中,而成体中存在于某些特定部位[11]。大量科学研究证明了神经干细胞作为种子细胞进行移植,能够修复多种神经损伤,并且在神经退行性疾病中发挥重要作用[12],目前认为神经干细胞发挥治疗作用的主要作用机制包括:替代坏死的神经组织,提供组织支架,优化微环境,分泌细胞外基质以及神经营养因子等[13]。目前研究认为,神经干细胞旁分泌产物,即其条件培养基,同样发挥重要的神经保护作用[14]。本研究中证实神经干细胞条件培养基能够保护神经元氧化应激损伤,能够减少过氧化氢导致的神经元凋亡,并且保护神经元神经突的长度和数量,并且证明这一机制是通过减少神经元氧化应激损伤时内源性活性氧增加发挥神经保护作用的。
在多种神经病理状态时,如脑/脊髓损伤、帕金森氏病、阿尔滋海默病等,组织的缺氧可导致活性氧的产生增加,导致细胞坏死和凋亡,进而引起一系列临床不良表现。神经干细胞所处微环境氧浓度维持在1%~8%[15],相较一般细胞所处21%的氧浓度属于极度缺氧,这种缺氧被证实是维持神经干细胞多能性方面所必须的。缺氧本身对细胞的旁分泌会产生影响,旁分泌产物反而能够通过信号传递的方式使其他细胞增加对缺氧的耐受能力[16]。这一特征可能是神经干细胞条件培养基抑制神经元氧化应激损伤的原因。另外,神经干细胞能够分泌多种神经营养因子,包括脑源性神经营养因子、神经生长因子,神经胶质细胞源性的神经营养因子以及血管内皮生长因子等。而神经营养因子能够在一定程度上发挥抗氧化应激的作用。另外一种可能的神经保护机制就是神经干细胞条件培养基中含有许多分泌的细胞外囊泡,而多种细胞的细胞外囊泡,包括外泌体,在抗氧化应激方面能够发挥积极作用[17]。
本研究证实神经干细胞条件培养基在一定程度上能够缓解神经元氧化应激损伤,但是结果仍未能达到空白对照组的状态,未来的研究需要在以下几方面进一步优化和探索:首先是探索神经干细胞条件培养基中抗氧化应激的关键分子,然后是要在动物实验验证治疗效果,最后可以使用低氧或饥饿刺激或转基因等方式增强神经干细胞条件培养基作用效果,争取实现替代细胞治疗和临床转化。
本研究构建体外神经元氧化应激损伤模型,通过神经干细胞条件培养基干预,证明了神经干细胞条件培养基能够减少细胞凋亡,增加神经突长度和数量,减少活性氧形成,一定程度上减轻小鼠皮层神经元氧化应激损伤,具有一定的临床应用和转化价值。

