CD8+CD103+肿瘤浸润淋巴细胞在非小细胞肺癌中的表达及意义
陈 晓 魏 立 陈 重 务 森 李基伟
肿瘤进展是肿瘤内不同类型细胞相互作用的结果[1]。肿瘤浸润淋巴细胞 (tumor infiltrating lymphocytes,TILs) 是1种能抑制肿瘤生长的特殊类型细胞[2]。最近研究发现,肿瘤免疫治疗是1种有前景的癌症治疗方法[3]。CD8+ TIL被认为是免疫细胞直接杀死肿瘤细胞的效应器细胞以及免疫检查点阻滞的靶点。研究表明,较高数量的 CD8+ 细胞与各种癌症(包括肝癌、结肠癌和卵巢癌)更好的结局相关[4]。
研究证明CD103 在T细胞定位中具有重要作用,它被视为肠道、皮肤和女性生殖道中组织驻留 T 细胞的1个标志物[5-6]。较高数量的CD103+ T细胞为膀胱癌、子宫内膜腺癌和卵巢癌的有益预后因素[7]。
目前非小细胞肺癌(NSCLC)总体5年生存率只有10%~20%,局部复发和远处转移是导致肺癌患者死亡的主要原因[8]。CD8+和CD103+TIL在 NSCLC 中的作用尚不清楚。我们根据临床标本和动物模型对 CD8和CD103 双阳性TIL 进行研究,探索CD8 和 CD103 双阳性TIL对于 NSCLC 的预后价值和治疗价值。
1 材料与方法
1.1 NSCLC患者标本和随访资料
收集2005年7月至2011年2月在河南省人民医院手术切除的220例NSCLC组织。入组标准:所有患者术前均无化疗、放疗、靶向治疗及免疫治疗史,均随访5年。根据世界卫生组织 (WHO) 肺癌标准确定组织学诊断,肺癌TNM分期参照2015年NCCN指南。NSCLC 患者病理特征见表1。所有220例NSCLC 患者均纳入我们的随访队列,随访五年或随访至因NSCLC死亡。死于其他疾病或突发事件的患者作为生存研究中的删失数据。220例患者的随访中位时间为 22个月(范围:1~80个月)。把所有 220 例病例分为训练队列和测试队列,使用简单随机抽样法选择 115 例病例纳入训练队列,余 105 例纳入测试队列。
1.2 细胞培养
从Sigma-Aldrich 获取小鼠 NSCLC 细胞株 CMT64。使用加入2 mM谷氨酰胺、10% 胎牛血清和 1% 抗生素抗真菌溶液的Waymouth's MB 752/1培养基(美国,伊利诺伊州,Thermo Fisher Scientific)进行细胞培养。以 80% 的传代细胞铺满率进行继代培养。
1.3 小鼠模型
使用C57BL/6J免疫活性小鼠(6周龄,20~22 g,中科院上海实验动物中心)建立小鼠同种异体肺癌模型。将C57BL/6J衍生NSCLC细胞株CMT64细胞(2×106)接种至每只小鼠背部。接种后1周肿瘤开始发生。然后将小鼠随机分为4个实验组(每组n=10)。每7天一次,通过尾静脉将抗体(分别为50 mg/kg抗CD8抗体、50 mg/kg抗CD103抗体、50 mg/kg抗CD8抗体+50 mg/kg抗CD103 抗体、100 mg/kg小鼠IgG2a)注入这些组的小鼠体内。所有抗体均购自 Thermo Fisher Scientific(美国,伊利诺伊州)。每周检查肿瘤生长情况。根据长度和宽度计算肿瘤体积:宽度2×长度×π/6。出现大量腹腔积液、体重减轻超过 30% 和其他窘迫体征被视为观察终点。记录每只小鼠的生存期以进行生存分析。
1.4 免疫组化
采用免疫组化法检测患者标本中CD8 和CD103 的表达。通过二甲苯和乙醇浓度梯度脱去标本石蜡。将切片置于柠檬酸(pH=6.0)缓冲液中水浴10 min,进行抗原修复。然后在室温下将切片浸于5% BSA-PBS 溶液中30 min,以阻止非特异性结合。按照 1∶100 的比例将一级抗体制成稀释液,于 4 ℃下孵育过夜。然后加入辣根过氧化物酶标记的二级抗体,于室温下孵育1 h。应用 PBS 缓冲液冲洗3次后加入DAB。显色并经苏木精复染后,立即使用自来水冲洗。最后,将切片放置于光镜下观察。
1.5 免疫染色评分
分别计数每个显微镜视野中的阳性细胞数量。每份标本随机选择10个视野对阳性细胞进行计数。根据所有视野的阳性细胞平均数量进行析。
1.6 统计学分析
应用SPSS 19.0软件和GraphPad软件对所有数据进行分析。通过t检验对定量数据进行比较。使用卡方检验和 Fisher 精确检验对不同的率进行比较。使用 Spearman 秩相关检验计算相关性。使用 Kaplan-Meier 法评估 OS 差异。通过对数秩检验进行单变量分析。根据患者结局和死亡预测参数值,通过接受者操作特征 (ROC) 曲线分析确定阳性细胞数量的高低分界点[9]。首先确定训练队列的 CD8 和 CD 103 表达分界点,然后确认测试队列确定的分界点的预测值。双侧P<0.05有统计学意义。
2 结果
2.1 NSCLC中的CD8+和CD103+细胞
在所有病例中观察到不同的 CD8+和CD103+ 细胞数量。CD8+细胞和 CD103+细胞数量之间存在正相关 (γ=0.38,P<0.0001)。
然后将 CD8+ 细胞数量和 CD103+ 细胞数量转化为二进制数据,根据 ROC 曲线确定的分界点进一步分析。结果表明,训练队列CD8+ 细胞数量的最佳分界点为 24.5(>24.5 定义为阳性表达,< 24.5 定义为阴性表达),曲线下面积(AUC)为0.683〔95% 置信区间(95% CI):0.537-0.830〕。CD103+ 细胞数量的分界点为21.5(>21.5定义为阳性表达,<21.5 定义为阴性表达),AUC 为 0.634(95% CI:0.501-0.766)。将患者分为两组:CD8+ CD103+(两者均为阳性表达)组和“其他”组。分析 NSCLC 患者临床参数与 CD8 和 CD103 表达的关系。训练队列和测试队列双阳性表达的患者数量分别为 34例(29.6%)和3 例(36.2%)。随访结束时因为在NSCLC 死亡患者和存活患者之间检测到CD8和CD103表达的显著差异(训练队列和测试队列P值均<0.001)。与存活患者相比,死于 NSCLC 患者的双阳性表达比例较低(表 1)。
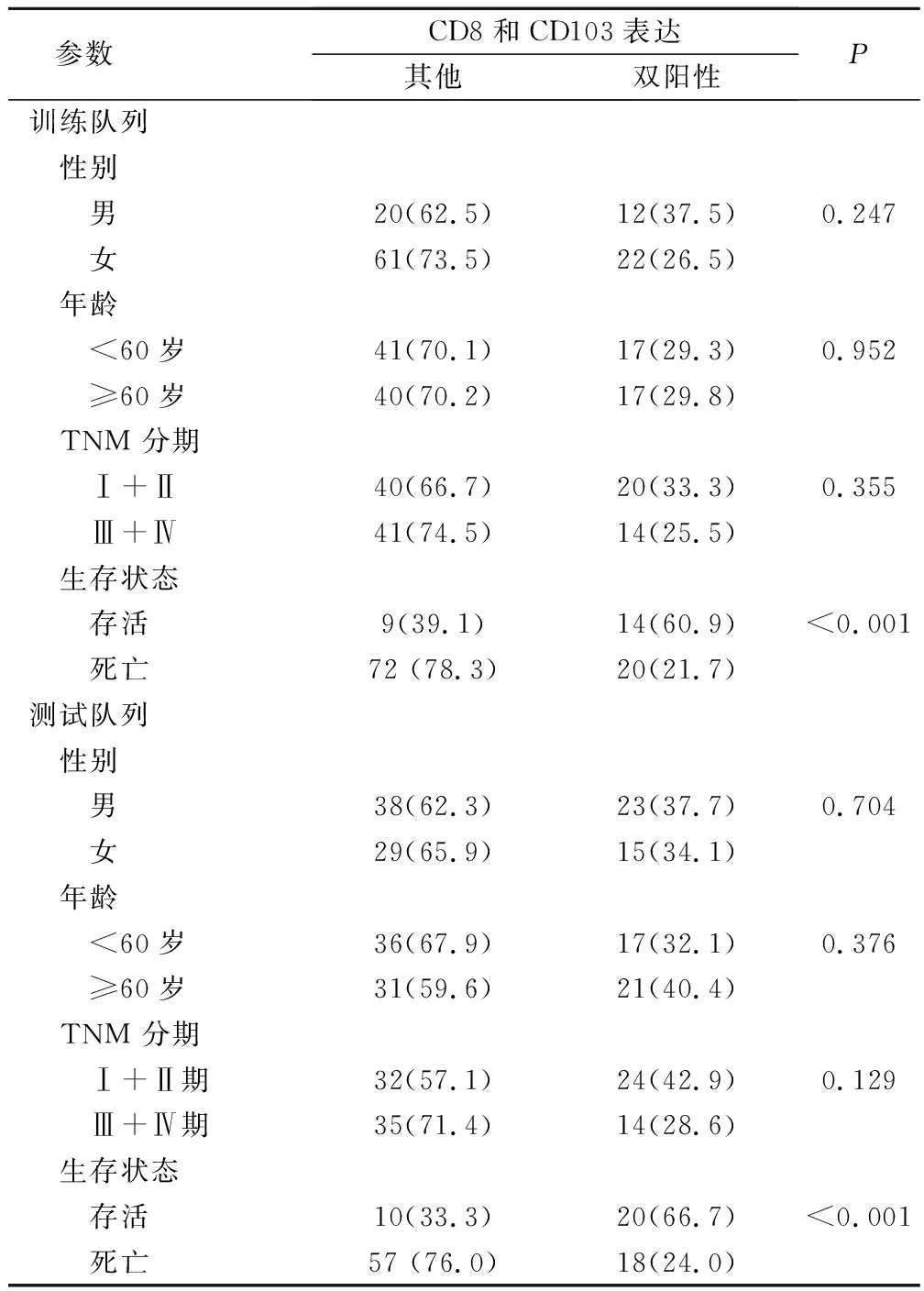
表1 CD8、CD103 表达与 NSCLC 临床病理特征的相关性(例,%)
2.2 CD8 和 CD103 双阳性表达是 NSCLC 的独立有益预后因素
在训练队列患者中,CD8+ CD103+组与其他组(CD8+ CD103-、CD8- CD103+和CD8- CD103-)的生存曲线有显著差异,P=0.001(图1)。同样,测试队列患者的生存曲线显示出相似的趋势:与其他表达模式的患者相比,CD8+ CD103+患者具有最佳的总生存期,P<0.001(图 2)。
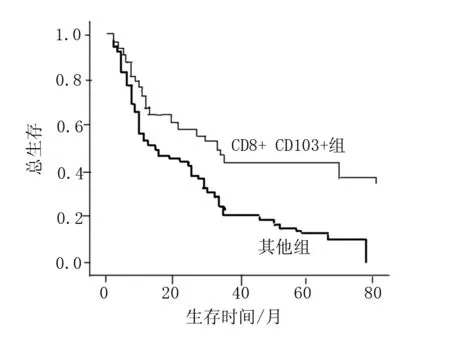
图1 训练队列患者中CD8+CD103+组与其他组的生存曲线

图2 测试队列患者中CD8+CD103+组与其他组的生存曲线
2.3 CD8+和CD103+细胞耗竭促进动物模型的肿瘤发展
小鼠模型研究数据表明,通过抗体耗竭CD8+或CD103+细胞将促进肿瘤生长。然而当CD8+和CD103+细胞均缺失时,肿瘤表现出最高的发展速度,生存期最短。CD8+和CD103+细胞耗竭也能减少抗肿瘤效应器分子(如 IFN-γ和颗粒酶B)的分泌。
3 讨论
肿瘤的发展依赖于肿瘤细胞与周围间质细胞(包括免疫细胞)之间的相互作用[10-11]。抗肿瘤免疫是一个需要多种免疫细胞参与的动态过程。因此,将更多的效应器细胞标志物纳入研究对于更好的预测预后来说非常重要。CD103是一种标志物,主要表达于瘤内 T 细胞和树突状细胞,这两种细胞都是抗肿瘤免疫的重要参与者。以往的研究强调了肿瘤组织中CD103+细胞在免疫治疗方面的意义[12]。CD103表达的预后价值也在一些类型的癌症中报告。本研究中,我们将CD8和CD103标志物结合起来研究其对于NSCLC的预后价值。
抗肿瘤免疫是一个需要不同免疫细胞参与协作的网络[13]。因此,为了研究CD8和CD103在NSCLC中的预后价值,我们对这两种标志物中的任一种或将其联合进行研究。与CD8或CD103相比,CD8和CD103组合具有最佳预测价值,表明CD8+和CD103+免疫细胞之间存在一定的协同效应。生存分析表明,与其他三种情况相比,CD8和CD103双阳性组有最好的结局。综合看来,所有这些数据突显出CD8和CD103组合在预测NSCLC患者结局方面的重要性以及它们对NSCLC发展的潜在保护作用。
为了进一步确认NSCLC中CD8+和CD013+细胞的保护作用,使用异种移植小鼠 NSCLC 模型进行了体内研究。通过消耗抗体抑制CD8+和CD103+细胞,观察到显著较快的肿瘤生长和较短的生存期。INF-γ和颗粒酶B是抗肿瘤免疫的关键效应器分子[14]。我们的数据表明,CD8+和CD103+细胞消耗也能减少它们的分泌。我们患者标本的分析结果强烈支持NSCLC中CD8+和CD103+细胞的保护价值。我们的研究结果与证实CD8+和CD103+细胞抗肿瘤重要性,CD8+ T 细胞为抗肿瘤免疫应答中的摘要效应器细胞,CD103+树突状细胞为肿瘤微环境中的主要抗原提呈细胞的其他研究一致[15]。
总之,我们的研究表明,CD8 和 CD103 结合分析的预后价值强于任一个标志物单独分析。肿瘤组织中较高数量的CD8+和CD103+细胞是NSCLC的有益预后因素。进一步的动物模型实验也支持NSCLC中CD8+和CD103+细胞的保护作用。

